新型甲壳素衍生物手性固定相的制备及其分离特性*
王晓晨,王昭群,张俊俊,陈 伟,柏正武(武汉工程大学化学与环境工程学院,湖北武汉 430073)
新型甲壳素衍生物手性固定相的制备及其分离特性*
王晓晨,王昭群,张俊俊,陈伟,柏正武
(武汉工程大学化学与环境工程学院,湖北武汉430073)
摘要:甲壳素与苯基异氰酸酯衍生物(2a~2d)经氨基甲酰化反应合成了4个新型的甲壳素苯基氨基甲酸酯衍生物(3a~3d),其结构经IR和元素分析表征。分别将3a~3c涂敷于大孔氨丙基硅胶表面(涂覆量均为16 wt%)制得相应的手性固定相(3a'~3c')。3a'~3c'对19个手性化合物的分离性能和耐用性能研究结果表明: 3a'~3c'的手性识别性能及耐用性均优于纤维素-三(3,5-二甲基苯基氨基甲酸脂)固定相。
关键词:甲壳素;制备;手性固定相;手性分离;耐用性
迄今,文献报道的手性固定相多达千种以上,其中多糖衍生物手性固定相由于其较强的光学拆分能力和对化合物的高负载量而备受关注[1]。研究最多的是用含芳香环异氰酸酯修饰纤维素、淀粉而生成的衍生物类手性固定相[2]。芳香环上取代基的位置、数目和种类对手性识别有较大影响[3-5],例如用3-氯-4-甲基苯基异氰酸酯(2b) 和5-氯-2-甲基苯基异氰酸酯(2d)修饰的淀粉和纤维素所制备的手性固定相具有很好的手性识别性能[5-6],而2b和2d未曾用于修饰甲壳素,也鲜见用4-三氟甲氧基苯基异氰酸酯(2a)和4-氯-3-三氟甲基苯基异氰酸酯(2c)修饰多糖,以及将其制备成手性分离材料。
如用2a~2d修饰甲壳素(1),生成甲壳素-二(氨基甲酸酯)衍生物的苯环上就连接着富电性基团(氟、氯)。这些基团能与众多手性化合物官能团发生作用,如氢键等,可能会产生手性识别。由于甲壳素衍生物比纤维素及淀粉衍生物在有机溶剂中更难溶胀、溶解,用其制备的涂敷型手性固定相应具有较好的耐用性[7-8]。
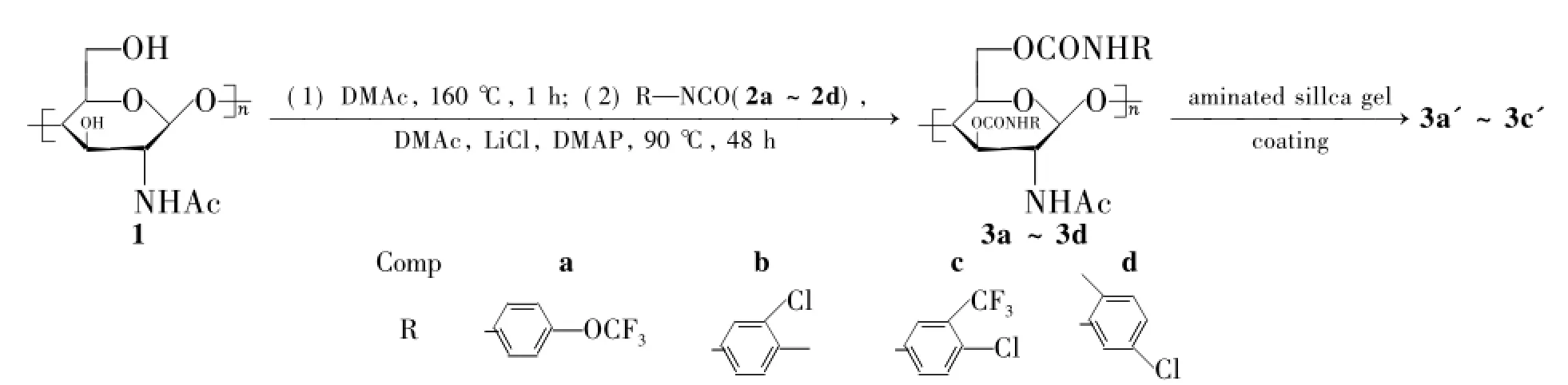
Scheme 1
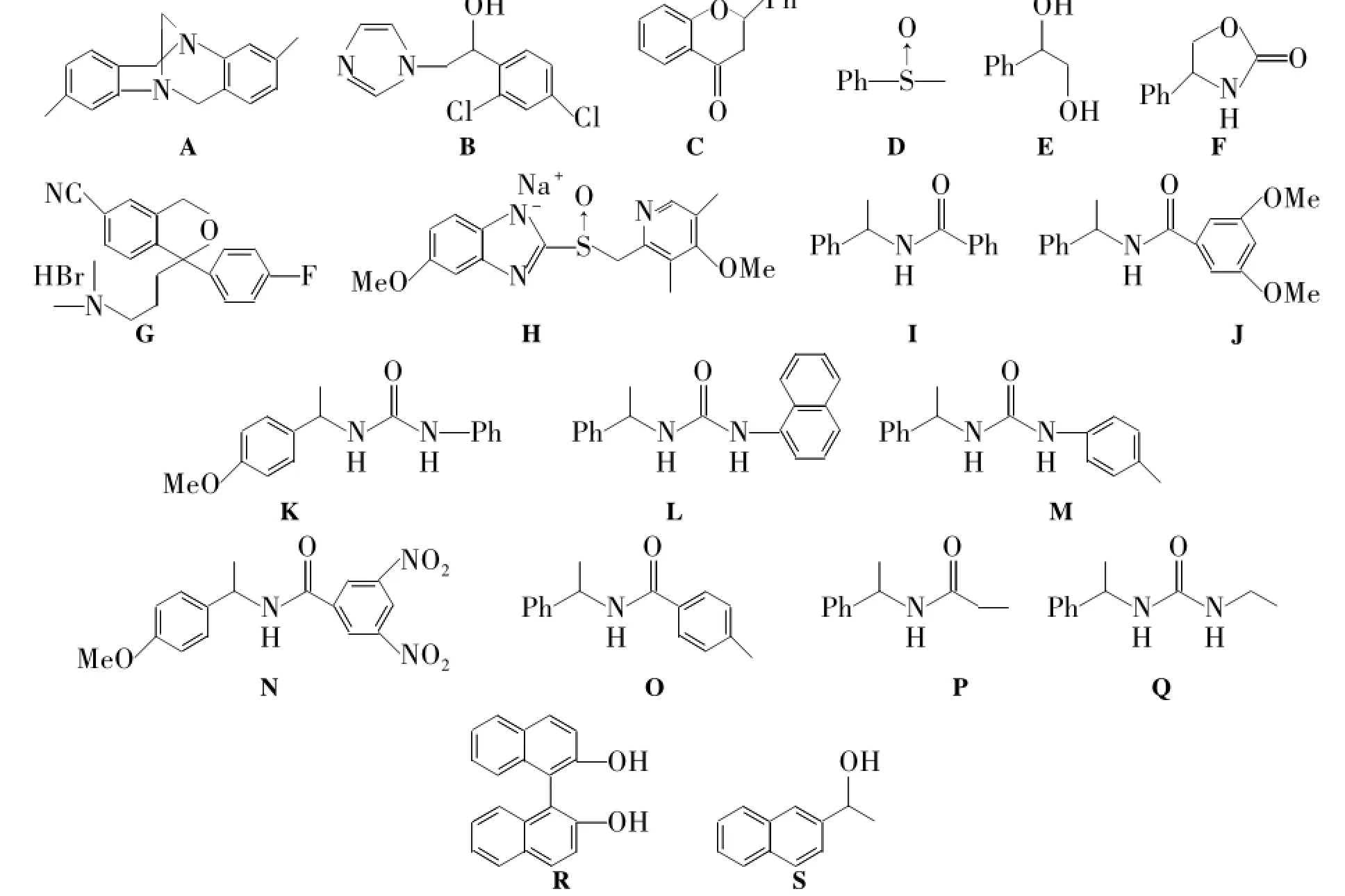
Chart 1
基于此,本文将1与2a~2d经氨基甲酰化反应合成了4个新型的甲壳素苯基氨基甲酸酯衍生物(3a~3d,Scheme 1),其结构经IR和元素分析表征。分别将3a~3c涂敷于3-氨基丙基硅胶(Ⅰ,涂覆量均为16 wt%)制得相应的手性固定相(3a'~3c')。并研究了3a'~3c'对19个手性化合物(A~S,Chart 1)的分离性能和对流动相的耐受性能。
1 实验部分
1.1仪器与试剂
Nicolet 5DX FT-IR型红外光谱仪(KBr压片) ; Elementar型元素分析仪; Alltech 1666型色谱柱填充泵;250 mm×4.6 mm不锈钢空色谱柱; Waters型高效液相色谱仪(600E泵,717 +自动进样器,996二极管阵列检测器,Empower色谱工作站)。
1,Sigma-Aldrich,干燥后置N,N-二甲基乙酰胺(DMAc)中于160℃活化1 h[10],冷却,过滤,滤饼用丙酮淋洗数次,于60℃干燥备用; 2a,2b和2d,濮阳市宏达圣导新材料有限公司; 2c,济南凯化化工有限公司; 3-氨丙基三乙氧基硅烷,百灵威科技有限公司;Ⅰ[11]和纤维素-三(3,5-二甲基苯基氨基甲酸脂) (Ⅱ)按文献[12]方法制备; A~S,江苏恩华药业股份有限公司,南通制药总厂或按文献[9]方法制备;硅胶(平均粒径7 μm,孔径100 nm),日本Daiso公司;其余试剂均为分析纯。
1.2 3a~3d的合成(以3a为例)
在反应瓶中加入1 2.0 g,LiCl 3 g和DMAc 30 mL,于80℃搅拌使其溶解(约需24 h) ;加入2a 6.0 g(2.0 eq)和催化量的4-N,N-二甲基氨基吡啶(DMAP),于90℃反应48 h。搅拌下将反应物滴入200 mL甲醇中,析出白色固体;过滤,滤饼用DMF(45 mL)溶解得溶液A。将A滴入甲醇中进行重沉淀,过滤,滤饼用甲醇洗涤,真空干燥得白色固体3a。
用类似的方法合成白色固体3b~3d。
甲壳素-二(4-三氟甲氧基苯基氨基甲酸脂) (3a) :产率75%; IR ν: 3 446~3 315(CONH),3 314~3 075(Ar-H),2 935~2 866(C-H), 1 734(),1 664,1 557(CONH,Ph) cm-1; Anal.calcd for (C24H21N3O9F6·0.5H2O)n: C 46.61,H 3.59,N 6.79; found C 46.18,H 4.18,N 6.11。
甲壳素-二(3-氯-4-甲基苯基氨基甲酸脂) (3b) :产率80%; IR ν: 3 456~3 286(CONH),3 172~3 065(Ar-H),2 943~2 860(C-H), 1 721(),1 661,1 524(CONH,Ph) cm-1; Anal.calcd for (C24H25N3O7Cl2·0.5H2O)n: C 52.66,H 4.79,N 7.68; found C 53.13,H 5.24,N 7.79。
甲壳素-二(4-氯-3-三氟甲基苯基氨基甲酸脂) (3c) :产率70%; IR ν: 3 446~3 276 (CONH),3 111~3 069(Ar-H),2 982~2 887 (C-H),1 730(),1 656,1 548(CONH, Ph) cm-1; Anal.calcd for (C24H19N3O7F6Cl2)n: C 44.60,H 2.96,N 6.50; found C 45.04,H 3.63,N 6.18。
甲壳素-二(5-氯-2-甲基苯基氨基甲酸脂) (3d) :产率70%; IR ν: 3 443~3 276(CONH),3 098~3 050(Ar-H),2 962~2 875(C-H), 1 734(),1 665,1 575(CONH,Ph) cm-1; Anal.calcd for (C24H25N3O7Cl2·0.5H2O)n: C 52.66,H 4.79,N 7.68; found C 52.10,H 5.51,N 7.87。
1.3 3a'~3c'和Ⅱ'的合成(以3a'为例)
在反应瓶中加入3a 0.53 g和DMF 30 mL,搅拌使其溶解得溶液B;取B 10 mL与Ⅰ.2.80 g混合均匀,减压蒸干;重复操作两次得3a'(涂敷量16 wt%)。分别将3b 0.53 g,3c 0.53 g和Ⅱ.0.70 g涂敷于Ⅰ(2.80 g)上,用类似的方法制得3b',3c'和Ⅱ' (由于3d干燥后难溶于DMF等有机溶剂中,无法涂覆,未制得3d')。
1.4手性柱的填充及色谱条件
用混合溶剂C[V(正己烷)∶V(异丙醇) = 2∶1]30 mL为匀浆液,以正己烷作顶替液,用填充泵分别将3a'~3c'和Ⅱ'以5 800 psi的压力填入色谱柱中。用1,3,5-三叔丁基苯为检测物测定死时间。用乙醇作溶剂配制手性样品(c 1 mg·mL-1),并经0.2 μm滤膜过滤。在色谱分离中,流动相的流速均为1 mL·min-1,柱温为25℃。其中,容量因子k =(tR-to) /to(tR为样品组分的保留时间,to为死时间) ;分配因子α= k2/k1(k1和k2分别为两个组分的容量因子) ;分离度Rs = 2(tR2-tR1) / (w1+w2) (tR1和tR2分别为相邻两个色谱峰的保留时间,w1和w2分别为两个峰的峰底宽)。
2 结果与讨论
2.1 3a'~3c'和Ⅱ'的手性分离性能
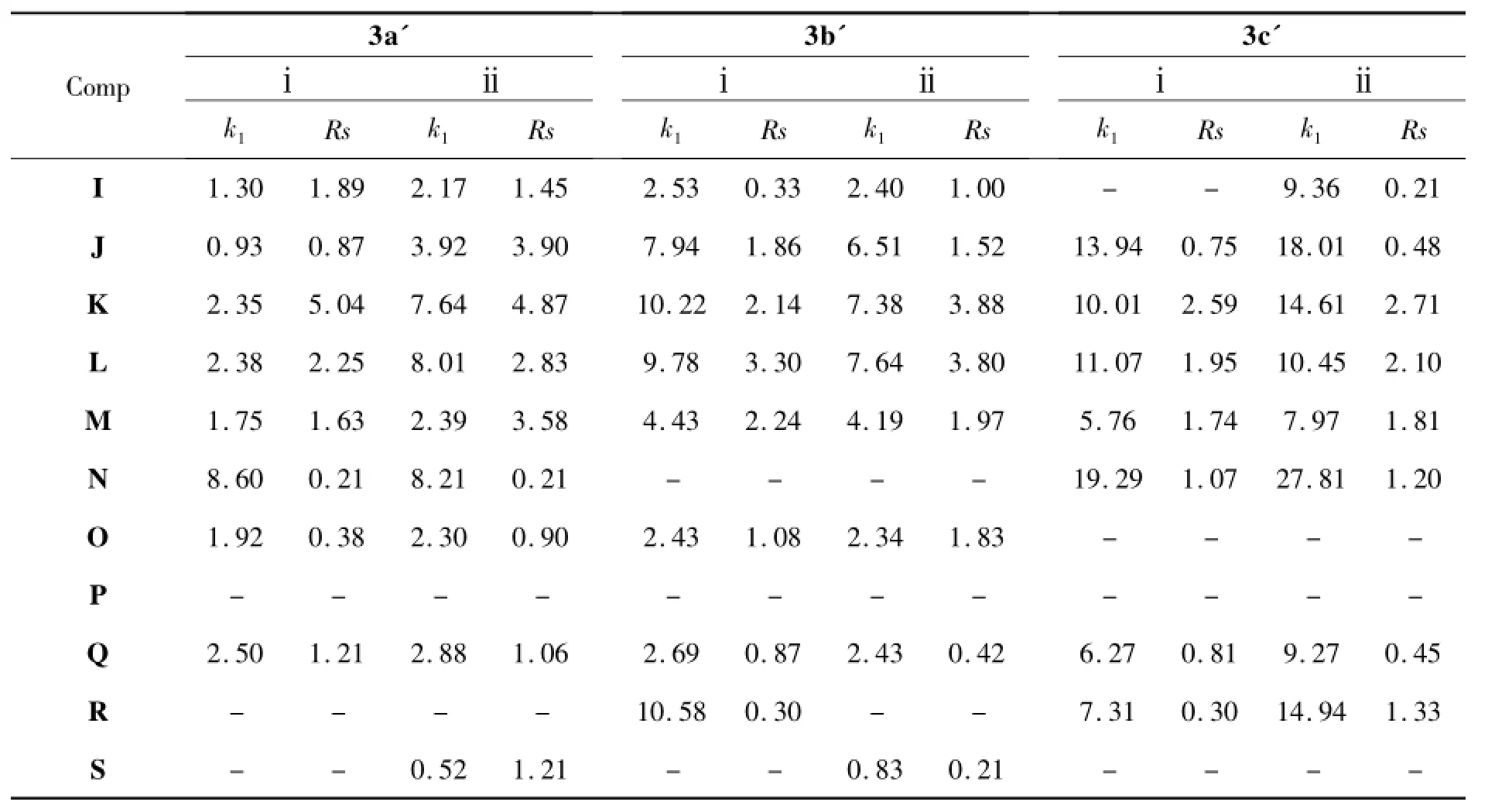
研究了3a'~3c'和Ⅱ'对A~S的手性识别性能,结果见表1。由表1可见,Ⅱ'具有很好的手性识别性能,并已商业化。从表1还可以看出,3a'~3c'和Ⅱ'分别识别了18个,17个,14个和16个手性化合物,其中分别有11个,13个,9个和6个化合物达到基线分离(Rs≥1.5)。被3a' 和3b'识别的手性化合物比被3c'和Ⅱ'所识别的化合物多。在3a'~3c'上达到基线分离的化合物也明显比在Ⅱ'上达到基线分离的化合物要多。如B,P和S在Ⅱ'上没有被识别,但能在3a',3b'或3c'上得到识别甚至基线分离。因此,3a'~3c'在一定程度上具有较优越的手性识别能力。其中,3a'和3b'比3c'具有更强的手性识别性能。
2.2 3a'~3c'的耐受性
为考察3a'~3c'对有机溶剂流动相的耐受性,考察了3a'~3c'在经历表1流动相A,B和C后,再次以A4为流动相对A~S的分离测试,比较两次手性识别性能的差异,结果见表2。从表2可以看出,多数手性样品在这三种固定相上的分离度不但没有减小,反而有不同程度的增加,因此3a'~3c'对有机溶剂流动相显示出较强的耐用性。例如,在先后两次使用A4为流动相的分离中,E在3a'上的分离度从0.96增大到3.81; O 在3b'上前后两次分离度分别为1.08和1.83。
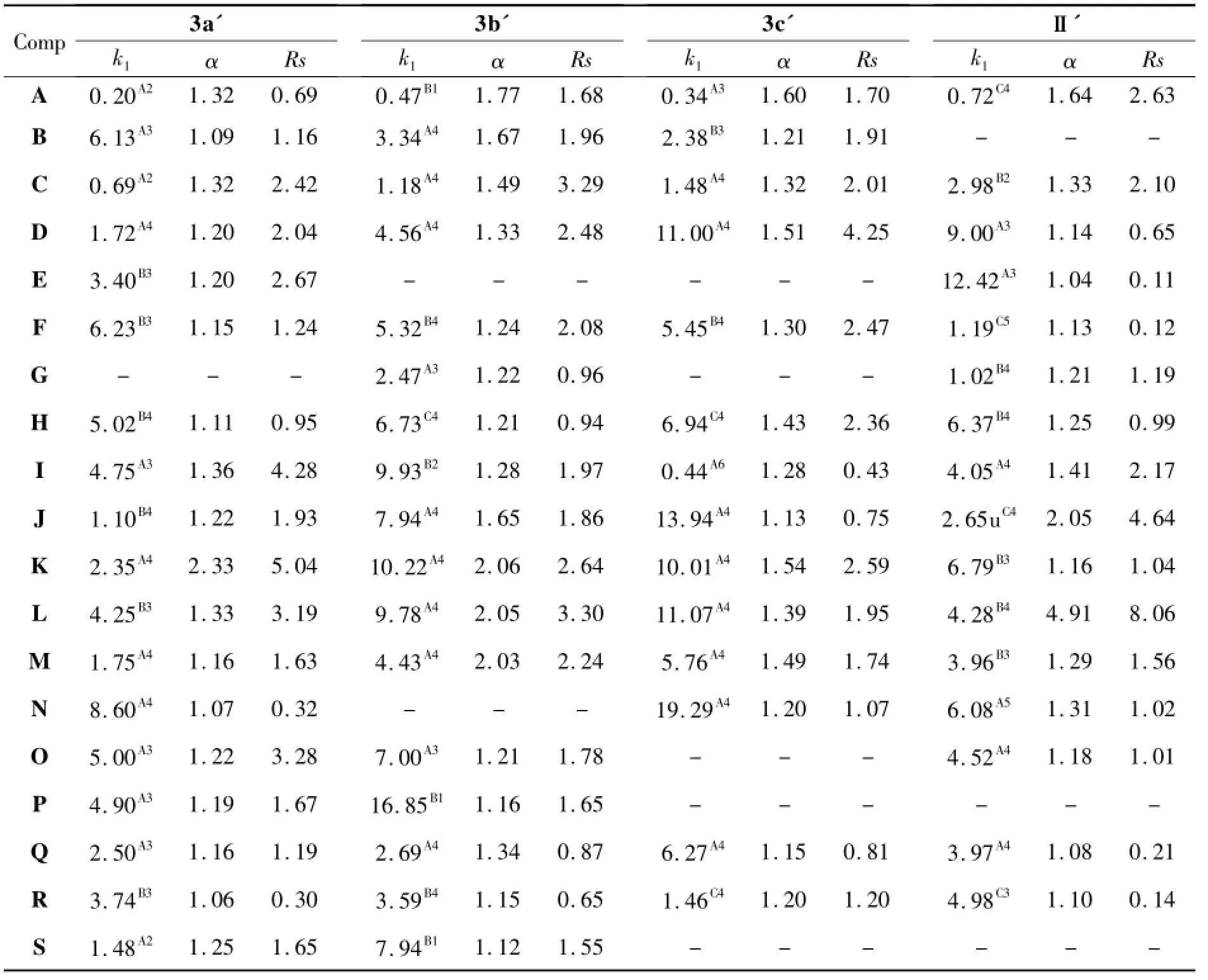
表1 3a'~3c'和Ⅱ'对A~S的分离结果Table 1 Chromatographic data of A~S resolved by 3a'~3c' andⅡ'
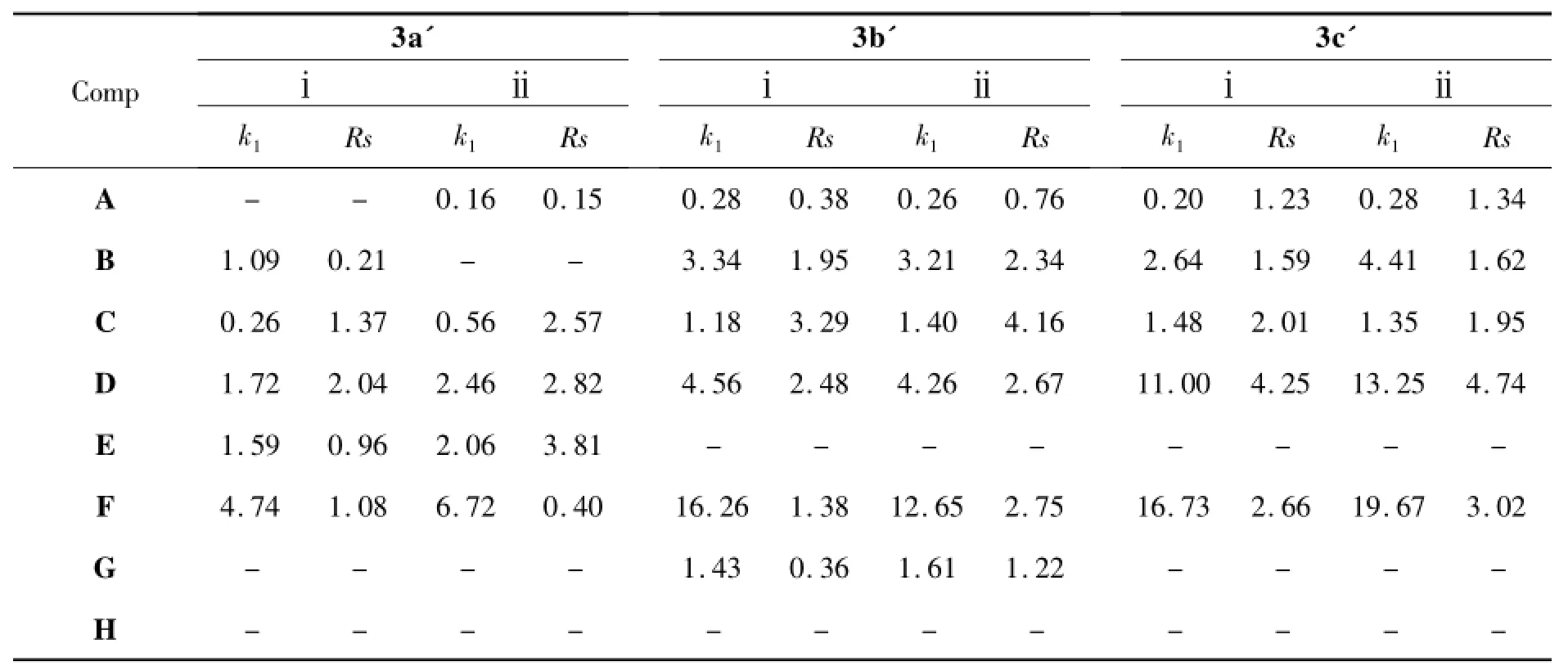
表2 3a'~3c'的耐受性* Table 2 Durability of 3a'~3c'
续表2
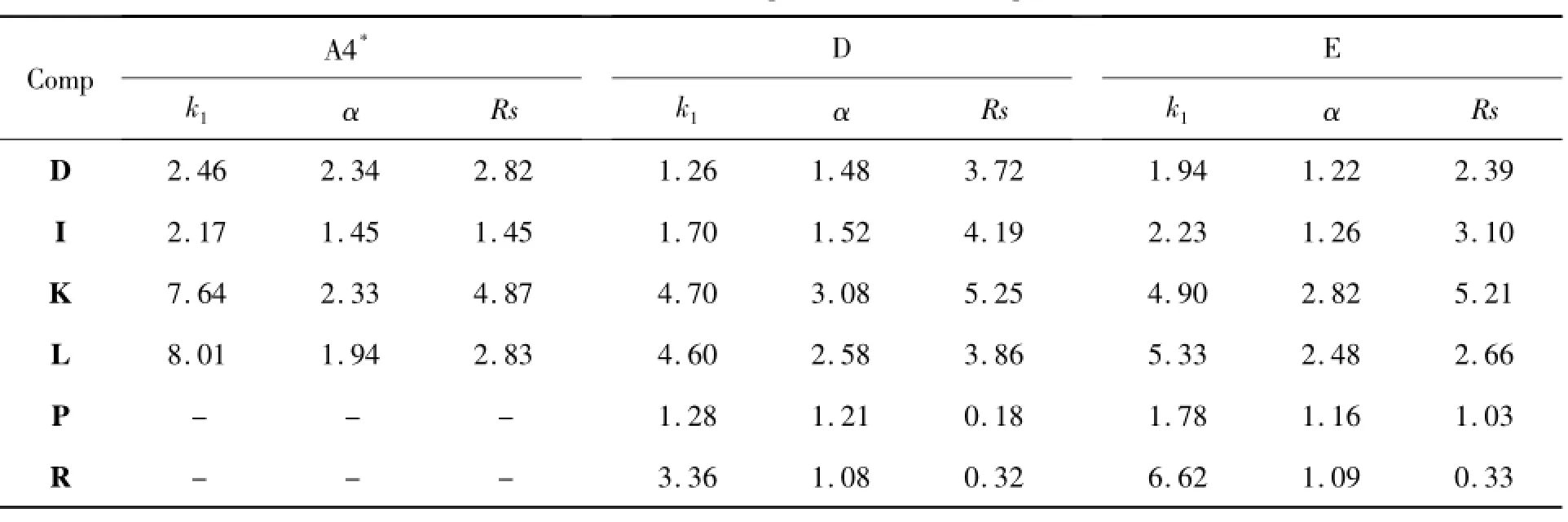
表3 手性化合物对3a'手性识别性能的影响Table 3 Effect of chiral compounds on enantioseparation of 3a'
由于甲壳素衍生物在绝大多数有机溶剂中的溶解度较小,因此,3a'~3c'能在较广泛的流动相中使用。表3是部分手性化合物在3a'上,以氯仿或乙酸乙酯作为流动相的添加剂时测得的手性分离结果。从表3可以看出,当将流动相中5%的异丙醇换为氯仿或乙酸乙酯时,I,K,P及R的分离度得以提高。因淀粉和纤维素衍生物能在氯仿和乙酸乙酯中溶解或高度溶胀,则这两类固定相不能在含氯仿或乙酸乙酯的流动相中使用[13-14]。
3 结论
用苯环上含不同取代基的苯基异氰酸酯修饰甲壳素合成了4个新型的的衍生物3a~3d;除3d外,其余衍生物均能溶于强极性有机溶剂DMF中,并能以涂覆法制备相应的手性固定相3a'~3c'。3a'~3c'具有较强的手性识别性能,说明以4-三氟甲氧基苯基异氰酸酯和4-氯-3-三氟甲基苯基异氰酸酯修饰多糖生成的衍生物也能用来制备手性固定相。
3a'~3c'在一系列流动相中使用后,其总的分离性能不但没有降低,反而有不同程度的提高,对有机溶剂流动相表现出较好的耐用性。另外,还能使用氯仿和乙酸乙酯作为流动相的添加剂,以改善一些手性样品的分离度。
参考文献
[1]Zhang Y,Wu D R,Wang-Iverson D B,et al.Enantioselective chromatography in drug discovery[J].Drug Discover Today,2005,10(8) : 571-577.
[2]Tang M L,Zhang J,Zhuang H L,et al.Development of chiral stationary phases for high-performance liquid chromatographic separation[J].TrAC Trends Anal Chem,2012,39: 180-194.
[3]Shen J,Zhao Y Q,Inagaki S J,et al.Enantioseparation using ortho- or meta-substituted phenylcarbamates of amylose as chiral stationary phases for high-performance liquid chromatography[J].J Chromatogr A,2013,1286: 41-46.
[4]Yamamoto C,Inagaki S J,Okamoto Y.Enantioseparation using alkoxyphenylcarbamates of cellulose and amylose as chiral stationary phase for high-performance liquid chromatography[J].J Sep Sci,2006,29(6) :915-923.
[5]Chankvetadze B,Yashima E,Okamoto Y.Chloromethylphenylcarbamate derivatives of cellulose as chiral stationary phases for high-performance liquid chromatography[J].J Chromatogr A,1994,670: 39-49.
[6]Chankvetadze B,Yashima E,Okamoto Y.Dimethyl-,dichloro-and chloromethylphenylcarbamates of amylose as chiral stationary phases for high-performance liquid chromatography[J].J Chromatogr A,1995,694:101-109.
[7]Yamamoto C,Hayashi T,Okamoto Y,et al.Enantioseparation by using chitin phenylcarbamates as chiral stationary phases for high-performance liquid chromatography[J].Chem Lett,2000,29: 12-13.
[8]Yamamoto C,Hayashi T,Okamoto Y.High-performance liquid chromatographic enantioseparation using chitin carbamate derivatives as chiral stationary phases [J].J Chromatogr A,2003,1021: 83-91.
[9]Huang S H,Bai Z W,Feng J W.Chiral self-discrimination of the enantiomers of α-phenylethylamine derivatives in proton NMR[J].Magn Reson Chem,2009,47: 423-427.
[10]Sachin D P,Nandkumar K,Gajanan B K,et al.Eanatiomeric separation of a melatonin agonist Ramelteon using chiral amylose-based stationary phase [J].Arabian J Chem,2013,6: 103-109.
[11]Chen J,Duan R,Bai Z W,et al.Enantioseparation properties of the biselector chiral stationary phase derived from amylose tris(phenylcarbamate) and amylose tris(benzoate)[J].Curr Anal Chem,2013,9: 128-134.
[12]Zhang T,Francotte E.Chromatographic properties of composite chiral stationary phases based on cellulose derivatives[J].Chirality,1995,7: 425-433.
[13]Okamoto Y,Ikai T,Shen J.Controlled immobilization of polysaccharide derivatives for efficient chiral separation[J].Israel J Chem,2011,51: 1096-1106.
[14]Ali I,Saleem K,Hussain I,et al.Polysaccharides chiral stationary phases in liquid chromatography [J].Sep Purif Rev,2009,38:97-147.
·研究论文·
Preparation and Enantioseparation Properties of Novel Chiral Stationary Phases Based on Chitin Derivatives
WANG Xiao-chen,WANG Zhao-qun,ZHANG Jun-jun,CHEN Wei,BAI Zheng-wu
(School of Chemistry and Environmental Engineering,Wuhan Institution of Technology,Wuhan 430073,China)
Abstract:Four novel chitin derivatives(3a~3d) were prepared by carbamoylation reaction of chitin with phenyl isocyanates.The structures were characterized by IR and elemental analysis.Three chiral stationary phases(3a'~3c') were obtained by coating 16 wt% 3a~3c on macroporous silanized silica gel.The enantioseparation capabilities and durability of 3a'~3c' were investigated by analysis on nineteen chiral compounds.The results showed that chiral recognition capability and high durability of 3a'~3c' were better than the chiral stationary phase prepared from cellulose tris(3,5-dimethylphenylcarbamate).
Keywords:chitin; preparation; chiral stationary phase; enantioseparation; durability
作者简介:王晓晨(1989-),女,汉,山东莒南人,硕士研究生,主要从事手性固定相的研究。E-mail: 45556128@ qq.com
基金项目:国家自然科学基金资助项目(51373127)
*收稿日期:2014-09-09;
修订日期:2015-06-06
中图分类号:O621.3; O652.63
文献标识码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.07.0574
通信联系人:陈伟,博士,E-mail: wchen@ wit.edu.cn

