NOD2信号对人肺泡巨噬细胞抗结核分枝杆菌活性的影响及机制研究*
阳大庆,石丽萍,张普山
(1.湖南医药学院医学检验系,湖南怀化418000;2.湖南医药学院药学系,湖南怀化418000;3.广东省人民医院,广东广州510030)
结核病是由结核分枝杆菌所致的以呼吸系统感染为主的慢性传染病。结核病是严重威胁着人类健康,同时也给社会带来沉重负担的疾病。目前,全世界现有结核病患者2 000万,每年新发病例约900万,每年死亡人数高达300万,结核病防治的形势非常严峻。我国是结核防治负担最重的国家之一,结核病患病人数位居世界第2,仅次于印度,被世界卫生组织列为全球22个结核病高负担国家之一,每年新发肺结核病患者145万。尤其是耐药性结核分枝杆菌的出现更使结核病的防治面临巨大的挑战,因此寻找新的抗结核杆菌感染的方法有着重要的意义。核苷酸结合寡聚化结构域2(NOD2)是一种胞内模式识别受体,属于NOD样受体(NLR)家族。现已证实,NOD2在炎性因子产生和抗铜绿假单胞菌、肺炎链球菌等呼吸道感染中发挥着重要作用[1-2]。有研究表明,NOD2缺陷的小鼠对胞内结核分枝杆菌的控制能力大大下降[3],这提示NOD2可能在天然抗结核免疫中同样起着至关重要的作用。然而,NOD2究竟通过何种机制来调控和影响抗结核免疫仍不清楚。笔者利用人肺泡巨噬细胞为研究对象,揭示了NOD2信号对其抗结核分枝杆菌活性的影响,并对产生这种影响的机制作了初步的探讨。
1 材料与方法
1.1 巨噬细胞来源 巨噬细胞分离自15例志愿者的支气管肺泡灌洗液,15例志愿者均来自广东省人民医院呼吸病中心,均为抗人类免疫缺陷病毒1、2型(HIV-1、2)阴性,胸片正常,无结核暴露史。
1.2 人肺泡巨噬细胞的分离和培养 参考有关文献[4],行支气管肺泡灌洗术。收集灌洗液,2 000r/min离心后,弃上清,用RPMI1640培养液(含5%小牛血清)重悬细胞。
1.3 结核分枝杆菌的培养、感染与计数 将人肺泡巨噬细胞按每孔2×105接种于24孔板,按细胞比细菌5∶1的比例加入结核分枝杆菌H37Rv(ATCC 25618),37℃孵育1h,用磷酸盐缓冲液(PBS)洗涤5次,洗去胞外的细菌,加入终浓度为10 μg/mL的镁依赖性磷酸酶(MDP),InvivoGen公司,37℃分别培养0、24、48、72h后,加入0.1%Triton X100裂解细胞,将裂解液移入无菌环氧树脂(EP)管中,10 000r/mim离心2min,去上清,用500μL Middlebrook 7H9培养液重悬,作10倍倍比稀释后,涂 Middlebrook 7H11(含10%OADC)平板,37℃,保持湿度培养14~21d,计数菌落数。
1.4 胞内NOD2蛋白的流式检测 离心收集人肺泡巨噬细胞,加入破膜缓冲液(Biolegend公司)、羊抗人NOD2和相应同型对照(Biolegend公司),4℃作用20min,洗涤细胞1次,加入异硫氰酸荧光素(FITC)标记的驴抗羊IgG(Santa Cruz公司),4℃避光作用20min,洗涤后用1%多聚甲醛固定后,于流式细胞仪上机检测。
1.5 一氧化氮(NO)的检测 将人肺泡巨噬细胞按每孔2×105铺24孔板,在每孔中加入PBS或终浓度为10μg/mL的MDP和1μg/mL 脂 多 糖(LPS,InvivoGen公 司),37 ℃,5%CO2培养24h,收集上清,按试剂盒(碧云天公司)操作说明书检测NO水平。
1.6 NOD2、一氧化氮合成酶(iNOS)与DEF4B基因表达的检测 采用实时荧光定量聚合酶链反应(RT-PCR)法,引物设计见表1。收集经过不同处理的人肺泡巨噬细胞,按照Catrimox-14TM RNA提取纯化试剂盒(TaKaRa公司)的说明提取总RNA,取2μg RNA提取物按照RT-PCR试剂盒(TaKaRa公司)操作说明书进行 RT-PCR。RT-PCR反应:2μL 单链DNA模板、2×SYBR Premix EXTaq 10μL、0.05mmol/L dNTP、10μmol/L引物0.4μL、50×Rox reference dye、灭菌去离子水补足至20μL,95℃预变性10s,95℃5s、60℃30s,共40个循环。以GAPDH为内参照,采用2-△△CT相对定量法进行计算,PCR定量以相对于对照组的变化倍数形式表示。
1.7 活性氧类(ROS)检测 将人肺泡巨噬细胞按每孔2×105铺24孔板,用对ROS敏感的还原型二氯荧光素(DCFH)荧光探针(碧云天公司)标记细胞,在每孔中加入PBS或终浓度为10μg/mL的 MDP和1μg/mL LPS,用EnVision多标记分析系统在激发光485nm,发射光535nm测定细胞内产生的荧光量的变化,反映细胞内ROS的产生量。
1.8 统计学处理 各组实验独立重复3次,用SPSS13.0软件分析结果,各样本处理前后NO水平、iNOS与DEF4B相对表达量和DCFH-DA荧光强度均以±s表示,两组间比较采用t检验,P<0.05为差异有统计学意义。

表1 各基因Realtime PCR引物的设计
2 结 果
2.1 NOD2在人肺泡巨噬细胞中的表达 流式细胞术结果显示,人肺泡巨噬细胞胞浆中存在NOD2蛋白的表达,同时,PCR结果表明NOD2基因在该细胞中也有表达,见图1。
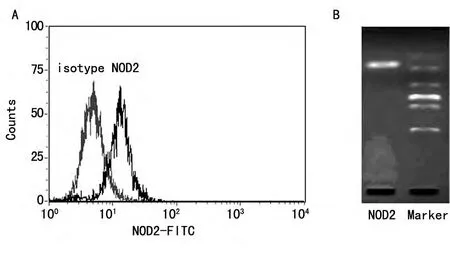
图1 NOD2在人肺泡巨噬细胞中的表达

图2 NOD2信号对人肺泡巨噬细胞抗结核分枝杆菌活性的影响
2.2 NOD2信号对人肺泡巨噬细胞抗结核分枝杆菌活性的影响 MDP刺激后,人肺泡巨噬细胞对结核分枝杆菌H37Rv在胞内生长的控制能力明显增强。从48h以后,加入MDP组和未加入MDP组开始出现差异,72h时未加入MDP组的胞内细菌数为MDP处理组的2.14倍,见图2。
2.3 NOD2信号对人肺泡巨噬细胞NO分泌及iNOS表达的影响 MDP刺激后,人肺泡巨噬细胞NO的分泌和iNOS的表达均有不同程度的增强,见图3,但较阳性对照LPS的作用弱。
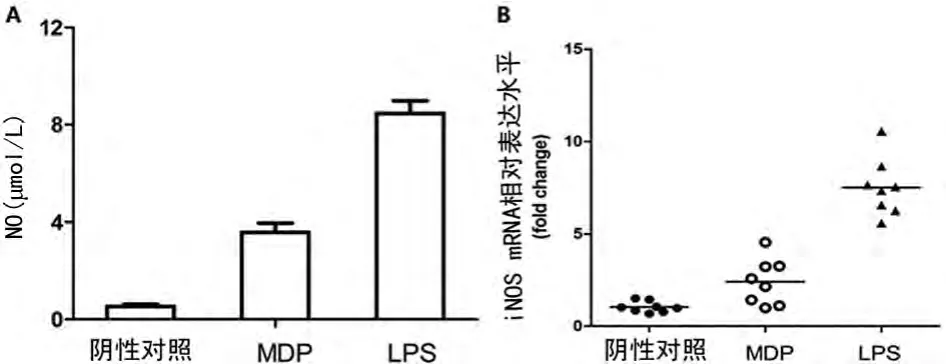
图3 NOD2信号对人肺泡巨噬细胞NO分泌及iNOS表达的影响
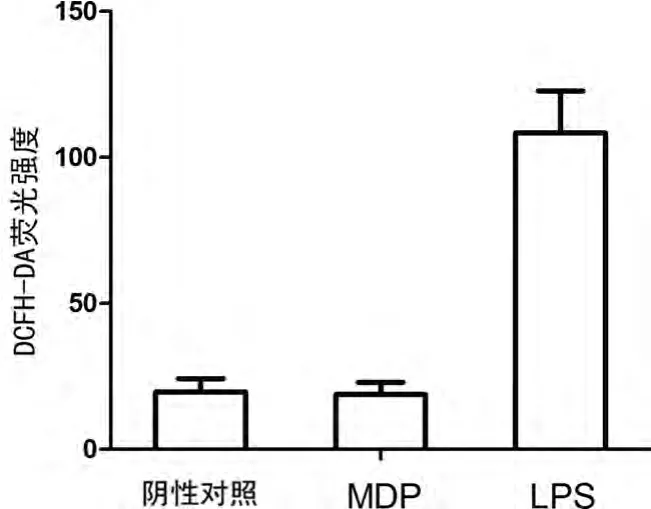
图4 NOD2信号对人肺泡巨噬细胞ROS分泌的影响
2.4 NOD2信号对人肺泡巨噬细胞ROS分泌的影响 MDP刺激后,人肺泡巨噬细胞ROS的分泌变化并不明显,见图4。而作为阳性对照的LPS却诱导了明显的ROS产生。
2.5 NOD2信号对人肺泡巨噬细胞DEF4B表达的影响MDP刺激后,人肺泡巨噬细胞中抗菌肽DEF4B基因的表达明显上调,见图5。

图5 NOD2信号对人肺泡巨噬细胞DEF4B表达的影响
3 讨 论
NOD2是一种胞内模式识别受体,其与配体结合后,可以诱发一系列炎性因子的产生[5-7],从而在抗感染免疫中发挥重要作用。近年来,关于NOD2对抗胞内菌感染的贡献日益受到人们的关注,这其中就包括了结核分枝杆菌的感染[8]。有研究表明,NOD2缺陷的小鼠控制结核分枝杆菌的能力明显减弱[3],说明NOD2在天然抗结核免疫中具有重要作用。
巨噬细胞既是结核分枝杆菌寄生的场所,同时又是抗结核免疫的主要效应细胞。最近,人们发现NOD2可以在人肺泡巨噬细胞中表达[9],但其在结核天然免疫中的作用及机制并不清楚。笔者利用流式细胞术和PCR的方法分别在蛋白和基因水平证实了NOD2在人肺泡细胞中的表达。在天然抗结核免疫中,巨噬细胞主要通过NO和ROS的分泌、自噬作用及抗菌肽的释放来杀灭胞内结核分枝杆菌[10-11]。有研究证实,NOD2信号刺激能诱导自噬酶IRGM的高表达和抗菌肽LL37的分泌,从而增强巨噬细胞杀灭结核分枝杆菌的效应[12]。本研究结果也表明,NOD2信号刺激能增强人肺泡巨噬细胞对胞内结核分枝杆菌的控制。为了进一步阐明这种效应的作用机制,笔者评价了NOD2信号刺激对人肺泡巨噬细胞NO、ROS及另外一种重要的抗菌肽——DEF4B的分泌或表达的影响。研究结果显示,MDP刺激后,人肺泡巨噬细胞中NO的分泌和DEF4B的表达水平明显增加,这提示NOD2可能通过这两者在抗结核天然免疫中发挥作用。令人意外的是,MDP刺激后,ROS水平变化并不明显,这可能与NOD2信号激发的基因表达谱有关。
总而言之,本研究结果提示NOD2可能参与了早期的抗结核感染免疫,从而阻止疾病的进展。这种效应与其诱导的NO和抗菌肽DEF4B的产生有关,而与ROS关系并不明显,其具体机制仍待进一步研究证实。
[1] Hippenstiel S,Opitz B,Schmeck B,et al.Lung epithelium as a sentinel and effector system in pneumonia--molecular mechanisms of pathogen recognition and signal transduction[J].Respir Res,2006,7(1):97.
[2] Kanneganti TD,Lamkanfi M,Núez G.Intracellular NOD-like receptors in host defense and disease[J].Immunity,2007,27(4):549-559.
[3] Divangahi M,Mostowy S,Coulombe F,et al.NOD2-deficient mice have impaired resistance to Mycobacterium tuberculosis infection through defective innate and adaptive immunity[J].J Immunol,2008,181(10):7157-7165.
[4] Juarez E,Nuez C,Sada E,et al.Differential expression of Toll-like receptors on human alveolar macrophages and autologous peripheral monocytes[M].Respir Res,2010,11(1):2.
[5] Park JH,Kim YG,Núez G.RICK promotes inflammation and lethality after gram-negative bacterial infection in mice stimulated with lipopolysaccharide[J].Infect Immun,2009,77(4):1569-1578.
[6] Werts C,le Bourhis L,Liu J,et al.Nod1and nod2induce CCL5/RANTES through the NF-kappaB pathway[J].Eur J Immunol,2007,37(9):2499-2508.
[7] Ekman AK,Cardell LO.The expression and function of Nod-like receptors in neutrophils[J].Immunology,2010,130(1):55-63.
[8]Jo EK.Mycobacterial interaction with innate receptors:TLRs,C-type lectins,and NLRs[J].Curr Opin Infect Dis,2008,21(3):279-286.
[9] Brooks MN,Rajaram MV,Azad AK,et al.NOD2controls the nature of the inflammatory response and subsequent fate of Mycobacterium tuberculosis and M.bovis BCG in human macrophages[J].Cell Microbiol,2011,13(3):402-418.
[10] Amer AO,Swanson MS.Autophagy is an immediate macrophage response to Legionella pneumophila[J].Cell Microbiol,2005,7(6):765-778.
[11] Amer AO,Byrne BG,Swanson MS.Macrophages rapidly transfer pathogens from lipid raft vacuoles to autophagosomes[J].Autophagy,2005,1(1):53-58.
[12] Juárez E,Carranza C,Hernández-Sánchez F,et al.NOD2enhances the innate response of alveolar macrophages to Mycobacterium tuberculosis in humans[J].Eur J Immunol,2012,42(4):880-889.

