干细胞移植治疗脑出血的关键影响因素研究进展
张倩,胡荣,郑江,冯华
脑血管病已成为威胁人类健康的主要疾病之一,其中脑出血(intracerebral hemorrhage,ICH)是致死致残率最高的脑血管病,90%的幸存者存在不同程度的残疾,给家庭和社会造成巨大负担[1]。随着社会老龄化,ICH患者逐年攀升[2],但迄今为止ICH尚无有效救治手段,最新的国际多中心临床试验显示手术干预并没有给患者带来获益[3],ICH研究与救治仍进展缓慢。随着干细胞理论与技术的发展,干细胞治疗已成为ICH治疗最有可能突破的新技术。近来临床前研究表明ICH后移植外源神经干细胞对神经功能恢复是有利的,移植的干细胞可进入宿主,不仅可以提供神经保护作用,还可以分化为神经元和胶质细胞以修复受损部位,显示了广阔的应用前景[4]。但是,由于临床试验进展较慢,相关研究数据匮乏,而各试验间又相对独立,诸如细胞类型、移植时间、移植细胞数量、途径以及最佳受众人群干细胞移植治疗ICH的各项关键因素都没有一个确切的标准,不利于后续临床研究的开展。本文对最新的研究进展做了回顾,总结了干细胞移植治疗ICH相关因素的研究进展,并就存在的问题进行探讨。
1 可移植干细胞的类型
目前用于移植治疗的干细胞主要有下面几个大类,分别是胚胎干细胞(embryonic stem cells,ESCs)、成体干细胞(adult stem cell,ASCs)和诱导多能干细胞(induced pluripotent stem cells,iPSCs)。iPSCs是体细胞通过过表达Oct4、Sox2、Klf4、和c-Myc可回到初始可塑状态[5]。成体干细胞ASCs被定义为多能干细胞,来自成体内部组织如骨髓、血液、骨骼肌、神经系统和脂肪等,分别有神经干细胞(neural stem cells,NSCs)、永生化细胞系、骨髓源性干细胞、造血干细胞(hematopoietic stem cells,HSCs);骨髓间充质干细胞(mesenchymal stem cells,MSCs);内皮祖细胞(endothelial progenitor cells,EPCs);极小胚胎样干细胞(very small embryonic-like stem cells,VSELs)、胚胎组织外干细胞(extraembryonic stem cells)和其他来源的成体干细胞(脂肪干细胞、牙组织源性干细胞)[6]。各种干细胞各有优缺点如:成体干细胞的优点在于可以自体移植,iPSCs保持了ESCs的优点,但也有局限性,比如生成效率低和致瘤性问题。因此,现阶段出于技术和伦理的考虑与其他两类干细胞相比,成体干细胞更有临床适用性,但是受限于分化和增殖的能力,使其进一步应用受到一定程度阻碍。具体不同类型的患者使用哪一类干细胞进行移植应该还需要进一步的研究数据来综合考虑。
2 干细胞移植治疗发挥疗效的可能机制
关于干细胞移植治疗起效的机制,早期研究集中表明移植的干细胞可以分化为各种神经细胞,以替代损伤丢失的细胞,并融入神经组织形成环路,改善神经功能恢复[7]。但后来的许多研究揭示移植的干细胞存活数量和时间有限,如研究发现ICH后在血肿区域很少能找到移植的脐带血干细胞,脑缺血模型中也发现同样的现象[8]。后来的研究发现移植的干细胞和前体细胞通过分泌许多细胞因子降低细胞损伤和促进内源性修复而达到神经保护和再生[9],例如干细胞移植可显著提高各种营养因子如血管内皮生长因子(vascular endothelial growth factor,VEGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)、胶质细胞源性神经营养因子(glial cell-derived neurotrophic factor,GDNF)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、神经生长因子(nerve growth factor,NGF)的水平[10],显著发挥抗凋亡和神经营养的作用,降低卒中半暗带区细胞的死亡,促进神经功能恢复。新近ICH和脑缺血的模型研究发现干细胞移植可显著活化抗炎因子和抑制促炎因子[9],有些研究提示多种干细胞如NSCs、CD34+细胞、MSCs移植起效不仅促进神经的修复,还促进支持结构如血管的生成[11]。更有意思的是研究还提示移植干细胞不仅自身参与修复,还促进脑组织内源性神经干细胞的发生[10]。另外,将神经干细胞与T淋巴细胞体外共培养发现NSCs可通过分泌一些因子移植T淋巴细胞的增殖[12],提示ICH急性期行颅内干细胞移植可能通过影响T淋巴细胞调节大脑和体循环的免疫反应减轻损伤。这些研究表明干细胞与损伤区微环境/脑内源性细胞间相互作用、调节机体的免疫炎症反应等的机制是多样的,ICH后细胞治疗还需要更加深入的研究来解决上述机制问题,明确干细胞移植治疗的起效机制有助于制订方案,促进疗效降低风险。
3 干细胞移植治疗的输注时机与途径
3.1 适用患者 干细胞治疗ICH应用到临床前需要解决的第一个关键问题是:哪些患者适合该疗法并能从中获益?ICH病理学分类和解剖学位置需要重点考虑。另外,还要考虑不同人种、年龄、性别在治疗中的差异。目前临床研究尚缺乏这方面的数据,临床前的研究主要使用青年雄鼠作为研究对象,但临床上老年患者才是卒中的主要受害者,因此从临床前的研究中得到的结论不能完全推论到临床。同时,以往主要的临床前和临床研究都主要集中在缺血性卒中而不是ICH,仅有少数是针对ICH,而且采用的动物模型也缺乏统一[13],不同的卒中模型,可能导致干细胞治疗产生的远期疗效不一样。例如有临床前研究对比发现对纹状体梗死进行干细胞移植比皮层缺血性卒中的应用效果更明显[14]。此外,设计临床试验时尚需要考虑患者的稳定性和并发症情况,特别是大面积梗死患者,常伴有多种并发症(吸入性肺炎,心律不齐等),这会影响干细胞移植的效果。因此,目前的临床前和临床研究尚无确切证据提示哪些ICH患者更适合干细胞治疗,后续研究需要就这个问题进行探讨。
3.2 时机 最适合进行移植的时机尚不确定,表1总结了目前ICH后干细胞移植治疗方面的临床前研究,发现干细胞移植时间从卒中早期24 h到1个月后不等。有学者提出如果治疗目标侧重神经保护机制应该更多考虑急性期移植;如果治疗目标在于促进修复和抑制神经元凋亡应该考虑亚急性期移植;炎症消退后对使用新神经元环路直接替代损伤组织的神经修复途径更为有利,这个策略需要卒中后几周到几月更佳[15]。一项大鼠研究表明静脉注射骨髓间充质干细胞后24 h和72 h神经功能有显著改善,但是7天后效果不显著[16]。另一项动物研究比较了在急性期、慢性期分别给予干细胞治疗,但得出矛盾结果[17],慢性期给药治疗效果反而优于急性期。由于这类似的临床前研究太少,同时又缺乏相应的临床数据,因此,ICH后移植的最佳时间目前还不能确定,需要进一步的研究来探明。
3.3 途径 干细胞移植的最佳途径也不确定,现有研究显示直接颅内移植、静脉以及动脉注射都能改善卒中患者的神经功能预后[18],但每条途径都存在安全问题。静脉注射作为一个全身循环给药途径,与直接脑部注射相比,安全,但输送到目标部位量少,也可能产生微栓塞[10]。临床前研究中静脉注射移植干细胞时使用免疫抑制剂并不能改善行为结局;颈内动脉直接给药可以避免首关效应,且侵袭性小于脑实质直接移植,而效果优于静脉注射移植[19],但由于这类途径移植的数据太少,暂无法得出其是否安全可靠的结论;而脑实质移植更具有创伤性,可能扰乱相关脑组织,并且这个部位被认为是没有营养支持的炎症环境[10]。颅内注射的部位也有待商榷,实验表明细胞直接移植到病灶中,不能达到预期成活率,相反若移植的细胞与病灶保持一定的距离则能很好的成活。可能的机制是移植干细胞的存活和分化需要各种细胞因子的营养、微环境的平衡及一定的血液供应。因此,理论上最适合的注射部位应在梗死或出血灶的周边半暗带区。但由于供体细胞和内源性祖细胞之间的相互作用、局部微环境对细胞迁移及可塑性的影响使得最佳位置仍不确定,需要进一步的研究。此外颅内注射特别是对急性缺血性卒中患者时,使用全身麻醉也是一个问题。具体选用哪一种移植途径还需要更多更确切的临床数据来验证。
3.4 细胞数量 目前临床试验数据很少,也没有确切的研究表明该采用何种剂量,剂量过低不利于达到治疗效果而剂量过高将造成浪费,为避免无效移植或高浓度导致的静脉栓塞,需要确定剂量的上下限[20]。人神经元样细胞(ntera2/D1 neuron-like cells,NT2N)是最早应用于临床研究的细胞,在试验时分别使用了2×106和6×106两个细胞数量,结果显示高细胞数量能够更好地改善神经功能[10]。后续临床试验使用不同种类的干细胞给药途径和细胞数量都没有固定的标准,从已有的实验数据看,使用BM-MNC剂量最高可达3×107而最低剂量是使用MSC时仅用5×105[1],脑部直接注射的剂量在10 000左右;静脉或动脉注射剂量是其10倍。
3.5 干细胞移植新策略-联合移植 另外一种联合策略是一种干细胞联合另一种非干细胞,非干细胞底物来增强移植治疗效果,比如联合应用NSCs和内皮细胞明显增加干细胞的存活和分化[21]。联合移植治疗的方法比较新颖,已经表现出增强干细胞存活降低不良反应的能力,值得深入探索。
3.6 追踪被移植干细胞 dMR研究可以用来评估新血管形成,正电子发射型计算机断层显像可以评估新陈代谢变化,扩散张量成像用于评估神经纤维束的完整性[22],而功能磁共振成像(magnetic resonance imaging,MRI)评估神经可塑性[23]。因此联合影像模式有可能更好的全方面评价被移植细胞以此弄清楚它们的作用机制。
4 干细胞治疗的临床试验
细胞治疗为卒中开辟了一个新的治疗途径,但将干细胞治疗的动物实验转化到临床应用还存在着很多挑战。2007年,美国国立卫生研究院(National Institutes of Health,NIH)通过名为“干细胞疗法作为卒中治疗紧急范例(Stem Cell Therapies as an Emerging
Paradigm in Stroke,STEPS)”的决议,是基于标准化研究为目的,决定从动物实验转入临床试验。2010年举行了名为STEPS2的第二次会议,为以后基于干细胞的研究制定了新的指南[18]。将来如何促进干细胞与患者的神经系统相融合以促进神经功能恢复是大家所关注的。目前的单臂临床试验研究表明干细胞移植治疗卒中是有效的,但也发现移植以后出现一定比例的感染(15%)、癫痫(14%)和死亡(13%)(http://www.clinicaltrials.gov)[1](表1)。临床数据同时表明:短期(6个月)观察比长期(12个月及以上)观察得到的结果更有效,骨髓源性单核细胞注射比其他干细胞类型更有效,动脉内注射比其他途径有效,高剂量优于低剂量[24]。因此,未来的研究需要遵照报告实验指南综合标准(Consolidated Standards of Reporting Trials guidelines,CONSORT)这一指南施行,否则错误的实验设计会极大影响实验结果。基础科学家和临床医生共同参与制定的一篇中枢神经系统干细胞移植的指南也很重要[18]。
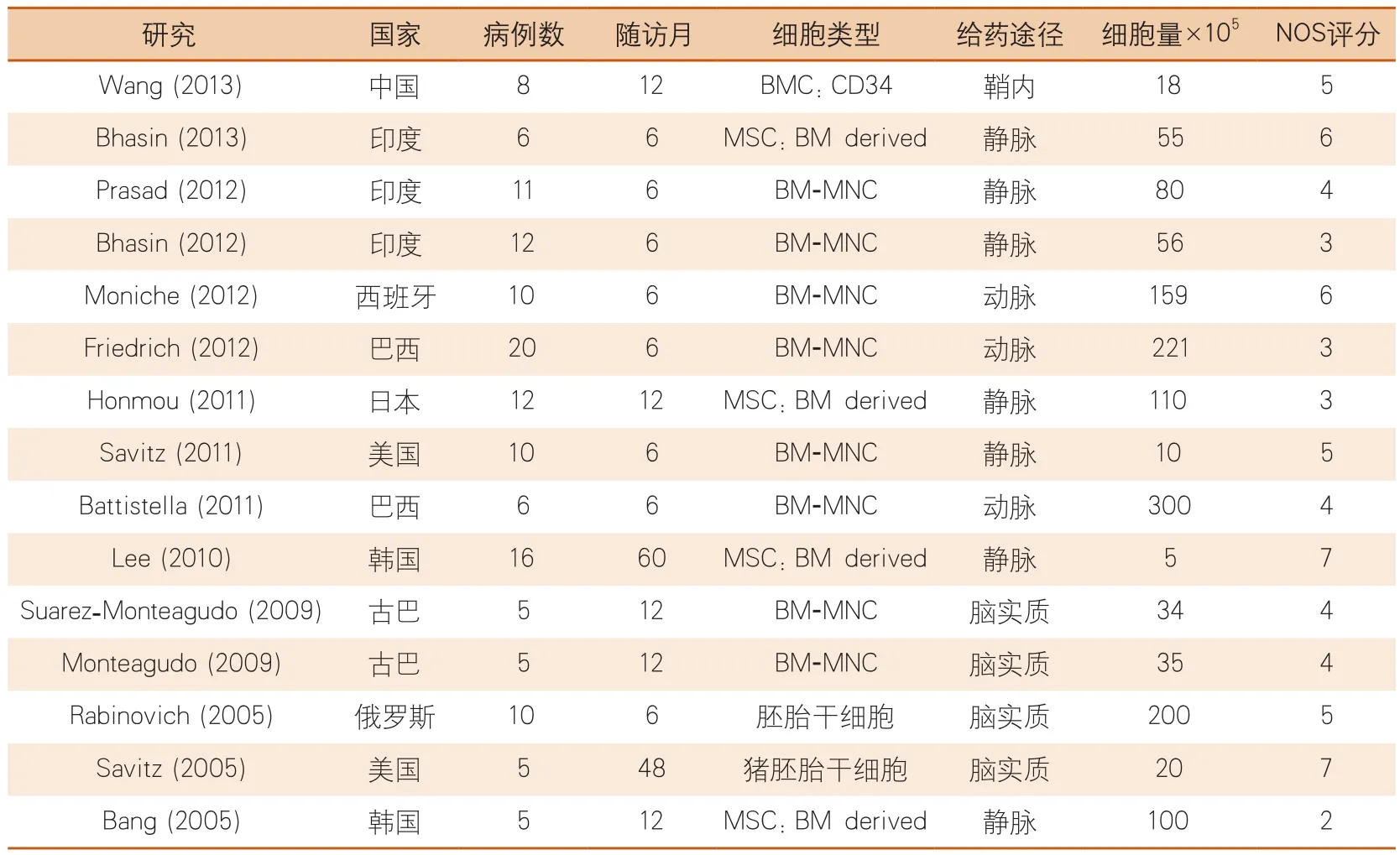
表1 临床研究[1]
每年将近1.6亿人发生卒中,导致约6百万人死亡[1],而治疗手段却极其有限。目前干细胞治疗被认为是非常有前景的疗法,最近一项临床前实验的Meta分析结果表明不同类型干细胞经颅内、动脉内以及静脉注射给药后有结构和(或)功能上的恢复。尽管干细胞移植治疗脑出血的临床前研究令人鼓舞,仍然有很多问题不甚明了,诸如细胞激活机制和最佳处理程序以及这些处理的效果,移植后在病理环境下生存、分化和维持获得表型的能力,以及对被移植大脑的影响。同时注射时间与持续时间长短也带来一定不同效果。所以在干细胞的鉴定、特性和准备方面需要进一步研究来证实干细胞移植在脑卒中方面的确切疗效与安全性问题,以及随机大样本的前瞻性临床试验来解决最佳细胞类型、剂量、时机和给药途径等问题。
1 Jeong H, Yim HW, Cho YS, et al. Efficacy and safety of stem cell therapies for patients with stroke:a systematic review and single arm meta-analysis[J]. Int J Stem Cells, 2014, 7:63-69.
2 Sullivan R1, Duncan K, Dailey T, et al. A possible new focus for stroke treatment-migrating stem cells[J].Expert Opin Biol Ther, 2015, 15:949-958.
3 Mendelow AD, Gregson BA, Rowan EN, et al.Early surgery versus initial conservative treatment in patients with spontaneous supratentorial lobar intracerebral haematomas (STICH Ⅱ):a randomised trial[J]. Lancet, 2013, 382:397-408.
4 Qin J, Gong G, Sun S, et al. Functional recovery after transplantation of induced pluripotent stem cells in a rat hemorrhagic stroke model[J]. Neurosci Lett, 2013,554:70-75.
5 Nam H, Lee KH, Nam DH, et al. Adult human neural stem cell therapeutics:Current developmental status and prospect[J]. World J Stem Cells, 2015, 7:126-136.
6 Shinozuka K, Dailey T, Tajiri N, et al. Stem cell transplantation for neuroprotection in stroke[J]. Brain Sci, 2013, 3:239-261.
7 Locatelli F, Bersano A, Ballabio E, et al. Stem cell therapy in stroke[J]. Cell Mol Life Sci, 2009, 66:757-772.
8 Stroemer P, Patel S, Hope A, et al. The neural stem cell line CTX0E03 promotes behavioral recovery and endogenous neurogenesis after experimental stroke in a dose-dependent fashion[J]. Neurorehabil Neural Repair, 2009, 23:895-909.
9 Lee ST, Chu K, Jung KH, et al. Anti-inflammatory mechanism of intravascular neural stem cell transplantation in haemorrhagic stroke[J]. Brain,2008, 131:616-629.
10 Banerjee S, Williamson DA, Habib N, et al. The potential benefit of stem cell therapy after stroke:an update[J]. Vasc Health Risk Manag, 2012, 8:569-580.
11 Taguchi A, Soma T, Tanaka H, et al. Administration of CD34+cells after stroke enhances neurogenesis via angiogenesis in a mouse model[J]. J Clin Invest, 2004,114:330-338.
12 Hu S, Rotschafer JH, Lokensgard JR, et al. Activated CD8+ T lymphocytes inhibit neural stem/progenitor cell proliferation:role of interferon-gamma[J]. PLoS One, 2014, 9:e105219.
13 Hicks AU, MacLellan CL, Chernenko GA, et al. Longterm assessment of enriched housing and subventricular zone derived cell transplantation after focal ischemia in rats[J]. Brain Res, 2008, 1231:103-112.
14 Smith EJ, Stroemer RP, Gorenkova N, et al.Implantation site and lesion topology determine efficacy of a human neural stem cell line in a rat model of chronic stroke[J]. Stem Cells, 2012, 30:785-796.
15 Meamar R, Dehghani L, Ghasemi M, et al. Stem Cell Therapy in Stroke:A Review Literature[J]. Int J Prev Med, 2013, 4:139-146.
16 Yang B, Strong R, Sharma S, et al. Therapeutic time window and dose response of autologous bone marrow mononuclear cells for ischemic stroke[J]. J Neurosci Res, 2011, 89:833-839.
17 Darsalia V, Allison SJ, Cusulin C, et al. Cell number and timing of transplantation determine survival of human neural stem cell grafts in stroke-damaged rat brain[J]. J Cereb Blood Flow Metab, 2011, 31:235-242.18 Savitz SI, Chopp M, Deans R, et al. Stem Cell Therapy as an Emerging Paradigm for Stroke (STEPS)Ⅱ[J]. Stroke, 2011, 42:825-829.
19 Fischer UM, Harting MT, Jimenez F, et al. Pulmonary passage is a major obstacle for intravenous stem cell delivery:the pulmonary first-pass effect[J]. Stem Cells Dev, 2009, 18:683-692.
20 Andres RH, Guzman R, Ducray AD, et al. Cell replacement therapy for intracerebral hemorrhage[J].Neurosurg Focus, 2008, 24:E16.
21 Zhang W, Yan Q, Zeng YS. Implantation of adult bone marrow-derived mesenchymal stem cells transfected with the neurotrophin-3 gene and pretreated with retinoic acid in completely transected spinal cord[J].Brain Res, 2010, 1359:256-271.
22 Nakagomi N, Nakagomi T, Kubo S, et al. Endothelial cells support survival, proliferation, and neuronal differentiation of transplanted adult ischemiainduced neural stem/progenitor cells after cerebral infarction[J]. Stem Cells, 2009, 27:2185-2195.
23 Bliss TM, Andres RH, Steinberg GK. Optimizing the success of cell transplantation therapy for stroke[J].Neurobiol Dis, 2010, 37:275-283.
24 Barbosa da Fonseca LM, Gutfilen B, Rosado de Castro PH, et al. Migration and homing of bone-marrow mononuclear cells in chronic ischemic stroke after intraarterial injection[J]. Exp Neurol, 2010, 221:122-128.
【点睛】
本文分别对影响干细胞治疗的细胞数量、移植时间、最佳给药途径等关键问题展开阐述,以供后续研究参考。
中国卒中学会诚聘医学期刊编辑
中国卒中学会是民政部登记成立的国家学术社团单位,现因工作发展需要,诚招医学期刊编辑若干名。
一、待遇:
1、薪酬从优(面议);五险一金;年终奖;节假福利等。
2、享受全部国家规定的带薪假及单位额外带薪假。
二、基本条件:
1、临床医学(西医)专业本科及以上学历,有神经科背景优先;
2、有英文专业阅读能力,能够检索、翻译中英文献,并有良好的文字编辑能力;
3、能熟练使用电脑和常用办公软件及设备;
4、工作细致、责任心强,有团队合作精神,性格适合做编辑工作。
三、岗位职责:
从事杂志社学术期刊稿件的审核、编辑、校对工作。
了解学会:www.chinastroke.net
联系方式:王老师;010-57986266;wangfeng@chinastroke.net