床旁TCD监测对蛛网膜下腔出血后迟发性脑缺血价值研究
丁则昱,张倩,吴建维,杨中华,赵性泉
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)后存活的患者中,迟发性脑缺血(delayed cerebral ischemia,DCI),特别是血管痉挛相关的DCI,成为死亡和残障的主要原因[1]。床旁经颅多普勒超声(transcranial Doppler,TCD)监测,通过观察脑血流速度的变化,能够发现脑血管痉挛;而且TCD监测可以根据流速的变化监测治疗效果。美国心脏协会(American Heart Association,AHA)/美国卒中协会(American Stroke Association,ASA)指南[1]及欧洲指南[2]中,已经将TCD作为SAH后血管痉挛的常规监测工具。但是,床旁TCD监测的作用在国内仍未得到重视。本文将通过比较TCD监测异常对治疗和预后影响探讨其应用价值。
1 对象与方法
1.1 研究对象 本研究连续纳入2011年10月至2013年10月收入首都医科大学附属北京天坛医院神内重症监护病房(intensive care unit,ICU)的完成床旁TCD监测的经颅脑计算机断层扫描(computed tomography,CT)明确诊断为SAH的患者244例。所有患者在72 h内完成血管造影检查,明确是否存在动脉瘤,根据病情给予介入动脉瘤填塞或开颅动脉瘤夹闭术。所有患者入住神内ICU后,立即开始床旁TCD监测,根据病情每天或隔日进行TCD检查直至转出ICU。
1.2 入选标准 ①年龄≥18岁;②符合国际疾病分类法(International Classification of Diseases,ICD)第10版,诊断代码为430.0(SAH);③收住神内ICU并住院48 h以上;④患者家属签署知情同意书。
1.3 排除标准 ①经造影证实已知病因为血管畸形、外伤及其他非动脉瘤性病因导致的SAH;②因临床情况不稳定及其他原因未能进行TCD检查;③排除发病前改良Rankin量表(modified Rankin Scale,mRS)评分>1分患者。
1.4 临床及影像学评价 记录患者的人口学信息,既往病史,入院时格拉斯哥昏迷评分(Glasgow Coma Scale,GCS)、Hunt-Hess分级、世界神经外科医师联盟(World Federation of Neurosurgical Society,WFNS)分级、改良Fisher分级的基线资料。患者Hunt-Hess分级Ⅰ~Ⅲ级、WFNS Ⅰ~Ⅲ级提示预后良好,而改良Fisher分级3~4级提示预后不良,故研究中将上述情况作为二分类统计的分割点[3]。
1.5 TCD监测 TCD监测采用德国DWL公司生产的经颅多普勒超声诊断仪,使用2 MHz探头,经颞窗分别探测双侧大脑中动脉(middle cerebral artery,MCA)。探测深度36~60 mm,记录流速最快的收缩/舒张流速,计算平均血流速度(mean cerebral blood flow velocity,MBF)。将MBF>120 cm/s定义为TCD诊断血管痉挛[4],MBF>80 cm/s定义为血流速度增快[5]。由专门的医师进行TCD监测,收入ICU后尽快完成基线数据获取,并根据情况进行监测,尽量保证同一医师完成监测。动脉瘤夹闭术后患者,手术侧MCA不能完成监测者,观察对侧MCA。根据TCD基线检测结果,将患者分为正常组,流速增快组和血管痉挛组。TCD监测结果,根据流速变化判断为好转或加重,MBF<80 cm/s为正常,监测在转出ICU时结束。
1.6 并发症与治疗 根据数字减影血管造影(digital subtraction angiography,DSA)或计算机断层扫描血管成像(computed tomography angiography,CTA)结果,记录动脉瘤的位置、动脉瘤处理方式。记录患者发生并发症的情况,包括DCI、脑积水、再出血、癫痫、颅内感染、肺内感染、肾功不全、机械通气、脑心综合征等。DCI定义为症状性血管痉挛,或与血管痉挛相关的CT低密度[3]。症状性血管痉挛定义为:临床神经功能恶化(神经功能异常体征,意识障碍或二者都有),确认原因为血管痉挛,特别需要排除其他影响因素(癫痫,脑积水,代谢紊乱,感染或过度麻醉)。根据2012年AHA/ASA指南的推荐意见,预防及治疗血管痉挛或DCI,给予保证晶体入量、提升血压、尼莫地平治疗[1],本研究将上述治疗定义为加强治疗。另外部分患者给予脑脊液置换、脑室外引流、腰大池引流治疗。记录3组患者对DCI治疗的效果,NIHSS评分减低≥2分定义为临床好转[3],TCD流速增高恢复,MBF减低≥5 cm/s定义为血管痉挛好转[4]。
1.7 随访与结局 发病后90天对患者进行电话或面谈随访,通过mRS评分评价预后。将mRS评分4~6分定义为预后不良[3]。
1.8 统计学分析 采用SPSS 19.0统计软件进行数据处理。在数据分析前进行正态性检验及方差齐性分析。计算资料符合正态分布,采用( )表示,组间比较采用方差分析。计数资料使用频数或百分数表示,不同组间频数比较,采用卡方检验。相关分析,采用Pearson相关分析。P<0.05为差异具有显著性。
2 结果
2.1 基线资料 244例入组患者平均年龄(55.6±11.8)岁,其中女性143例(58.6%)。患者的GCS评分、Hunt-Hess分级Ⅰ~Ⅲ级、WFNSⅠ~Ⅲ级、改良Fisher分级3~4级、脑室出血、颅内血肿、动脉瘤位置、手术方式及合并症的例数统计及占总数的百分比详见表1。
2.2 TCD监测和分组 244例患者的TCD基线监测结果显示,22例(9.0%)颞窗不佳,14例(5.7%)流速增快,85例(34.8%)血管痉挛,123例正常(50.4%)。将222例有TCD结果的数据分成3组,血管痉挛组、流速增快组和正常组。3组患者的基线比较,GCS评分、Hunt-Hess分级Ⅰ~Ⅲ级、WFNSⅠ~Ⅲ级、改良Fisher分级3~4级、颅内血肿差异有显著性(P<0.05)。相关分析显示TCD结果异常与GCS评分、Hunt-Hess分级Ⅰ~Ⅲ级、WFNSⅠ~Ⅲ级、改良Fisher分级、颅内血肿、脑室出血、前交通动脉瘤均有相关性(表2)。
TCD基线结果异常患者,均有多次TCD监测数据,根据MCA的MBF值了解病情的演变及治疗的效果。图1为1例血管痉挛典型SAH患者的CT、DSA、TCD结果。该患者发生了DCI,经强化治疗及脑脊液置换后,临床情况明显好转。
2.3 治疗及并发症
2.3.1 动脉瘤的治疗 患者动脉瘤位置以前交通、后交通动脉瘤为主,约60%。3组患者比较在动脉瘤位置差异无显著性(P>0.05)。夹闭术选择略高于栓塞术,分别为115例(47.1%)和79例(32.4%)。3组患者在手术方式选择上差异亦无显著性(P>0.05)(表1)。
2.3.2 并发症 本研究统计的患者并发症中DCI的发生率最高为71例(29.1%),其后分别为肺部感染(21.3%)、脑积水(21.3%)、再出血(15.2%)和脑积水(21.3%)。对于急诊收治的动脉瘤性SAH患者,均尽早安排手术治疗,但仍有部分患者因病情或家属拒绝而未能尽快进行手术。发生再出血的多为动脉瘤未处理患者。3组患者的并发症比较,除DCI外差异均无显著性(表1)。
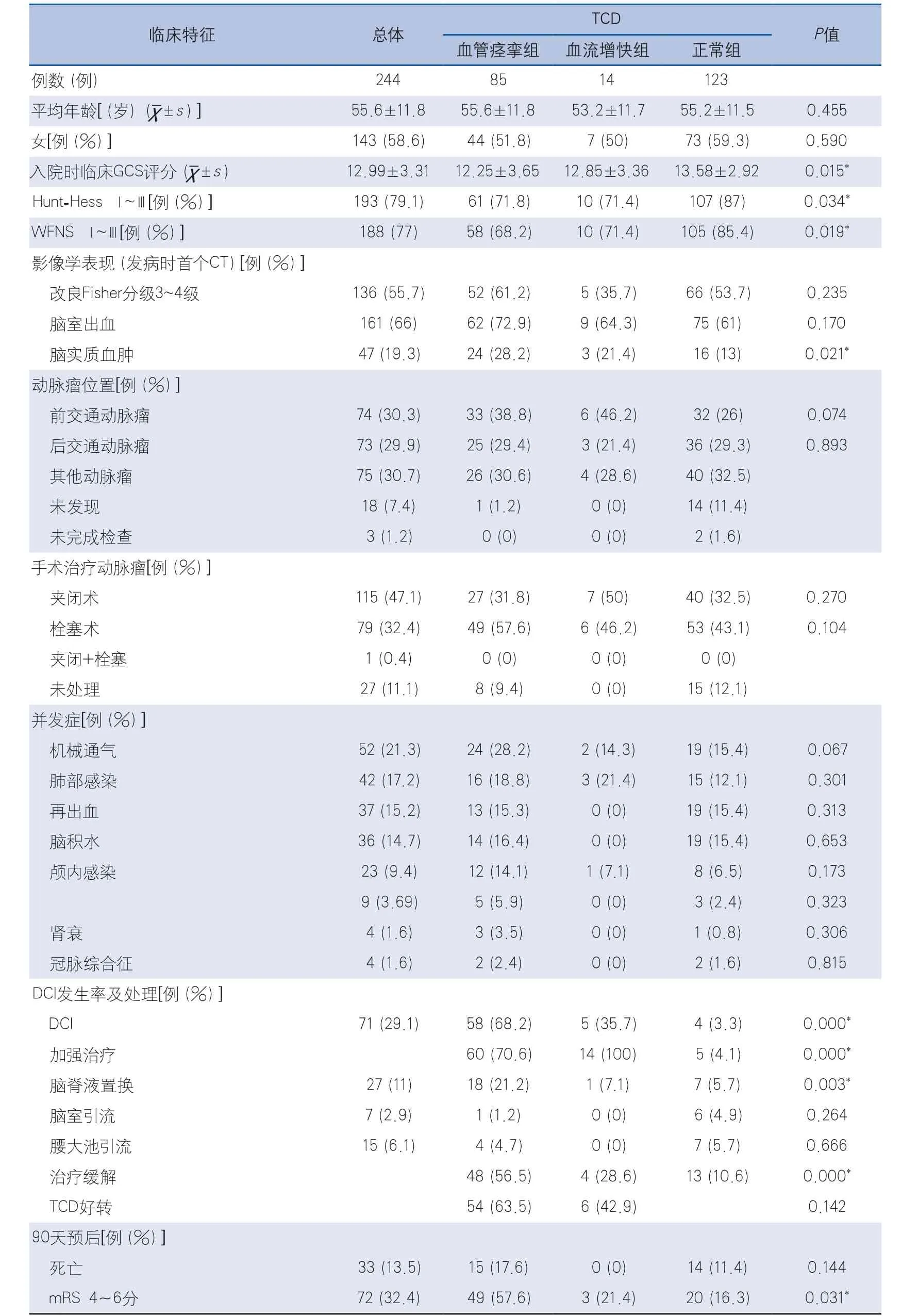
表1 SAH患者的人口学,临床及影像学特征
2.3.3 DCI发生率及治疗 3组患者DCI的发生率分别为血管痉挛组68.2%,流速增快组35.7%和正常组3.2%,差异有显著性(P<0.01)。
3组患者针对DCI的治疗也显著不同,给予加强治疗的比例血管痉挛组为70.6%,流速增快组100%和正常组4.1%,差异有显著性(P<0.01)。给予脑脊液置换的比例血管痉挛组为21.2%,流速增快组7.1%和正常组5.7%,差异有显著性(P<0.01)。给予脑室引流及腰大池引流的患者较少,组间差异无显著性(表1)。
3组患者经治疗后临床缓解率血管痉挛组56.5%,流速增快组28.6%和正常组10.6%,差异有显著性(P<0.01)。治疗后TCD改善率接近50%,血管痉挛组63.5%,流速增快组43.9%。2.4 临床预后 222例患者在90天随访时,失访17例(7.7%),死亡33例(14.9%),预后不良55例(24.8%)。3组患者比较,预后不良比例血管痉挛组30.6%,流速增快组21.4%和正常组15.4%,差异有显著性(P=0.031)。
3 讨论
SAH是一种高致死性脑血管病,积极完善DSA或CTA检查,发现动脉瘤并尽早手术,可大大降低再出血的发生率,DCI是SAH后的严重并发症之一。SAH后DCI发生率为20%~40%,DCI的表现形式不同,持续时间长短不一,可以是症状性血管痉挛,或与血管痉挛相关的CT低密度,也可以是一过性的也可以是永久的[3]。多项研究表明,DCI与3月时死亡或严重残疾显著相关[3,6]。

表2 TCD结果异常的相关因素分析
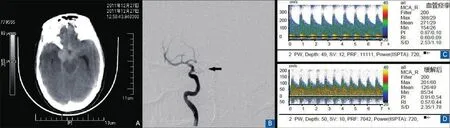
图1 49岁女性蛛网膜下腔出血TCD监测图注:图A:发病后头CT检查,示蛛网膜下腔出血;图B:急诊血管造影检查,箭头所示为右侧后交通动脉瘤填塞后;图C:TCD右侧大脑中动脉血流速度,MBF196 cm/s,支持血管痉挛;图D:血管痉挛缓解后,MBF97 cm/s。TCD:经颅多普勒超声;MBF:平均血流速度;CT:计算机断层扫描
目前研究主要分为两方面即DCI的治疗、如何早期预测DCI的发生。目前研究发现DCI与临床分级差[7]、SAH积血多[8]、年龄、DSA和TCD所示血管痉挛有关[4]。DCI可能与多种因素相关,影像学对血管痉挛的发现早于临床,DSA是诊断血管痉挛的金标准,而TCD因为床旁、便捷,成为一个重要的替代工具。TCD对MCA血管痉挛的诊断有较高的准确性,指南推荐的诊断标准为MBF>120 cm/s[4]。血管痉挛的发生高峰在4~14天,因此发病早期血流速度增快可为DCI发生的危险因素。研究显示发病后48小时之内MCA的MBF>90 cm/s,可以预测DCI的发生[7],而MCA正常血流速度的上限为80 cm/s[9],本研究没有选择90 cm/s作为分界值,而是根据TCD结果的正常值范围划分为流速增快组和正常对照组,即MBF>120 cm/s为血管痉挛组,120 cm/s≥MBF>80 cm/s为流速增快组,MBF<80 cm/s作为正常对照组。
研究显示年龄≥68岁,WFNSⅠ~Ⅲ级、改良Fisher分级1~2级患者较少发生血管痉挛[10]。而本研究基线资料显示,与正常组比较,血管痉挛组和流速增快组的GCS评分低、Hunt-Hess分级Ⅰ~Ⅲ级少、WFNSⅠ~Ⅲ级少、改良Fisher分级3~4级多和颅内血肿多(P<0.05)。上述结果提示,对于临床及影像分级差合并颅内血肿的患者,更容易发生血管痉挛。从反面印证了之前的研究结果。
目前指南中推荐的对DCI的有效治疗包括尼莫地平[1]、维持正常循环血量[1]、提升血压[1]、血管成形术[11]和动脉内血管扩张剂[12]。血管内治疗常常应用在尼莫地平、增加血容量和提升血压无效的情况下。当发现有突发的神经功能缺损,用DSA发现的血管痉挛可以解释的情况时,也适合选择介入治疗。治疗的方法包括球囊扩张术和局部动脉内应用血管扩张剂。
虽然指南中没有推荐,关于腰大池引流的一些研究报道也显示其可以减低DCI发生率,改善早期预后[8,11-12]。本研究也发现,通过腰大池引流进行血性脑脊液置换可以改善临床情况。因为考虑到继发颅内感染的风险,本研究中通常采用脑脊液置换的方法,短期将血性脑脊液与生理盐水置换。一项腰大池引流的随机对照试验,入组患者为WFNS 1~3级和改良Fisher分级2~4级[11],考虑可能因为出血量较大的患者更适合采用腰大池引流。
TCD监测到血流增快后,不但可诊断血管痉挛,也可以预测血管痉挛及DCI的发生[7]。因此TCD流速增快是DCI的风险指标,是临床选择积极抗血管痉挛治疗的依据。本研究中,TCD血流速度异常的患者,得到了更多更积极的抗血管痉挛治疗。血管痉挛组和流速增快组给予加强治疗和脑脊液置换的比例显著高于对照组。不仅仅在TCD方面有大幅的改善,临床症状也大大改善。图1~2是1例发生典型DCI的SAH患者,经加强治疗和脑脊液置换,症状逐渐缓解的情况。TCD监测在整个治疗过程中,也客观地反映了治疗的效果,使临床医师制订治疗决策有了更多的依据。
如前所述,Hunt-Hess分级差和改良Fisher分级差是预后不良及DCI的危险因素。本研究中,虽然给予了强化治疗,血管痉挛组和流速增快组的预后不良率也显著高于对照组(P=0.031)。这与患者临床分级低、出血量多、发生DCI有关。反之,如果这些患者没有接受强化治疗,可能预后不良及DCI的发生率会更高。进行床旁TCD监测发现血流异常患者给予加强治疗,是非常有必要的。
TCD检查也有很多局限性,如对于严重的血管痉挛TCD反而表现为流速减低,除MCA血管痉挛外,TCD诊断其他血管痉挛的效率并不高[4,13-15]。许多研究旨在探讨更加敏感的DCI预测方法,包括对TCD参数的变化[14-17]、采用三维成像TCD监测[18]、连续监测[19]等。但目前指南的推荐意见,除外MFV参数外,仅包括Lindegaard(LI)指数。LI是通过颅内动脉MFV/颈内动脉颅外段MFV计算,以排除脑过度充血所致的血流增快,当LI>3时考虑诊断为血管痉挛。据报道联合CT灌注成像诊断血管痉挛是一个比较好的方法,重症血管痉挛患者如果TCD不能表现为流速增快时,可以加做灌注CT[20-22]。本研究的不足之处在于,临床诊断DCI而TCD表现正常的患者,没有补充CT灌注成像检查。这种情况可能导致重度血管痉挛的漏诊。但是实际操作中,因为考虑到临床诊断DCI,已经给予加强治疗,即使没有诊断血管痉挛,对治疗措施的选择无明显影响。另外本研究没有结合LI指数进行TCD诊断,可能使TCD血管痉挛的诊断率减低,使临床未能给予强化治疗,影响预后。
本研究发现TCD血管痉挛及血流速度增快组DCI的发生率高于正常组,虽然给予加强治疗,仍不能改善90天预后不良情况的发生。在TCD异常的患者中,随着加强治疗的进行,临床情况有改善,TCD监测可以及时反映DCI。综上所述,TCD应作为SAH后防治血管痉挛的基本监测手段,得到进一步的重视。
1 Connolly ES Jr, Rabinstein AA, Carhuapoma JR, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage:A guideline for healthcare professionals from the american heart association/american stroke association[J]. Stroke,2012, 43:1711-1737.
2 Steiner T, Juvela S, Unterberg A, et al. European stroke organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage[J]. Cerebrovasc Dis, 2013, 35:93-112.
3 Frontera JA, Fernandez A, Schmidt JM, et al. Defining vasospasm after subarachnoid hemorrhage:What is the most clinically relevant definition?[J]. Stroke, 2009,40:1963-1968.
4 Marshall SA, Nyquist P, Ziai WC. The role of transcranial doppler ultrasonography in the diagnosis and management of vasospasm after aneurysmal subarachnoid hemorrhage[J]. Neurosurg Clin N Am,2010, 21:291-303.
5 Alexandrov AV, Sloan MA, Wong LK, et al. Practice standards for transcranial doppler ultrasound:Part i--test performance[J]. J Neuroimaging, 2007, 17:11-18.
6 van Gijn J, Kerr RS, Rinkel GJ. Subarachnoid haemorrhage[J]. Lancet, 2007, 369:306-318.
7 Carrera E, Schmidt JM, Oddo M, et al. Transcranial doppler ultrasound in the acute phase of aneurysmal subarachnoid hemorrhage[J]. Cerebrovasc Dis, 2009,27:579-584.
8 Al-Tamimi YZ, Orsi NM, Quinn AC, et al. A review of delayed ischemic neurologic deficit following aneurysmal subarachnoid hemorrhage:Historical overview, current treatment, and pathophysiology[J].World Neurosurg, 2010, 73:654-667.
9 Alexandrov AV, Sloan MA, Tegeler CH, et al. Practice standards for transcranial doppler (tcd) ultrasound.Part ii. Clinical indications and expected outcomes[J].J Neuroimaging, 2012, 22:215-224.
10 Crobeddu E, Mittal MK, Dupont S, et al. Predicting the lack of development of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage[J]. Strok,2012, 43:697-701.
11 Al-Tamimi YZ, Bhargava D, Feltbower RG, et al. Lumbar drainage of cerebrospinal fluid after aneurysmal subarachnoid hemorrhage:A prospective,randomized, controlled trial (lumas)[J]. Stroke, 2012,43:677-682.
12 Klimo P Jr, Kestle JR, MacDonald JD, et al. Marked reduction of cerebral vasospasm with lumbar drainage of cerebrospinal fluid after subarachnoid hemorrhage[J]. J Neurosurg, 2004, 100:215-224.
13 Deb S, Gogos AJ, Drummond KJ, et al. The role of transcranial doppler ultrasound monitoring in patients with aneurysmal subarachnoid haemorrhage[J]. J Clin Neurosci, 2012:950-955.
14 Zetterling M, Hallberg L, Hillered L, et al. Brain energy metabolism in patients with spontaneous subarachnoid hemorrhage and global cerebral edema[J]. Neurosurgery, 2010, 66:1102-1110.
15 Carrera E, Schmidt JM, Oddo M, et al. Transcranial doppler for predicting delayed cerebral ischemia after subarachnoid hemorrhage[J]. Neurosurgery, 2009,65:316-324.
16 Muñoz-Sanchez MA, Murillo-Cabezas F, Egea-Guerrero JJ, et al. Emergency transcranial doppler ultrasound:Predictive value for the development of symptomatic vasospasm in spontaneous subarachnoid hemorrhage in patients in good neurological condition[J]. Med Intensiva, 2012, 36:611-618.
17 de Riva N, Budohoski KP, Smielewski P, et al.Transcranial doppler pulsatility index:What it is and what it isn't[J]. Neurocritical care, 2012, 17:58-66.
18 Rigamonti A, Ackery A, Baker AJ. Transcranial doppler monitoring in subarachnoid hemorrhage:A critical tool in critical care[J]. CanJ Anaesth, 2008,55:112-123.
19 Bell RD, Benitez RP. Continuous measurement of cerebral blood flow velocity by using transcranial doppler reveals significant moment-to-moment variability of data in healthy volunteers and in patients[J]. Crit Care Med, 2002, 30:712-713.
20 Sanelli PC, Jou A, Gold R, et al. Using CT perfusion during the early baseline period in aneurysmal subarachnoid hemorrhage to assess for development of vasospasm[J]. Neuroradiology, 2011, 53:425-434.
21 Rijsdijk M, van der Schaaf IC, Velthuis BK, et al.Global and focal cerebral perfusion after aneurysmal subarachnoid hemorrhage in relation with delayed cerebral ischemia[J]. Neuroradiology, 2008, 50:813-820.22 Dankbaar JW, de Rooij NK, Velthuis BK, et al.Diagnosing delayed cerebral ischemia with different ct modalities in patients with subarachnoid hemorrhage with clinical deterioration[J]. Stroke, 2009, 40:3493-3498.
【点睛】
通过比较SAH患者TCD异常与正常者的抗血管痉挛强化治疗的选择率、DCI及不良预后发生率和治疗效果,评价床旁TCD监测对DCI的临床价值。
《漫画脑卒中》书讯

作为一名外科医生,花了几十年时间与患者在一起并肩作战,我在享受手术的成就感的同时,又有深深的无助感。医生的无助在哪里?医生的无助在于,看到患者对疾病知识的无知和无畏,却无能为力。再精美的手术,都无法帮助一个积重难返的病人。这种无助感随着工作时间越久,就越积越重,转而成为了紧迫感,督促我不得不去做这件事。这就是我要完成的心愿!
—— 主编:缪中荣
首都医科大学附属北京天坛医院介入神经病学科缪中荣教授主编的《漫画脑卒中》,由人民卫生出版社出版。2015年10月底在人民卫生出版社天猫旗舰店、京东、亚马逊等上架出售。
该书目录、内容试读及其他相关信息,请移步当当预售链接:http://product.dangdang.com/23790212.html