人外分泌汗腺细胞分离方法的优化*
赵换军, 赵洪良, 谭志军, 陈 艳, 许永安, 张 茂, 张翠萍△, 付小兵△
(1. 天津医科大学, 天津 300070; 2. 解放军总医院第一附属医院,全军创伤修复与组织再生重点实验室, 北京 100048;3. 浙江大学医学院附属第二医院急诊科, 杭州 310009)
人外分泌汗腺细胞分离方法的优化*
赵换军1,2, 赵洪良2, 谭志军1, 陈 艳2, 许永安3, 张 茂3, 张翠萍2△, 付小兵2△
(1. 天津医科大学, 天津 300070; 2. 解放军总医院第一附属医院,全军创伤修复与组织再生重点实验室, 北京 100048;3. 浙江大学医学院附属第二医院急诊科, 杭州 310009)
目的:优化人外分泌汗腺细胞的分离方法,以高效地提取外分泌汗腺细胞。方法:新鲜的皮肤样本剪成组织微粒(大小约1 mm3),A组采用胰蛋白酶-乙二胺四乙酸(EDTA)和胶原酶Ⅱ型(2 mg/ml)体积分数1∶1混合的方法;B组采用传统消化方法,即胶原酶Ⅱ型;C组采用胰蛋白酶-EDTA消化的方法,三组同时置于恒温培养箱内,比较三种方法处理后汗腺细胞团的获取情况。将挑取的汗腺细胞团种于培养皿内,观察细胞贴壁和生长情况,并用流式细胞仪测定各组细胞的增殖指数,最后进行免疫细胞化学检测汗腺细胞标志性蛋白的表达。结果:A组和C组在消化30 min后,镜下可见少部分的汗腺细胞团,2 h后A组游离汗腺细胞团明显增多,C组游离汗腺细胞团很少;B组在消化6 h后,才出现部分游离的汗腺细胞团。将汗腺细胞团培养3 d后发现C组汗腺细胞贴壁情况差、成活细胞少;A组和B组的汗腺细胞贴壁情况良好,培养9 d后呈“铺路石样”生长,细胞增殖指数分别为(18±4)%和(17±6)%,无明显差异,免疫细胞化学结果表明:两组细胞癌胚抗原(CEA)和细胞角蛋白7(CK7)表达均为阳性。结论:胰蛋白酶-EDTA和Ⅱ型胶原酶联合消化法能明显缩短汗腺细胞的分离时间,且不影响细胞的活性和增殖特性。
汗腺; 胰蛋白酶; 胶原酶
皮肤是人体最大的器官,在抵御外界损伤,维持体温稳定,平衡物质代谢等方面起着重要的作用[1,2]。作为皮肤附属器的汗腺,在大面积深度烧伤患者中常常受到严重损伤,损伤部位分泌排汗、调节体温的功能丧失,这给患者带来极大的痛苦。目前,汗腺修复再生方面的研究,主要是诱导多能干细胞向汗腺样细胞的转分化,来修复再生汗腺[3]。在此研究过程中获取大量优质的汗腺是十分必要的,但目前分离获取外分泌汗腺存在着效率低下、消耗时间长的缺点。本实验旨在优化人外分泌汗腺细胞的分离方法,以高效的获取外汗腺细胞。
1 材料与方法
1.1 材料和试剂
全层正常皮肤来自解放军总医院第一附属医院普外科手术病人,术前经患者知情同意。Dulbecco's modified eagle medium(DMEM)和胎牛血清(Gibco公司),胶原酶Ⅱ型(Sigma公司),胰酶-EDTA(Solarbio公司),小鼠抗人CK7(ab82253)和兔抗人CEA(ab33562)单克隆抗体购自美国Abcam公司,山羊抗小鼠、山羊抗兔二抗购自北京中杉金桥公司。DMEM完全培养基和D-Hank’s溶液均由本实验室自行配制[4]。
1.2 外分泌汗腺分离培养
将手术切下约1.5 cm×2.0 cm大小的新鲜全层皮肤,置于含双抗的D-Hank’s平衡盐溶液中反复漂洗,除去皮下脂肪后,于60 mm培养皿中,剪为1 mm3大小的组织微粒[5, 6]。将所得的碎皮粒平均为三份后转移至培养皿中,A组加入5 ml胰蛋白酶-EDTA(胰蛋白酶0.25%,EDTA 0.53 mmol/L)与胶原酶Ⅱ1∶1的混合液,B组和C组分别加入5 ml的胶原酶Ⅱ型和胰蛋白酶-EDTA消化液,三组同时置于37℃、5%CO2饱和湿度的恒温培养箱中消化,每隔30 min镜下观察汗腺细胞团的游离情况。用10 μl的微量移液器在倒置相差显微镜下吸取游离的汗腺细胞团,放入含10%胎牛血清DMEM培养基的培养皿中,每皿放入大约13~20个汗腺细胞团,恒温培养箱中培养,并分别于3 d、6 d、9 d观察细胞的生长情况。
1.3 流式细胞仪测定细胞的增殖指数
培养9 d后收集约2×106个细胞,用75%的冷乙醇固定,离心弃上清,将细胞悬浮后,加入10 g/L RNAase 10 μl,37℃水浴孵育30 min后,立即放入冰浴中。加入5 mg/100 ml溴化乙锭染色(4℃,避光孵育30 min),用流式细胞仪(FACS Calibur)检测并分析结果。
1.4 免疫细胞化学检测CEA和CK7的表达情况
弃培养基,加入丙酮和甲醇混合液固定细胞25 min,磷酸盐缓冲液(PBS)清洗,用3%过氧化氢(H2O2)灭活固定细胞中的内源性过氧化物酶10 min。PBS浸洗3次,每次2 min。然后分别加入稀释后的一抗CEA和CK7,4℃冰箱中过夜。次日复温40 min后,PBS浸洗后加入二抗(辣根酶标记山羊抗小鼠/抗兔IgG),室温孵育30 min,PBS浸洗3次,每次2 min。二氨基联苯胺(DAB)现用现配(每5 ml加入250 μl DAB溶液)染色,苏木素复染,镜下观察并拍照。
1.5 统计学处理
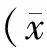
2 结果
2.1 不同消化方法分离汗腺的结果
A组在消化30 min后可见组织结构松散,出现了少部分的汗腺团,2 h后,可见大量汗腺细胞团,呈盘曲状聚集(图1A);B组在2 h仍见有大量纤维状胶原,未见游离汗腺细胞团(图1B),6 h后观察出现较多游离的汗腺细胞团;C组在30 min后可见极少数汗腺细胞团,汗腺团轮廓不清晰,伴随着大量的胶原纤维,在2 h后,汗腺细胞团很少(图1C,见彩图页Ⅳ),继续消化出现了一些腺体解离现象[4,7]。
2.2 汗腺细胞的生长状态和生长活性观察
A组获取的细胞培养3 d后,贴壁生长,周围有少量细胞开始由腺体向外周蔓延扩散(图2A);6 d后以腺体为中心,逐渐形成环状单层细胞,多呈扁平不规则的多边形(图2B);9 d后汗腺细胞在单层细胞的基础上逐渐形成“铺路石”样细胞群(图2C);B组获取的汗腺细胞生长过程和状态与A组相似(图2D、E、F,见彩图页Ⅳ);C组获取的汗腺腺体贴壁情况差,未见有明显的细胞生长。故后期实验不再采用C组细胞。
2.3 汗腺细胞的增殖指数测定结果
为了比较组A与组B获取的汗腺细胞在增殖能力方面的差异,我们测定了两组汗腺细胞的增殖指数。结果显示:A组获取的汗腺细胞增殖指数为(18±4)%,B组获取的汗腺细胞增殖指数为(17±6)%,两组之间无明显差异。
2.4 汗腺细胞表型的鉴定结果
对A、B两组获取的细胞进行表型鉴定,免疫细胞化学染色结果表明:在两组细胞中,汗腺细胞特异性标志蛋白CEA和CK7均表达阳性(图3,见彩图页Ⅳ),说明A、B两组所获取的细胞均为汗腺细胞[8]。
3 讨论
胰蛋白酶属于丝氨酸蛋白酶,通过松解细胞间连接而达到分离效应,消化作用很强,适应于绝大多数组织的消化与分离[9]。单用胰酶消化(C组),虽然消化迅速有效,但在后续的培养过程中发现,贴壁效果很差,存活细胞很少,效果很差。Ⅱ型胶原酶通过水解胶原蛋白的三维螺旋结构,使上皮细胞与胶原纤维得到分离,适用于纤维性组织的消化,但作用温和。传统的分离方法(B组)所消耗时间长,汗腺细胞团长时间暴露于消化酶中,细胞活力会受影响。采用酶联合消化的方法(A组),在其他条件不变的情况下,加快了获取汗腺细胞的时间,而且简单易行,不需要额外的设备。酶联合消化法的优点是获取外分泌汗腺细胞速度快,提取的细胞数量多。获取的汗腺细胞在随后的体外培养扩增中,通过镜下观察生长状态以及流式细胞仪的检测,发现细胞存活率及其生长增殖良好,验证了优化方法的效率[10]。本研究虽然提高了外分泌汗腺的获取效率,但是在汗腺相关的组织工程应用仍存在着几方面的问题:1细胞培养的过程中外分泌汗腺细胞生长增殖缓慢;2本文只探讨了酶联合消化法对于分离细胞的影响,其他方面的影响因素没有纳入系统的考虑中。
通过对传统消化方法的改良与优化,缩短了提取汗腺细胞的时间,为后续利用干细胞修复与再生汗腺的实验提供了方便,也为烧伤后汗腺功能恢复的临床治疗及汗腺相关组织工程研究奠定了基础。
[1] 张翠萍, 付小兵. 干细胞与汗腺再生的研究进展[J]. 感染、炎症、修复, 2012, 13(3): 179-181.
[2] Wilke K, Martin A, Terstegen L,etal. A short history of sweat gland biology[J].IntJCosmetSci, 2007, 29(3): 169-179.
[3] 付小兵. 中国的再生医学研究:需求与转化应用[J]. 解放军医学杂志, 2012, 37(03): 169-171.
[4] 周 岗, 李海红, 付小兵, 等. 人汗腺细胞的分离和纯化培养方法探讨[J]. 中国危重病急救医学, 2005, 17(02): 84-86.
[5] Lee CM, Carpenter F, Coaker T,etal. The primary culture of epithelia from the secretory coil and collecting duct of normal human and cystic fibrotic eccrine sweat glands[J].JCellSci, 1986, 83: 103-118.
[6] 雷 霞, 伍津津, 鲁元刚, 等. 人汗腺腺上皮细胞快速分离培养的初步研究[J]. 中华皮肤科杂志, 2006, 39(02): 86-88.
[7] Cai S, Pan Y, Han B,etal. Transplantation of human bone marrow-derived mesenchymal stem cells transfected with ectodysplasin for regeneration of sweat glands[J].ChinMedJ(Engl), 2011, 124(15): 2260-2268.
[8] Li HH, Zhou G, Fu XB,etal. Antigen expression of human eccrine sweat glands[J].JCutanPathol, 2009, 36(3): 318-324.
[9] 田 原, 于 利. 耳蜗外毛细胞的几种分离方法的比较及形态学观察[J]. 中国应用生理学杂志, 2008, 24(03): 373-376.
[10]赵 瑛, 蔡绍皙. 鼠骨髓间充质干细胞的分离培养及定向诱导分化为内皮样细胞[J]. 中国应用生理学杂志, 2010, 26(01): 60-65.
Optimization of primary human eccrine sweet glands’ isolation in vitro
ZHAO Huan-jun1,2, ZHAO Hong-liang2, TAN Zhi-jun1, CHEN Yan2, XU Yong-an3, ZHANG Mao3, ZHANG Cui-ping2△, FU Xiao-bing2△
(1. Tianjin Medical University, Tianjin 300070; 2. Key Laboratory of Tissure Repair and Regeneration, the First Affiliated Hospital of General Hospital of PLA, Beijing 100048; 3. the Second Affiliated Hospital, Medicine School of Zhejiang University, Hangzhou 310009, China)
Objective: To optimize the methods of isolating human eccrine sweat gland cells in vitro so as to get efficiently primary human sweat glands. Methods: The fresh and normal skin tissue was cut into pieces of microskin about 1mm3and the following 3 group digestion buffer was applied to isolated gland cells. The digestion buffer of group A was the equivoluminal mixture of Trypsin-Ethylene Diamine Tetraacetic Acid(EDTA) and collagenase-Ⅱ(2 mg/ml). The digestion buffer of group B was collagenase-Ⅱ(2 mg/ml) traditionally and group C was Trypsin-EDTA. These three groups were placed into an incubator simultaneously and the emerging time of dissociated sweat glands was calculated. Sweat glands were sorted out and then placed in culture dish. The adherence and the growth of cells were observed. The proliferation index was detected by flow cytometry. The identification of cultured cells was performed by immunocytochemical staining. Results: After digesting 30 min in group A and C, a very few of dissociated sweat glands were emerging. But after digesting for 2 h , there were lots of dissociated sweat glands emerging in group A rather than in group C. The emergence of dissociated sweat glands in group B would require at least 6 hours. After seeded in culture dishes, the sweat glands in group C couldn’t adhere to the wall of dish, but the sweat glands in group A and B adhered very well and even grew like paving stones after 9 days. In addition, the proliferation index were (18±4)% and (17±6)% respectively, there was no statistical difference. The results of immunocytochemical staining showed that the cells expressed carcino-embryonic antigen(CEA) and cytokeratin 7(CK7) in group A and B. Conclusion: Trypsin-EDTA combined with collagenase-Ⅱ can shorten the time of isolating sweat gland cells and have no effect on cell activity and proliferation.
sweat gland; trypsin; collagenase
国家973计划资助项目(2012CB518105);国家自然科学基金项目(81121004,81230041,81171798)
2014-10-22
2015-02-10
R331
A
1000-6834(2015)03-235-03
10.13459/j.cnki.cjap.2015.03.011
△【通讯作者】Tel: 010-66867391; E-mail: zcp666666@sohu.com,fuxiaobing@vip.sina.com

