运动结合单不饱和脂肪酸摄入对大鼠胰岛素抵抗的影响*
魏珊珊, 梁丹丹, 严晓波, 刘磊矗
(1. 重庆大学体育学院, 重庆 400044; 2. 合肥职业技术学院公卫教研室, 安徽 巢湖 238000)
运动结合单不饱和脂肪酸摄入对大鼠胰岛素抵抗的影响*
魏珊珊1△, 梁丹丹2, 严晓波1, 刘磊矗1
(1. 重庆大学体育学院, 重庆 400044; 2. 合肥职业技术学院公卫教研室, 安徽 巢湖 238000)
目的:通过观察运动结合单不饱和脂肪酸对SD大鼠胰岛素抵抗的影响,为糖尿病患者科学合理饮食及运动提供理论依据。方法:将SD大鼠随机分为空白对照组(C组)、饱和脂肪酸组(S组)、单不饱和脂肪酸膳食组(M组)、单不饱和脂肪酸+运动组(ME组),分别观察体重、体脂、血糖、空腹胰岛素(FINS)、总胆固醇(TC)、甘油三酯(TG)、内脏脂肪素(visfatin)的变化。结果:与C组相比,S组体重、体脂均增加(P<0.01),血糖、FINS、TG、TC升高(P<0.01),visfatin降低(P<0.05);与S组相比,M组体重及体脂无明显变化,但ME组体重及体脂相比S组及M组均有降低(P<0.05),M组及ME组血糖、FINS下降,TG、TC降低(P<0.01),LDL-C的水平下降(P<0.01),visfatin的水平升高(P<0.01),并且ME组血糖、FINS、TG、TC、LDL-C的水平低于M组(P<0.05),而血浆visfatin的水平则明显高于M组(P<0.05)。结论:与饱和脂肪酸饮食相比,运动及单不饱和脂肪酸饮食共同干预可以明显改善大鼠的胰岛素抵抗,并且变化的机制可能与内脏脂肪素的降低有关。
单不饱和脂肪酸;运动;胰岛素抵抗;内脏脂肪素
monounsaturated fatty acid diet; exercise; insulinresistance; visfatin
胰岛素抵抗(insulin resistance,IR)是2型糖尿病发生的基础,其发生除遗传因素的作用外,生活方式的影响最为突出,研究发现饮食中摄入脂肪酸的类型对胰岛素的利用也有不同影响,饱和脂肪酸(saturated fatty acid,SFA)摄入增多使IR的发生增加[1],而单不饱和脂肪酸(monounsaturated fatty acid,MFA)替代部分能量摄入有助于改善IR,但大量添加会带来的各种影响研究较少。本研究拟采用运动与单不饱和脂肪酸结合干预的方式,观察大鼠胰岛素抵抗的发展情况,为研究运动及饮食干预IR的机制提供新思路。
1 材料与方法
1.1 实验动物及分组
48只断乳SD雌性大鼠体重(90±3)g,均为5周龄,由重庆医科大学提供,随机分为4组(n=12):空白对照组(C组)、饱和脂肪酸组(S组)、单不饱和脂肪酸膳食组(M组)、单不饱和脂肪酸+运动组(ME组)。大鼠饲养于屏障环境中,明暗周期12 h(6∶00~18∶00),自由采食、饮水,温度(23±1)℃,湿度(50±5)%。
1.2 动物饲料
大鼠适应性喂养l周后,对照组给予维持日粮,能量含量为3.5 kcal/g,各组饮食总热量相同(热量组成:碳水化合物30%,脂肪50%,蛋白质20%),其中饱和脂肪酸组饮食采用猪油(单不饱和脂肪酸43.2%,多不饱和脂肪酸8.5%,饱和脂肪酸48.3%),单不饱和脂肪酸组采用油茶籽油(单不饱和脂肪酸80.3%,多不饱和脂肪酸5.65%,饱和脂肪酸14.05%,单不饱和脂肪酸+运动组饲料同上)。共喂养10周。
1.3 方法
ME组自喂养第2周起运动适应一周后进行游泳运动[4],水温34℃~36℃,每周5次。训练时间从30 min开始,逐渐增加运动时间,直到60 min,共训练8周。
每周一为大鼠称体重并记录,各组大鼠喂养方式一致。实验结束后,各组大鼠禁食8 h以上,腹主动脉取血,分离血清。取出附睾脂肪垫及肾周的脂肪垫,生理盐水冲洗,滤纸吸干称重,测定各大鼠体脂含量。血糖和空腹胰岛素(FINS)采用放免法测试,试剂盒由北京中杉金桥生物技术有限公司提供,TG、TC试剂购自于上海蓝怡科技有限公司,测试用全自动生化仪由重庆医科大学提供,大鼠内脂素(visfatin) ELISA分析试剂盒购自艾美捷科技有限公司。
以上测试均严格按照试剂盒说明要求测试。
1.4 统计学处理
2 结果
2.1 体重和脂体百分比
与C组相比,S组与M组大鼠体重、脂体百分比均增高(P<0.05,P<0.01),且M组与S组间并无明显差异。说明饱和脂肪酸及单不饱和脂肪酸的摄入都使大鼠体内的脂肪含量升高。
而进行8周游泳训练后,与M组相比,ME组脂体百分比下降,且ME组体重、脂体百分比也明显低于S组(P<0.01)。说明高单不饱和脂肪酸的摄入同样可能增加脂肪的积聚,而运动有明显促进体脂代谢、降低体重的作用(表1)。


GroupBodyweight(g)PBF(%)Control211.2±10.17.6±1.4S256.4±13.3∗∗15.0±1.2∗M241.2±9.5∗11.7±1.6∗ME203.7±7.3##△9.9±2.0##
S: Saturated fatty acid group; M: Monounsaturated fatty acid group; ME: Monounsaturated fatty acid and exercise group
*P<0.05,**P<0.01vscontrol group;#P<0.01vsS group;△P<0.05vsM group
2.2 饮食及运动干预后各组生化指标的变化
与C组相比,S组血糖、空腹胰岛素明显增高(P<0.01),血TG、TC升高,差异具有显著性(P<0.05),HDL-C则明显下降(P<0.05),LDL-C明显升高(P<0.01)。提示饱和脂肪酸饮食后胰岛素抵抗明显发生,且血脂代谢存在异常。与S组相比,M组血糖、空腹胰岛素均下降(P<0.05),但空腹胰岛素仍高于C组(P<0.05),血TG、TC也有明显降低(P<0.01)。LDL-C与S组相比降低,但HDL-C无明显变化。提示用单不饱和脂肪酸代替部分热量的饮食有助于改善胰岛素抵抗。ME组与S组相比,血糖、空腹胰岛素均降低(P<0.05),且血清胰岛素低于M组(P<0.05),LDL-C降低,HDL-C升高(P<0.05),但与C组、M组间无明显差异,结果提示运动与单不饱和脂肪酸脂肪酸共同作用后,胰岛素抵抗及血脂的代谢情况得到改善。
与C组相比,S组与M组空腹脂肪素(visfatin)升高(P<0.05),与S组相比,M组无明显差异,但ME组visfatin降低,并且ME组的水平明显低于M组(P<0.01,表2)。说明饱和脂肪酸饮食后,内脏组织分泌的空腹visfatin的上升与胰岛素抵抗的产生可能具有一定相关性,而增加单不饱和脂肪酸摄入后并无明显变化,但单不饱和脂肪酸饮食加8周运动后,血浆visfatin的水平都明显降低,提示饮食与运动联合干预可能是较强的改善脂肪代谢、刺激visfatin降低的因素,与改善胰岛素抵抗的程度有相关性。
3 讨论
高脂膳食的摄入与胰岛素抵抗发生有密切的联系,而运动可能通过降低游离脂肪酸、肿瘤坏死因子的水平,同时增加了脂联素脂肪动员,促进糖脂代谢的正常化[2]。目前研究发现改善胰岛素抵抗的有效方式为运动及膳食相结合,孙庆艳等研究发现[3],运动与膳食均可改变胰岛素的敏感性,但高脂饮食与低脂饮食分别结合运动后胰岛素指数无明显差异。
同时,许多研究开始关注饮食成分的构成,不饱和脂肪酸替代部分能量的饮食有助于改善糖脂利用,改善胰岛素抵抗,在2型糖尿病的发生发展过程中具有重要意义。但饮食中多不饱和脂肪酸及单不饱和脂肪酸的作用目前尚未统一,有研究表明,将糖耐量正常人群分为3组,分别给予饱和脂肪酸饮食、多不饱和脂肪酸饮食及单不饱和脂肪酸饮食,给予短期饮食干预,OGTT实验表明单不饱和脂肪酸组增高,空腹Visfatin显著升高,并且Visfatin与HOMA-IR呈明显负相关。说明单不饱和脂肪酸饮食在实验人群中可以改善胰岛素抵抗[4]。并且单不饱和脂肪酸饮食的影响还反映短期Visfatin升高可以降低血糖,长期visfatin升高又加速脂肪细胞的堆积,造成visfatin分泌过多,形成IR[5]。
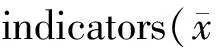
Tab. 2 Contrast of blood sugar, blood serum and other biochemical ±s, n=12)
S: Saturated fatty acid group; M: Monounsaturated fatty acid group; ME: Monounsaturated fatty acid and exercise group; FINS: Fasting serum insulin; TG: Triglycerides; TC: Total cholesterol; HDL-C: High density lipoprotein cholesterol; LDL-C: Low density lipoprotein cholesterol
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsS group;△P<0.05vsM group
内脏脂肪素(visfatin)是一种脂肪细胞因子[6],内脏脂肪素具有降低血糖、调节脂肪形成、调节炎症与免疫反应和类胰岛素样等作用,提示它可能和2型糖尿病、肥胖、胰岛素抵抗密切相关[7],但对其在胰岛素抵抗形成过程中的作用并不清楚。有研究表明内脏visfatin的基因表达与内脏脂肪量呈正相关,而visfatin本身对与胰岛素水平及血糖的水平调节并不明显,更有可能是通过胰岛素下游IRS-1,P13K等信号传导途径作用,通过调节内脏脂肪组织形成参与胰岛素抵抗的过程[8]。但目前各种相关研究结论并不统一。
已有研究显示运动可以促使肌肉及脂肪组织释放IL-6,引起循环中IL-6浓度增高[9],因而运动最终可以通过抑制脂肪组织内visfatin的基因表达,从而达到运动减少内脏脂肪的效果。这可能是运动减少visfatin进而改善肥胖的机制之一。
本次实验将单不饱和脂肪酸饮食与运动干预相结合,实验结果表明,与饱和脂肪酸饮食组大鼠相比,只采用单不饱和脂肪酸饮食干预的大鼠,体重、体脂仍然增加,可能与单不饱和脂肪酸摄入的含量相关,即使采用单不饱和脂肪酸替代部分热量,大量摄取仍有可能引起脂肪的积聚。单不饱和脂肪酸结合8周运动组大鼠则体重、体脂都能够控制在正常范围内,说明饮食结合运动仍然是改善肥胖的首选。只采用单不饱和脂肪酸饮食干预的大鼠,血糖、FINS、血脂均比饱和脂肪酸组降低,但血浆visfatin并无明显变化。相比下饮食结合运动干预的大鼠,FINS、TG、TC的水平更加接近正常范围,LDL-C的水平明显降低,血浆visfatin则明显下降,内脏脂肪含量的下降一致。本研究表明单不饱和脂肪酸结合运动的干预方式优于只采用单不饱和脂肪酸干预的方式,饮食及运动共同作用有助于平衡能量代谢,改善胰岛素敏感性,作用机制可能与visfatin对内脏脂肪合成的调节有关,进一步的研究将有助于明确visfatin在胰岛素抵抗中的具体机制。
[1] Fung TT, Rexrode KM, Mantzoros CS,etal. Mediterranean diet and incidence of and mortality from coronary heart disease and stroke in women[J].Circulation, 2009, 119(8): 1093-1100.
[2] 魏珊珊, 梁丹丹. 运动对高脂饮食大鼠TNF-α、IL-6及脂联素的影响[J], 中国应用生理学杂志, 2013, 3: 280-282
[3] 孙庆艳, 李苗苗, 李古州, 等. 运动和低脂膳食对胰岛素抵抗大鼠肿瘤坏死因子α表达的影响[J]. 中国应用生理学杂志, 2014, 30(2): 180-183
[4] 卢亚敏, 宋光耀, 李 萍. 不同脂肪酸饮食对糖耐量正常人群内脏脂肪素及其胰岛素抵抗的影响[J]. 中国糖尿病杂志, 2012, 1(20): 17-19.
[5] 孙 勤, 李 伶, 杨刚毅. 内脂素基因过表达对胰岛素抵抗大鼠胰岛素敏感性的影响[J]. 中华医学杂志, 2008, 88(6): 365-368.
[6] Genser B, Dias KC, Siekmeier R,etal. Lipoprotein(a) and risk of cardiovascular disease-a systematic review and metaanalysis of prospective studies[J].ClinLab, 2011, 57(3-4): 143-156.
[7] Krzyzanowska K, Krugluger W, Mittermayer F,etal. Increased visfatin concentrations in women with gestational diabetes mellitus [J].ClinSci(Lond), 2006, 110(5): 605-609.
[8] 高 峰, 何玉秀, 郝 强, 等. 早期游泳运动对过度喂养肥胖大鼠内脏脂肪积累和食欲肽表达的影响[J]. 中国体育科技, 2014, 50(2): 38-45.
[9] 尚 敬, 陈璐璐, 孙 晖. 运动干预对高脂喂养大鼠脂肪组织内脏脂肪素表达的影响[J]. 中国现代医学杂志, 2008, 18(5): 551-554.
中央高校基本科研业务费资助(CQDXWL-2014-020)
2014-10-20
2015-03-02
R589
A
1000-6834(2015)03-269-03
10.13459/j.cnki.cjap.2015.03.020
△【通讯作者】Tel: 13206061593; E-mail: necoo888@163.com

