大黄鱼病原哈维氏弧菌(Vibrio harveyi)拮抗菌的筛选及益生菌特征的分析
■王梦霞 朱晓玲 王君如 刘嘉佩 刘雪珠
(浙江海洋学院海洋科学与技术学院,浙江舟山 316022)
大黄鱼(Larimichthys crocea)隶属硬骨鱼纲、鲈形目、石首鱼科、黄鱼属,主要分布在我国黄海南部、东海、台湾海峡以及南海。自1995年起,人工养殖大黄鱼逐渐产业化[1],作为我国近海的主要经济鱼类,大黄鱼也是浙江省海水网箱养殖主要品种之一。但随着养殖业的大规模发展,各种病原性鱼病日渐泛滥,大黄鱼疾病的致病因素繁多,微生物引起的大黄鱼鱼病可概括为三类:病毒性鱼病、寄生性鱼病及细菌性鱼病[2]。弧菌是危害经济鱼、虾、蟹、贝类的主要病原菌,病原性弧菌的感染已成为引起大黄鱼疾病的重要原因。抗生素的使用成为解决这一养殖问题的一大较为经济普遍的方式,但因之而起的抗生素滥用所带来的威胁却不容小觑[3],其往往会破坏水体中的微生态平衡,导致耐药微生物的增加,并使鱼体产生药源性器官损伤[4]。近年来从免疫学角度进行的鱼病防治工作主要是将一些病原通过灭活制成疫苗,再通过注射等途径使鱼体对特定的疾病有一定的抵抗能力[5]。从环保及科学养殖的角度出发,通过微生物技术制备益生菌制剂不仅可以解决抗生素滥用带来的问题,防治消化道疾病、帮助消化吸收和刺激免疫系统,还可以改善水体质量[6-7]。目前,应用于实际生产的水产益生菌包括乳酸菌属、双歧杆菌属、弧菌属、假单胞菌属、芽孢杆菌、硝化菌、光合菌等[8]为数不多的几种。近年,Surajit Das等在研究中还发现一种海洋放线菌属的链霉菌可作为益生菌在水产养殖中应用[9]。不过,目前的研究仍未找到针对大黄鱼疾病防治的特异性益生菌。本文用点种法定性初筛、酶标法及牛津杯法定量复筛,从实验室保存的在海洋生物体中分离得到的未知海洋微生物中筛选对大黄鱼病原性哈维氏弧菌(Vibrio harveyi)具有较强拮抗作用的拮抗菌,并从抗菌谱、生长优势、药敏检测、碳源利用等方面进一步分析目的拮抗菌作为益生菌的特征,以期为大黄鱼弧菌病防治及益生菌的开发提供可参考的菌种。
1 材料与方法
1.1 材料
试验菌:从舟山海域潮间带海洋生物体中分离的细菌、放线菌等。
病原菌:哈维氏弧菌(Vibrio harveyi)。
指示菌:溶藻弧菌(V.alginolyticus)、副溶血弧菌(V.parahaemolyticus)、创伤弧菌(V.vulnificus)、费氏弧菌(V.fischeri)、鳗弧菌(V.anguillarum)。以上各弧菌指示菌由浙江海洋研究所提供。大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus),以上指示菌为实验室用菌,保存于4℃冰箱。
培养基:TCBS培养基、MH培养基购于杭州微生物试剂有限公司。2%NaCl营养琼脂平板、LB固体培养基、高氏Ⅰ号培养基、LB营养肉汤、明胶培养基、硫化氢培养基、淀粉琼脂平板均由实验室配制。
1.2 方法
1.2.1 病原哈维氏弧菌拮抗菌的筛选
参照莫照兰等[10]的方法进行点种法初筛。参照Gram等[11]的方法,根据酶标仪测得的OD630值定量复筛拮抗菌。参考刘冬梅等[12]的方法,用牛津杯法定量再筛,确定目的拮抗菌。
1.2.2 生长曲线绘制
参照Niall等[13]的方法,有改动。根据酶标仪所测OD630值绘制生长曲线,选取生长曲线上最陡的7个点做生长曲线拟合度直线,直线斜率即为最大生长率(μ),直线在X 轴上的截距为延滞生长期(λ),生长曲线稳定期切线在Y轴上的截距为最大生物量(A)。根据公式Td=ln2/μ求得倍增时间(Td),根据公式RI/100=I/(λ×Td),求得各菌株生长参数(RI)。
1.2.3 抗菌谱测定
测定两株目的拮抗菌对8株指示菌的抗菌情况,采用的牛津杯法类似前文所述。取0.3 ml病原指示菌悬液于培养皿,倾注2%NaCl营养琼脂制成混菌平板。待平板稍凝固后,用镊子夹取无菌牛津杯均匀放在平板上。吸取200 μl目的拮抗菌的上清液和菌液于各牛津杯内,30℃培养24 h后测定抑菌圈直径。
1.2.4 药敏试验检测
参照抗菌药物药敏纸片判断标准(2000年版)介绍,用MH培养基为基础培养基。待培养基溶化后,制成厚度为4 mm的平板。挑选待测目的拮抗菌纯菌落接种于营养肉汤培养基中,30℃摇床培养12 h。用灭菌的棉签蘸取菌液少许,均匀涂于平板上,待干后,用灭菌镊子分别取药敏纸片均匀贴于培养基表面,并用镊子轻按纸片中心,使其附着严密。30℃倒置培养18 h,用游标卡尺测量抑菌环直径,根据美国CLSI手册中药敏试验药敏性判断标准判断目的拮抗菌对被测药物的敏感性。
1.2.5 菌株的形态观察及生理生化鉴定
采用插片法进行目的拮抗菌株的形态观察。将两株目的拮抗菌X14及X15在高氏1号培养基中密集划线接种,在30℃恒温培养箱中培养3、5、7 d,观察生长情况,基内菌丝及气生菌丝等形态特征。
采用明胶液化,淀粉水解,硫化氢产生及牛奶凝固与胨化及Biomerieux的API试条测定X14、X15目的拮抗菌的一些生理生化特性。在30℃恒温培养数天后观察试验现象并作记录。
1.2.6 16S rDNA测序分析和进化树的构建
提取X14、X15菌株的DNA,采用细菌16S rDNA引物:341F(5'-CCTACGGGAGGCAGCAG-3')和907R(5'-CCGTCAATTCCTTTGAGTTT-3'),一定条件下进行PCR扩增。制备感受态细胞、转化、克隆,对克隆后菌液进行PCR扩增检测,确保成功获得转化子。以载体上的引物作为测序引物序列,委托苏州金唯智生物测序公司测序。菌株16S rDNA测序结果同GenBank数据库中选取的与菌株亲缘关系较近菌株,用MEGA 5.0软件采取Neighbor-Joining算法构建系统发育树,1 000次重复计算Bootstrap值,进行系统发育分析。
2 结果
2.1 拮抗菌的筛选
用点种法在实验室保存的65株未知的海洋微生物菌株中,获得18株出现抑菌圈的初筛拮抗菌。酶标法复筛,从生长曲线对比图1(a,b,c,d)可看出各试验菌的拮抗效果。在试验菌发酵上清液拮抗下的指示菌生长曲线居于空白指示菌生长曲线之下的均可能存在拮抗效果。因此,初步确定X15、Y13、Y26、Y36、Z10、X14、Z5、Z9、Y9、Z11、Y27、Z4、Y25、Y24、Z6、Z1具有对指示菌哈维氏弧菌的拮抗作用。

图1 指示菌在试验菌发酵上清液拮抗下的生长曲线对比图(a,b,c,d)
通过用牛津杯法直接测量抑菌圈直径大小,并经过计算机数据分析,计算均值及标准误差如表1所示,可间接得出酶标法测得的16株试验拮抗菌对指示菌哈维氏弧菌的拮抗效果,从而确定最佳目的拮抗菌为X14菌株和X15菌株。
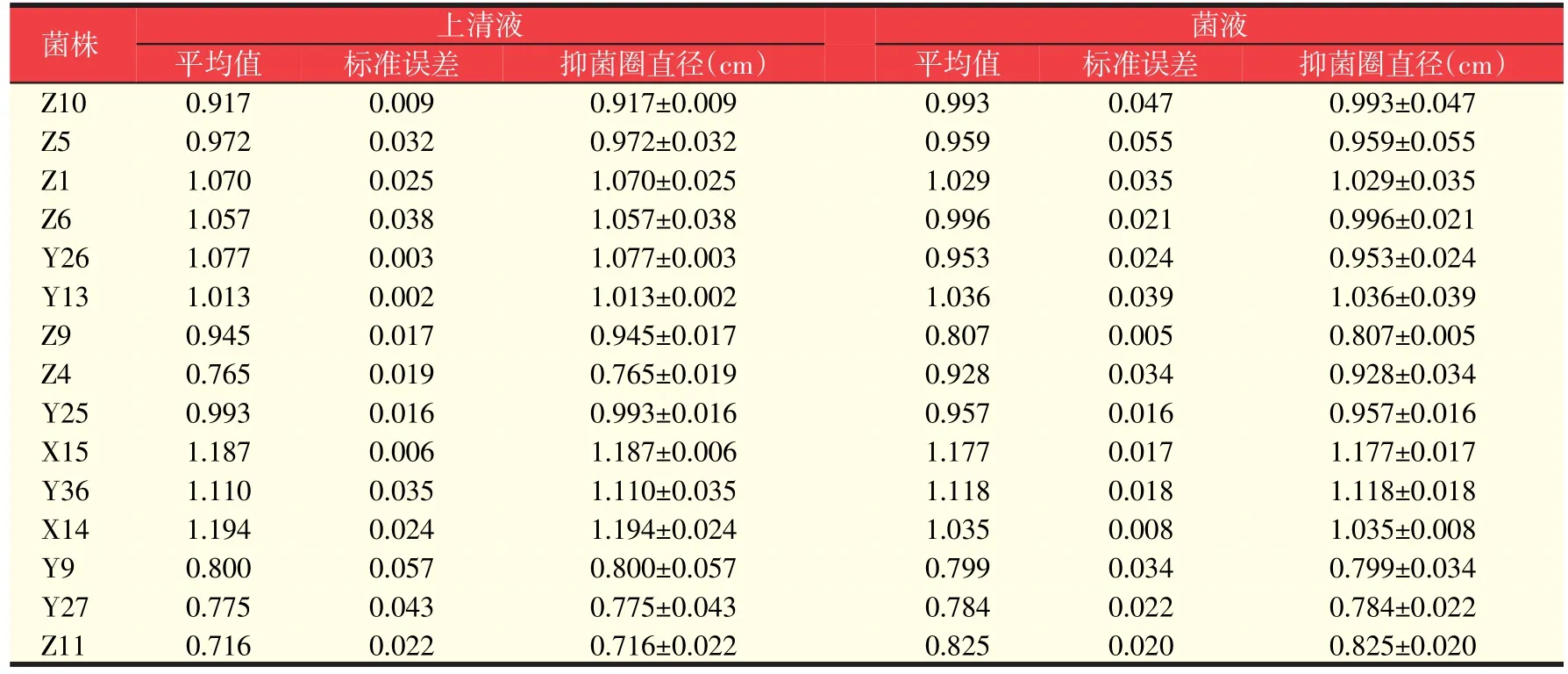
表1 牛津杯法测得抑菌圈直径(cm)
2.2 益生菌特征的分析
2.2.1 生长曲线
如表2所示,列出了从两株拮抗菌和两株病原弧菌生长曲线中推导得到的生长参数,从中可看出两拮抗菌最大生长率较两株病原菌大,但最大生物量较两株病原菌小,延滞期也都较病原菌小,倍增时间都小于两株病原菌。RI值较大的菌株具有短的延滞期和短的倍增时间,具有生长优势。两株拮抗菌在相同的条件下可能较两株病原菌更具生长优势,且X14生长优势强于X15。

表2 两株拮抗菌和两株病原弧菌生长曲线参数
2.2.2 拮抗菌抗菌谱
根据试验测得的抑菌圈直径,计算标准误差,X14及X15菌株的抗菌谱如表3所示。抗菌谱研究表明,对病原哈维氏弧菌具有拮抗作用的X14、X15菌株,对其余8株试验病原指示菌也表现出大小不一的拮抗作用。目的拮抗菌的菌液及无菌发酵上清液均具有抗所列病原指示菌的作用,但X14菌株在拮抗副溶血弧菌时,发酵上清液的拮抗效果明显好于菌液;而X15菌株在拮抗枯草芽孢杆菌时上清液好于菌液,作用大肠杆菌时,菌液拮抗效果明显优于发酵上清液。X14对费氏弧菌的抗性相对最优,X15对枯草芽孢杆菌的抗性最优。总体而言,两株目的拮抗菌体现出一定的抗菌广谱性。

表3 X14、X15菌株发酵上清液及菌液抗菌谱
2.2.3 药敏性
参考美国CLSI手册中药敏试验药敏性判断标准,两株分离得到的菌株X14及X15对四环素、环丙沙星、庆大霉素、氨苄西林、头孢噻肟、复方新诺明、头孢噻吩、利福平、萘啶酸、阿莫西林10种抗菌药物敏感,具体抑菌环直径及敏感性等级见表4。

表4 X14、X15菌株对10种抗菌类药物的敏感性
2.3 目的拮抗菌鉴定结果
2.3.1 拮抗菌株形态和生理生化特征
将筛选到的目的拮抗菌X14、X15菌株在高氏1号培养基上培养,均生长良好,形成发达的气生菌丝和基内菌丝,气生菌丝呈灰白色,基内菌丝呈黄灰色。菌株X14孢子丝呈簇状,孢子卵形;菌株X15孢子丝为微螺旋形,孢子圆形。两菌株在高氏1号培养基上均产生明显的可溶性色素。
用Biomerieux的API试条测定X14、X15生理生化特性中,发现两菌株都能利用多种糖类,碳源谱利用比较广。在10种糖类中,X14可以利用7种,X15可以利用8种,其结果及其余各项生理生化指标测定由表5所示。

表5 X14、X15菌株生理生化测定结果
2.3.2 16S rDNA系统发育分析
经克隆和测序得到两株拮抗菌X14和X15的部分16S rDNA基因序列,序列长度分别为568 bp和584 bp。将上述16S rRNA基因序列与Genebank中所有已登录的基因序列进行同源性比较结果显示与16S rDNA基因同源性达99%以上的菌株均来自链霉菌属(Streptomyces),菌株16S rDNA测序结果同Gen-Bank数据库中选取的与菌株亲缘关系较近菌株,用MEGA 5.0软件采取Neighbor-Joining算法构建系统发育树进一步建立系统发育树,如图5、6所示。结果显示菌株X15与灰平链霉菌(Streptomyces griseoplanus)相似性最高,但结合形态特征及理化性质未能确定两菌株到种。

图2 X14菌株16S rDNA及最大同源性序列系统发育树
3 讨论
目前的研究还未找到专门针对大黄鱼的益生菌,我们选择海洋动物体上获得的一些海洋微生物作为试验菌,筛选大黄鱼病原哈维氏弧菌的拮抗菌株。

图3 X15菌株16S rDNA及最大同源性序列系统发育树
①用点种法定性初筛,从65株海洋菌株中筛选出18株病原哈维氏弧菌的拮抗菌,再用酶标法和牛津杯法进一步定量复筛后,得到2株保持较好拮抗效果的菌株X14及X15。一些菌株在筛选过程中抗菌效果减弱的原因可能是在培养基上经多次传代或多次低温保种,出现适应或遗传变异等现象使得这些菌株的拮抗作用不稳定。作为益生菌,能长期保持对特定菌株拮抗作用是其必备条件之一,因此在复筛中只表现出暂时抗性的菌株不适合作为益生菌。
②抗菌谱结果显示,两株菌对海洋环境中广泛存在的溶藻弧菌、副溶血弧菌、创伤弧菌、鳗弧菌、费氏弧菌等5种致病弧菌及普通致病菌大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌均具有拮抗作用,符合作为益生菌具有广谱抑菌活性的要求。还可看出,无菌上清液和菌液在不同菌株上的拮抗效果不尽相同,若在实际应用中还需针对不同菌株使用不同益生菌及其制剂。
③从生长参数结果可知,两株拮抗菌在相同的条件下较两株病原菌更具生长优势,且X14的生长优势强于X15。益生菌往往与饵料一起投喂,而鱼类在与环境进行物质交换时速度相对较快,与食物一起进入肠道的益生菌如果不能较快地生长及粘附很容易被排出体外而流失。鱼类肠道益生菌必须具有较大的生长优势,利用较短的时间快速大量繁殖,一定数量的菌体才能更好地在肠道内与肠黏液粘附,产生抗菌活性物质拮抗病原菌[14]。
④水产养殖中使用的益生菌含有抗生素抗性基因易导致水产养殖中出现多重耐药病菌,而筛选得到的两目的菌株药敏试验均显示为敏感型,不具抗药性。有研究证明水产动物出现抗药性是因为合成抗生素滥用,直接使用链霉菌作为益生菌可降低抗性基因横向转移率[14]。
⑤两菌株在生理生化测定中显示均能利用多种糖类,且X15菌株具有有效分解淀粉的能力,而大多数海洋鱼类对高糖饵料中糖类的处理能力很弱,消化道中淀粉酶的活性很低,饵料中的淀粉在营养上基本是无用成分[15],若能将所筛选的菌株作为益生菌用于大黄鱼肠道,其较广的糖类利用及较强的淀粉酶活性可以帮助大黄鱼利用饵料中的糖类淀粉,有助于减轻大黄鱼肝脏糖类积蓄的负担,利于大黄鱼的正常代谢功能。
⑥经16S rDNA基因同源性分析并结合形态及生理生化结果,两株海洋微生物均属放线菌中的链霉菌属(Streptomyces),虽然目前实际生产中应用较为普遍的水产益生菌有乳酸菌、芽孢杆菌、假单胞菌、弧菌等细菌性微生物,但近年来,海洋放线菌也逐渐被应用于预防及治疗水产养殖致病菌引起的病害。Das等研究报道,海洋链霉菌可作为益生菌用来促进斑节对虾(Penaeus monodon)的生长[9]。游建岚等的研究表明,利用海洋放线菌治疗和预防病原性弧菌引起的虾病害,其能抑制弧菌菌膜的形成,在养殖池水中能产生抗菌类物质并高效分解淀粉、蛋白等大分子,还可以产生耐热耐干燥的孢子等优点,海洋放线菌具有成为水产益生菌的潜力[16-17]。
4 结论
用点种法定性初筛、酶标法和牛津杯法定量复筛,从海洋生物体上获得的65株菌中筛选出2株具有较高抗病原哈维氏弧菌的菌株X14、X15为目的拮抗菌。在对两株益生菌特征分析的研究中,抗菌谱及生长曲线结果显示菌株X14、X15具有较广的抗菌性,且两株拮抗菌在相同的条件下可能较两株病原菌更具生长优势。药物敏感性试验结果表明,分离菌株对四环素、环丙沙星、庆大霉素、氨苄西林、头孢噻肟、复方新诺明、头孢噻吩、利福平、萘啶酸、阿莫西林等10种药物敏感。16S rDNA基因同源性分析的结果显示与X14、X15同源性达99%以上的菌株均来自链霉菌属(Streptomyces),进一步建立系统发育树,结果显示菌株X15与灰平链霉菌(Streptomyces griseoplanus)相似性最高,但结合形态特征及理化性质不能将两菌株确定到种。筛选得到的菌株X14、X15在拮抗病原哈维氏弧菌、抗菌谱、生长优势及药敏性等方面均初步满足益生菌的筛选条件。

