西格列汀对2型糖尿病小鼠胰岛β细胞自噬相关因子表达的影响
吴彦菊,关一夫
(中国医科大学,沈阳110122)
西格列汀是一种二肽基肽酶4(DPP-4)抑制剂,是治疗2型糖尿病的新型药物。其主要通过高选择性抑制DPP-4,增加血中有活性胰高血糖素样多肽1(GLP-1),促进胰岛素分泌,抑制胰高血糖素分泌,发挥改善血糖调控的作用,且低血糖等不良反应发生率低[1~3]。研究表明,西格列汀单一及联合用药,具有抑制胰岛β细胞凋亡,促进β细胞增殖,改善胰岛β细胞功能的作用[3~5]。但是,其改善胰岛β细胞功能的确切机制尚需深入研究。胰岛β细胞功能进行性衰竭是2型糖尿病发生、发展的重要机制。有研究在2型糖尿病患者胰岛β细胞中检测到了自噬体及自噬相关因子的表达[6],提示自噬参与胰岛β细胞进行性衰竭的过程。2014年4~9月,我们从动物整体水平探究西格列汀对胰岛β细胞自噬相关因子 Atg12、Atg3及 Beclin1表达的影响,观察其与改善胰岛β细胞功能的关系。
1 材料与方法
1.1 材料 8周龄雄性db/db小鼠,共30只,由南京模式动物研究所提供。
1.2 方法
1.2.1 实验动物模型构建及分组 西格列汀(默沙东,美国);RNA提取试剂盒(Omega,美国);逆转录试剂盒(Thermo,美国);RT-PCR试剂盒(Takara,日本);兔抗Beclin1抗体(Abcam,美国);抗胰岛素抗体(Cell Signaling Technology,美国);抗胰高血糖素抗体(Abcam,美国);标记Alexa-488及Alexa-596的二抗(Jackson,美国);SABC免疫组化试剂盒(博士德,武汉)。胰岛素 ELISA试剂盒(Millipore,美国)。酶标仪(Thermo,美国),血糖仪及试纸(强生,美国),低温立式离心机(KUBOTA,日本),荧光定量 PCR 仪(ABI,美国),化学发光仪(Thermo,美国),共聚焦显微镜(OLYMPUS,日本)。适应性喂养1周后,经尾静脉取血检测血糖,30只小鼠血糖均超过16.7 mmol/L,视为糖尿病动物模型构建成功。将db/db小鼠随机为2组:糖尿病对照组(DC组)与西格列汀治疗组(DT组),每组15只。DT组小鼠每日晨9时灌胃给予西格列汀(80 mg/kg)1次,DC组小鼠给与等体积饮用水灌胃,共干预5周。实验用db/db小鼠饲养于屏障环境中,鼠笼、饮水瓶等用具均经高压灭菌消毒,SPF级饲料喂养,每日更换垫料及饮用水,维持室温24~26℃,湿度55% ~65%,12 h照明。
1.2.2 标本收集 治疗5周后,将所有小鼠以颈椎脱臼法处死,打开腹腔,剥离完整胰腺;生理盐水冲洗,将胰腺从中央剖成两部分,一半冻存于液氮中,用于提取RNA及组织胰岛素;另一半浸泡于4%多聚甲醛溶液固定,以制备石蜡切片。血标本以心脏穿刺法采取,4℃离心(3 000 r/min,10 min)后,分离血清,-20℃冰箱中储存。
1.2.3 血糖水平检测 实验期间,每周给药前检测小鼠血糖1次,血标本经尾静脉穿刺采取,血糖值以强生血糖仪检测,采血前小鼠禁食2 h。
1.2.4 血清及胰腺组织胰岛素检测 血标本经尾静脉穿刺采取,ELISA法检测血清胰岛素。取绿豆大小胰腺组织,加入1 mL预冷的盐酸乙醇溶液,冰上充分研磨,4℃孵育16 h。4℃离心(12 000 r/min,5 min)后,取上清,ELISA法检测胰岛素浓度。向各样品离心后的沉淀中加入1 mL RIPA裂解液,制备蛋白样品,并测定蛋白浓度。测得胰岛素浓度与蛋白浓度的比值即为各样品组织胰岛素的含量。
1.2.5 胰腺组织胰岛素与胰高血糖素检测 采用免疫荧光染色。胰腺组织石蜡切片的处理流程与免疫组化一致。加入稀释后的抗胰岛素抗体(1∶800)与胰高血糖素抗体(1∶2 000),4℃孵育14 h;Alexa-488及Alexa-596标记的二抗(1∶200),室温孵育2 h;加入荧光二抗后,所有操作均避光;甘油封片,共聚焦显微镜观察并拍照(×200)。胰岛素阳性染色区即β细胞呈现红色荧光,胰高血糖素阳性染色区即α细胞呈现绿色荧光。
1.2.6 胰腺组织Caspse3活性检测 将1 mL预冷的RIPA裂解液加入黄豆大小胰腺组织中,冰上研磨,孵育30 min。4℃离心(12 000 r/min,20 min)后,取上清,BCA法测定蛋白浓度。按照Caspase3活性检测试剂盒的说明进行操作,以化学发光仪检测待测样品的生物荧光强度(RLU)。测得生物荧光强度(RLU)与蛋白含量(μg)的比值即为各样品有活性Caspase3的含量。
1.2.7 胰岛 β 细胞 Atg3、Atg12及 Beclin1基因检测 采用实时荧光定量PCR法。按照Omega试剂盒操作指南提取总RNA;逆转录为cDNA。引物以Primer5.0软件设计,由金思瑞生物科技公司合成,序列如下:Atg3引物:上游 5'-ACGCTGGAGGTGAAGATG-3',下 游 5'-CCTGCATGGGTGAACTGA-3',扩增产物长度为236 bp。Atg12引物:上游5'-TTGGAGGCATAGACAGACAC-3',下游 5'-TATGTGTATTCCGTGCCATC-3',扩增产物长度为 200 bp。Beclin1引物:上游5'-GTTGCCGTTATACTGTTCTG-3',Beclin1 下游 5'-CCTCCAGTGTCTTCAATC-3',扩增产物长度为 180 bp。GAPDH引物:上游 5'-CCATGTTTGTGATGGGTGTGAACCA-3',下游 5'-ACCAGTGGATGCAGGGATGATGTTC-3',扩增产物长度为 251 bp。反应体系(25 μL):cDNA 2 μL,SYBR Premix Ex Taq 12.5 μL,上、下游引物(浓度 5 μmol/L)各 1 μL,灭菌蒸馏水 8.5 μL。反应条件:预变性95 ℃,30 s;变性95 ℃,30 s;退火58 ℃,30 s;延伸72℃,30 s;共38个循环。以GAPDH为管家基因,计算各基因的相对表达。
1.2.8 胰岛β细胞Beclin1蛋白检测 将固定后的胰腺组织制备成4 μm的石蜡切片,经脱蜡、水化等处理后,采用SABC法检测Beclin1蛋白表达。灭菌PBS稀释的抗Beclin1抗体(1∶100),4℃孵育14 h;HRP标记的二抗37℃孵育30 min;DAB显色,苏木素复染并封片。倒置显微镜观察胰岛组织,每张切片选取3个不重叠视野拍照(×400),Image proplus软件计算胰岛Beclin1阳性表达区的平均光密度值。
1.2.9 统计学方法 采用SPSS19.0统计软件。计量资料以±s表示,采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组血糖水平比较 见表1。
表1 两组血糖水平比较(n=15,±s)

表1 两组血糖水平比较(n=15,±s)
组别 血糖(mmol/L)第1周 第2周 第3周 第4周 第5周DC 组 21.55 ±3.14 24.26 ±3.13 26.50 ±3.01 28.54 ±3.16 30.96 ±2.92 DT 组 21.66 ±2.83 24.08 ±2.22 24.49 ±2.00 23.78 ±1.89 22.17 ±1.94 t 0.11 0.18 2.16 4.98 9.70 P 0.916 0.856 0.039 0.000 0.000
2.2 两组血清胰岛素及组织胰岛素比较 见表2。
表2 两组血清胰岛素及组织胰岛素比较(±s)

表2 两组血清胰岛素及组织胰岛素比较(±s)
组别 n 血清胰岛素(ng/mL)组织胰岛素DC组6 5.02 ±0.83 15.39 ±3.51 DT 组 6 7.34 ±0.96 33.31 ±3.73 t 4.46 8.56 P 0.001 0.000
2.3 两组胰腺组织胰岛素与胰岛血糖素检测结果DC组小鼠胰岛α细胞(胰岛素)散布于胰岛中,所占比例大;DT组小鼠β细胞(胰岛血糖素)所占比例大,分布于胰岛的中央,α细胞分布于胰岛的周边,所占比例小。见插页Ⅲ图9。
2.4 两组胰腺组织 Caspase3活性比较 DC组caspase3 活性为3.07 ±0.73,DT 组为1.72 ±0.42,t=3.94,P=0.002。
2.5 两组胰岛β细胞Atg3、Atg12及Beclin1 mRNA相对表达比较 见表3。
表3 两组胰岛β细胞Atg3、Atg12及Beclin1 mRNA相对表达比较(±s)
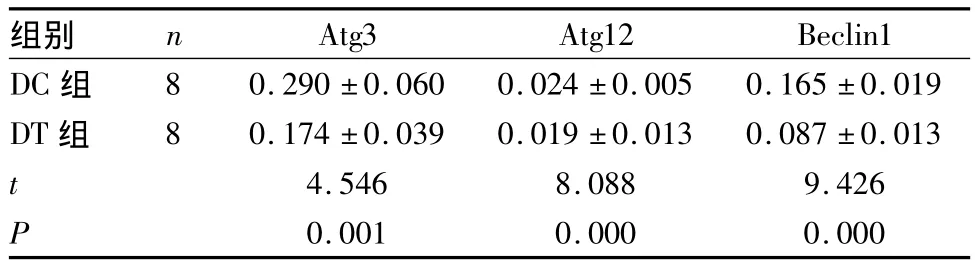
表3 两组胰岛β细胞Atg3、Atg12及Beclin1 mRNA相对表达比较(±s)
组别 n Atg3 Atg12 Beclin1 DC组8 0.290 ±0.060 0.024 ±0.005 0.165 ±0.019 DT 组 8 0.174 ±0.039 0.019 ±0.013 0.087 ±0.013 t 4.546 8.088 9.426 P 0.001 0.000 0.000
2.6 两组胰岛β细胞Beclin1蛋白表达比较 棕黄色染色区即为Beclin1阳性表达区,主要位于胰岛β细胞胞质,见插页Ⅲ图10。半定量分析发现,DC组与DT组小鼠胰岛β细胞Beclin1蛋白表达分别为 12.37 ±2.11和 7.43 ±1.23,P <0.01。
3 讨论
西格列汀无论短期还是长期治疗均可发挥降糖及改善胰岛β细胞功能的作用[4,5]。在本研究中,西格列汀治疗降低了2型糖尿病小鼠的血糖水平。免疫荧光染色结果显示,西格列汀治疗后,糖尿病小鼠胰岛β细胞所占比例大,位于胰岛的中央,α细胞位于胰岛周边,分布趋于正常。进一步检测胰岛素水平发现,DT组小鼠血清胰岛素及组织胰岛素水平较DC组显著增加,提示西格列汀治疗增强了糖尿病小鼠胰岛β细胞合成及分泌胰岛素的能力,改善血糖调控及β细胞功能。
既往研究表明,拮抗β细胞凋亡是西格列汀改善胰岛β细胞功能的重要机制[7]。随着研究者对自噬深入探究,逐步发现自噬与细胞凋亡密切相关。自噬,又称Ⅱ型程序性细胞死亡,是指将细胞中的大分子物质和细胞器等运输至自噬溶酶体进行大量降解的生物学过程[8]。Beclin1、Atg3及 Atg12等多种自噬相关蛋白参与自噬体的形成,并通过多种机制调节细胞凋亡。本研究已在糖尿病小鼠胰岛β细胞中检测到Atg3、Atg12及Beclin1等自噬相关因子的表达,且西格列汀治疗后,2型糖尿病小鼠胰岛β细胞中自噬相关因子Atg3、Atg12及Beclin1的表达显著减低,伴Caspase3活性降低。Caspase3是细胞凋亡的终末执行者,其活性降低表明西格列汀治疗拮抗了β细胞凋亡。Beclin1,哺乳动物体内发现的自噬相关基因,主要参与自噬泡膜与溶酶体膜融合的调节[9]。研究发现,过表达自噬基因 Beclin1,可显著增加细胞凋亡率[10],说明Beclin1是诱发细胞凋亡的重要因子。目前认为,Beclin1主要通过与Bcl-2蛋白作用调控凋亡[11]。Atg12,泛素样蛋白家族成员,主要参与自噬体膜延伸的调节[12],亦通过不同的机制调节细胞凋亡。在Atg12结构中,含有一个BH3样结构域,能与Bcl-2家族成员如Bcl-2、Mcl-1结合,拮抗其抗凋亡的作用,从而引发细胞凋亡[13]。Atg3,LC3泛素样系统中的一员,可催化可溶性LC3-I转变为脂溶性LC3-Ⅱ,调节自噬泡膜融合与延伸[14]。Wang等[15]研究发现,人 SKM-1 细胞中过表达Atg3,细胞凋亡率显著增加。Atg3还可通过Atg12可与共价结合形成复合物,经线粒体途径,引发细胞凋亡[16]。已有研究表明,抑制Beclin1等自噬相关因子的表达,可拮抗胰岛 β细胞凋亡[17,18]。由此推测,在本研究中,西格列汀对 Atg3、Atg12及Beclin1的下调作用,与其抑制胰岛β细胞凋亡的作用有关。
综上所述,西格列汀治疗改善了2型糖尿病小鼠的血糖调控,抑制了β细胞凋亡,增强了β细胞合成及分泌胰岛素的能力;其对胰岛β细胞自噬相关因子Atg3、Atg12及Beclin1的下调作用,可能是其改善胰岛β细胞功能的新机制。本课题从全新的角度探究了西格列汀保护2型糖尿病胰岛β细胞的机制,为该药物的临床应用提供了新的依据。
图8 p53基因PCR扩增电泳图(部分)及测序峰图

图9 两组胰腺组织胰岛素与胰高血糖素免疫荧光染色(×200)

图10 两组胰岛β细胞Beclin1蛋白免疫组化染色(×400)
[1]Ohmura H,Mita T,Taneda Y,et al.Efficacy and safety of sitagliptin in Japanese patients with type 2 diabetes[J].J Clin Med Res,2015,7(4):211-219.
[2]Otsuka Y,Yamaguchi S,Furukawa A,et al.Addition of sitagliptin or metformin to insulin monotherapy improves blood glucose control via different effects on insulin and glucagon secretion in hyperglycemic Japanese patients with type 2 diabetes[J].Endocr J,2015,62(2):133-143.
[3]Zhang Y,Chen Y,Cheng J,et al.DPP Ⅳ inhibitor suppresses STZ-induced islets injury dependent on activation of the IGFR/Akt/mTOR signaling pathways by GLP-1 in monkeys[J].Biochem Biophys Res Commun,2015,456(1):139-144.
[4]Mega C,Vala H,Rodrigues-Santos P,et al.Sitagliptin prevents aggravation of endocrine and exocrine pancreatic damage in the Zucker Diabetic Fatty rat-focus on amelioration of metabolic profile and tissue cytoprotective properties[J].Diabetol Metab Syndr,2014,6(1):42.
[5]Zhao Y,Yang L,Xiang Y,et al.Dipeptidyl peptidase 4 inhibitor sitagliptin maintains β-cell function in patients with recent-onset latent autoimmune diabetes in adults:one year prospective study[J].J Clin Endocrinol Metab,2014,99(5):E876-880.
[6]Masini M,Bugliani M,Lupi R,et al.Autophagy in human type 2diabetes pancreatic beta cells[J].Diabetologia,2009,52(6):1083-1086.
[7]Takeda Y,Fujita Y,Honjo J,et al.Reduction of both beta cell death and alpha cell proliferation by dipeptidyl peptidase-4 inhibition in a streptozotocin-induced model of diabetes in mice[J].Diabetologia,2012,55(2):404-412.
[8]Feng Y,He D,Yao Z,et al.The machinery of macroautophagy[J].Cell Res,2014,24(1):24-41.
[9]Wirawan E,Lippens S,Vanden Berghe T,et al.Beclin1:a role in membrane dynamics and beyond[J].Autophagy,2012,8(1):6-17.
[10]Wang W,Fan H,Zhou Y,et al.Knockdown of autophagy-related gene BECLIN1 promotes cell growth and inhibits apoptosis in the A549 human lung cancer cell line[J].Mol Med Rep,2013,7(5):1501-1505.
[11]Decuypere JP,Parys JB,Bultynck G.Regulation of the autophagic bcl-2/beclin 1 interaction[J].Cells,2012,1(3):284-312.
[12]Haller M,Hock AK,Giampazolias E,et al.Ubiquitination and proteasomal degradation of ATG12 regulates its proapoptotic activity[J].Autophagy,2014,10(12):2269-2278.
[13]Rubinstein AD,Eisenstein M,Ber Y,et al.The autophagy protein Atg12 associates with antiapoptotic Bcl-2 family members to promote mitochondrial apoptosis[J].Mol Cell,2011,44(5):698-709.
[14]Metlagel Z,Otomo C,Ohashi K,et al.Structural insights into E2-E3 interaction for LC3 lipidation[J].Autophagy,2014,10(3):522-523.
[15]Wang L,Song J,Zhang J,et al.Lentiviral vector-mediate ATG3 overexpression inhibits growth and promotes apoptosis of human SKM-1 cells[J].Mol Biol Rep,2014,41(4):2093-2099.
[16]Radoshevich L,Murrow L,Chen N,et al.ATG12 conjugation to ATG3 regulates mitochondrial homeostasis and cell death[J].Cell,2010,142(4):590-600.
[17]Tanemura M,Ohmura Y,Deguchi T,et al.Rapamycin causes upregulation of autophagy and impairs islets function both in vitro and in vivo[J].Am J Transplant,2012,12(1):102-114.
[18]曾建,陈晓军.沙格列汀对改善2型糖尿病患者血压的效果及其作用机制[J].武警医学,2015,26(1):44-46.

