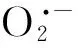连作苹果土壤酚酸对平邑甜茶幼苗的影响
王艳芳, 潘凤兵, 展 星, 王功帅, 张国栋, 胡艳丽, 陈学森,毛志泉,*
1 山东农业大学园艺科学与工程学院,作物生物学国家重点实验室, 泰安 271018 2 山东农业大学化学与材料科学学院, 泰安 271018
连作苹果土壤酚酸对平邑甜茶幼苗的影响
王艳芳1,2, 潘凤兵1, 展 星1, 王功帅1, 张国栋1, 胡艳丽1, 陈学森1,毛志泉1,*
1 山东农业大学园艺科学与工程学院,作物生物学国家重点实验室, 泰安 271018 2 山东农业大学化学与材料科学学院, 泰安 271018
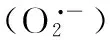
连作; 酚酸类物质; 平邑甜茶; 线粒体; 抗氧化酶
我国传统优势栽培地区的苹果园主要是20世纪80年代和90年代初建立的,现在大部分进入衰老期,其中20—30a园龄的占20%以上,每年有2—3.13万hm2的老果园面临重建[1]。而果园重建常常面临一个严重的问题——苹果连作障碍(再植病、忌地现象)。连作障碍使树体生长势变弱、病虫害加剧、产量降低、果实品质下降,严重制约了我国苹果产业的可持续发展。因此,深入的探讨苹果连作障碍的发生机理,研究建立有效苹果连作障碍防控技术体系,对苹果产业的可持续发展具有重要意义。
大量研究表明,根系分泌以及前茬残根腐解产生的酚酸类物质是引起连作障碍的重要原因之一[2-4]。这些酚酸类物质主要包括根皮苷、苯甲酸、间苯三酚、根皮素、阿魏酸、对羟基苯甲酸、香草酸、丁香酸、咖啡酸等[5]。孙海兵等[6]研究环渤海湾地区连作苹果园土壤中酚酸类物质的含量变化时,发现根皮苷、焦性没食子酸和绿原酸可能是引起连作障碍的关键物质。覃逸明等[7]用凤丹根分泌的阿魏酸、肉桂酸、香草醛、香豆素以及丹皮酚对丹凤幼苗的进行盆栽试验,发现酚酸类物质影响根系酶活性和叶绿素合成,进而认为凤丹连作障碍可能主要与自身分泌到土壤中的酚酸类物质的自毒作用有关。
就现有的研究成果来看,关于酚酸类物质毒害作用的研究,大多是外源施入预先设定的酚酸类物质,按照人为的浓度梯度进行试验[8-9],或者用根际土壤浸提液、植株不同部分浸提液、根系分泌物进行综合伤害检测[10-11]。而在实际生产中,自毒物质的类型和含量在不同的土壤类型、不同植物品种或品系间存在很大的差异[12-13],因此在研究降解酚酸类物质来缓解连作障碍时,应针对土壤中实际存在的有害物采取措施,而不能“一刀切”。至今,关于连作果园土壤中实际浓度的酚酸类物质对作物的影响鲜有报道。因此,本研究在砂培条件下,用连作土壤中有代表性的5种酚酸类物质,以其田间实测的浓度处理平邑甜茶幼苗,通过研究其对平邑甜茶幼苗根系线粒体功能以及抗氧化性酶活性、膜透性和过氧化氢、超氧阴离子自由基含量等指标的影响,探讨连作土壤中实际浓度的酚酸类物质对平邑甜茶幼苗的影响,以期为研究减轻苹果连作障碍技术提供理论依据。
1 材料与方法
1.1 试验材料
试验于2013年在山东农业大学园艺科学与工程学院根系实验室进行。供试材料为苹果常用砧木-平邑甜茶(MalushupehensisRehd.)。供试分析纯试剂根皮苷、间苯三酚、根皮素、对羟基苯甲酸、肉桂酸购自美国Sigma公司。培养基质为河砂,砂石用水洗涤干净,备用。
1.2 试验设计
于山东省泰安市瓷窑镇大磨庄村选取1333m220年生红富士苹果园,砧木为八棱海棠(M.micromalus),进行更新重建。土壤类型为褐土,土壤硝态氮含量为11.39 mg/kg,铵态氮含量为 2.32 mg/kg,速效钾含量为70.0 mg/kg,速效磷含量为25.4 mg/kg,有机质含量为5.1 g/kg。幼树为富士-平邑甜茶二年生嫁接苗,按照原树穴、原树株间、原树行间的布局进行栽植。连作第2年,在新建苹果园中,从上述3个位置,采用多点取样法,取0—30 cm土层土壤混合,室温风干,过12目筛,用加速溶剂萃取法提取土壤中酚酸,然后进高效液相色谱仪分析酚酸类物质的含量[5]。所测5种酚酸类物质的含量如下:根皮苷,6.0 mg/kg、间苯三酚,1.3 mg/kg、根皮素,0.05 mg/kg、对羟基苯甲酸,0.3 mg/kg、肉桂酸,0.06 mg/kg。根据所测酚酸类物质含量,用小于0.2% (体积分数)乙醇溶液配制相应浓度的根皮苷、间苯三酚、根皮素、对羟基苯甲酸、肉桂酸溶液,备用。
将平邑甜茶种子层积、催芽后播种于营养钵(高10 cm、直径10 cm)中,将营养钵放在不漏水的托盘内,每钵6粒,用50 mL Hoagland营养液每3 d浇灌1次,待幼苗长至3片真叶,选长势基本一致保留3株,保证各处理条件一致。待幼苗长至10—11片功能叶后,对其进行处理,试验处理见表1,每处理12钵。将5种酚酸按所测的土壤中的含量分别施入营养钵中,5 d处理1次,每次20 mL,若有流出则将托盘中的流出液倒回营养钵,如此反复操作,使处理营养钵中的酚酸浓度与连作果园土壤中的浓度相一致,共处理3次。第1次处理15 d后,取样进行各项生理指标的检测。

表1 试验处理
1.3 相关指标的测定
(1)根系指标的测定
将处理后幼苗取出,用水小心洗净根系,将根系平铺于透明硬塑料板上,在水中将根系展开,用专业版WinRHIZO(2007年版)根系分析系统获取根系扫描图形,记录总根长、平均根直径[14]。
根冠比=地下干物质量/地上干物质量
(2)线粒体的提取及指标测定
线粒体用差速离心法[15]提取,放在冰上保存备用。
将线粒体提取液充分摇匀,参照Marchi等的方法[16],于540 nm处测定吸光度变化,检测线粒体膜通透性转换孔(MPTP)。以单位质量根系线粒体引起的每分钟吸光度变化表示MPTP开放程度。
将线粒体提取液颠倒摇匀后,按照Braidot等的方法[17]用RF-5301PC荧光分光光度计测定线粒体膜电位,激发波长505 nm,发射波长573 nm,狭缝宽度5 nm。以单位质量根系线粒体引起的荧光强度表示线粒体膜电位的大小。
将线粒体提取液轻轻颠倒摇匀后,用UV-2600紫外可见扫描分光光度计(岛津,日本)测定550 nm和630 nm处的吸收值。以单位质量根系线粒体的2种波长的吸收值之比来计算细胞色素Cyt c/a[18]。
(3)抗氧化酶活性测定测定
氮蓝四唑(NBT)光还原法测定超氧化物歧化酶(SOD)活性[19];按Omran[20]的方法测定过氧化物酶(POD)的活性;用Kar等[21]的方法测定过氧化氢酶(CAT)的活性。
1.4 统计分析
采用Excel 2003完成对试验数据的计算和制图,通过SPSS 19.0中ANONA进行方差分析,Duncan′s 新复极差法进行差异显著性检测。
2 结果与分析
2.1 5种酚酸类物质对平邑甜茶幼苗及根系生长的影响
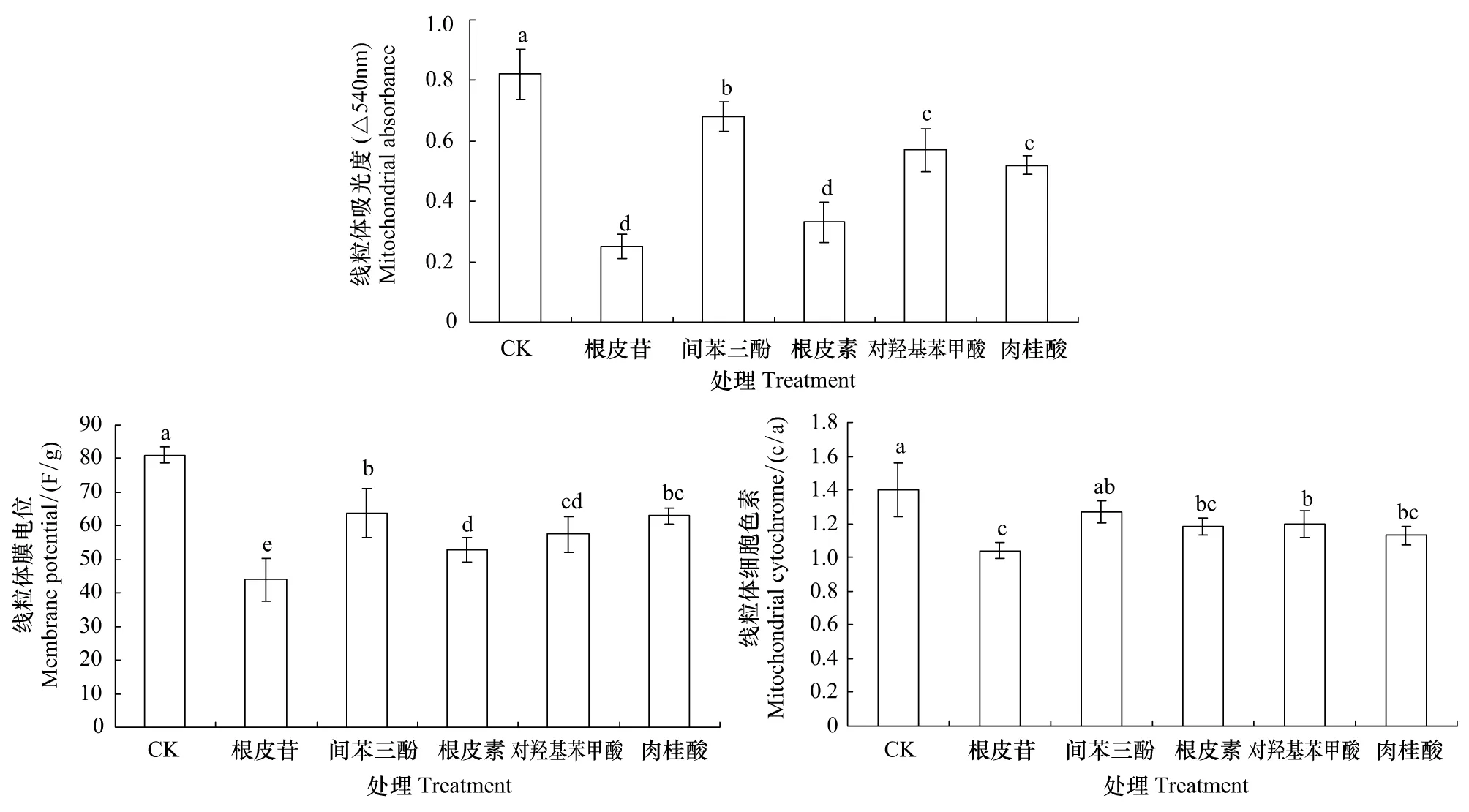
由表2可知,土壤实测浓度的酚酸类物质均降低了平邑甜茶幼苗地上部干重,除间苯三酚外,其余酚酸类物质使地下部干重显著降低,其中以6 mg/kg根皮苷处理对植株重量影响最大,地上、地下部降低幅度分别达32.9%和56.5%。根冠比的降低说明,酚酸类物质对根系的影响程度大于地上部,其中根皮苷处理根冠比下降幅度最大,降幅为34.4%。
5种酚酸类物质均使得总根长以及平均根直径呈明显的下降趋势(表2),以根皮苷处理抑制力最强。总根长数值大小依次是根皮苷<根皮素<肉桂酸<对羟基苯甲酸<间苯三酚 表2 不同酚酸类物质处理对平邑甜茶幼苗及根系生长的影响 线粒体通透性转化孔(MPTP)开放,引起线粒体内膜对甘露醇和蔗糖高通透性,因此造成线粒体肿胀,即表现为线粒体悬浮液吸光度值降低,因而可通过测定吸光度值得变化间接反映MPTP的开放程度。不同酚酸类物质处理均使得线粒体吸光度值降低(图1),这表明酚酸类物质会诱导MPTP开放程度增加,以根皮苷处理使得MPTP开放程度最大,间苯三酚处理开放程度最小。 图1 不同酚酸类物质处理对平邑甜茶幼苗根系线粒体MPTP、膜电位和cyt c/a的影响Fig.1 Effects of phenolic acids on mitochondrial MPTP, membrane potential, and cyt c/a in root of Malus hupehensis Rehd 根皮苷 phloridzin; 间苯三酚 phloroglucinol;根皮素 phloretin; 对羟基苯甲酸 p-hydroxybenzoic acid; 肉桂酸 cinnamic acid; 图中不同小写字母表示不同处理间的差异(P<0.05) 线粒体膜电位是指生物膜两侧离子浓度不同所产生的跨膜电位差,反映了线粒体功能的完整性,是评价线粒体功能的敏感指标。线粒体的膜电位与MPTP开放程度有关,MPTP高通透性开放,则引起膜电位的降低[24]。根皮苷、间苯三酚、根皮素、对羟基苯甲酸和肉桂酸处理后,幼苗根系线粒体膜电位分别为对照的54.2%、78.7%、65.1%、70.8%和77.6%,显著低于对照(图1)。 与对照相比,酚酸处理平邑甜茶幼苗,使得根系线粒体细胞色素Cyt c/a显著降低(图1),以根皮苷处理降低程度最大,为对照的74.3%,间苯三酚处理影响最小。这说明酚酸类物质破坏了线粒体膜的完整性,在线粒体不断肿胀的过程中,膜电位降低,细胞色素c不断流失。 由图2可以看出,5种酚酸类物质处理平邑甜茶幼苗后,均显著降低了根系抗氧化酶活性。各种酚酸处理后,根系SOD活性由小到大的顺序依次是:根皮苷<根皮素<肉桂酸、对羟基苯甲酸<间苯三酚<对照,POD、CAT活性变化与SOD变化趋势一致。根皮苷处理后,根系SOD、POD和CAT活性分别为对照的16.4%、29.6%和27.5%。 图2 不同酚酸类物质处理对平邑甜茶幼苗根系SOD、POD和CAT的影响Fig.2 Effects of phenolic acids on SOD, POD, and CAT activities in root of Malus hupehensis Rehd. seedling 由图3可以看出,5种酚酸类物质均可导致平邑甜茶幼苗根系膜透性增大,具体表现为MDA的含量显著升高,根皮苷、间苯三酚、根皮素、对羟基苯甲酸和肉桂酸处理幼苗根系MDA含量分别是对照的6.3、1.3、5.5、1.7和3.3倍。 图3 不同酚酸类物质处理对平邑甜茶幼苗根系MDA、H2O2和的影响Fig.d. seedling 苹果连作障碍是在全世界主要苹果产区普遍存在的问题。早期对苹果连作问题进行了大量的研究,发现苹果连作障碍的重要原因之一是土壤中存在有害酚酸类物质[25]。本实验室经过大量试验摸索,发现一种简便、快速和高效提取、测定连作苹果园土壤中酚酸含量的新方法[5],这为后续试验奠定了基础。 土壤中酚酸类物质的积累是作物根系受到的一种逆境胁迫[10,26],酚酸类自毒物质不仅抑制作物地下部的生长,而且阻碍地上部的发育[11,26-27]。张江红等[27]用浓度为1 mmol/L的根皮苷处理平邑甜茶幼苗,发现幼苗的根系长度和表面积大幅下降,根尖的超微结构受到破坏,根系的吸收能力严重受到影响。本试验结果也发现,连作果园中实测浓度的5种酚酸类均抑制了平邑甜茶幼苗植株的生长,使幼苗根系干物质量明显降低,降低幅度在23.9%—56.5%,而地上部干物质的量减小幅度在6.3%—34.4%。其中根皮苷、根皮素、对羟基苯甲酸以及肉桂酸处理根冠比下降幅度明显,证明这些酚酸类化合物对根系的影响程度大于地上部分。在酚酸类物质胁迫下,幼苗总根长和平均根直径均有所下降,这些指标的下降导致根系对养分吸收能力的降低,最终使得地下部干物质积累量的减少。 不论是由线粒体数据,还是植株的生物量数据,都可以看出,5种连作土壤实测浓度的酚酸类物质对平邑甜茶幼苗的伤害程度不同,其中以根皮苷毒害作用最大。但关于酚酸类物质在连作园起毒害作用的临界值,以及各种主要酚酸类物质的复合效应有待深入研究。 [1] 陈学森, 韩明玉, 苏桂林, 刘凤之, 过国南, 姜远茂, 毛志泉, 彭福田, 束怀瑞. 当今世界苹果产业发展趋势及我国苹果产业优质高效发展意见. 果树学报, 2010, 27(4): 598-604. [2] 张江红. 酚类物质对苹果的化感作用及重茬障碍影响机理的研究 [D]. 泰安: 山东农业大学, 2005. [3] 白茹. 苹果连作障碍中自毒作用的研究 [D]. 咸阳: 西北农林科技大学, 2009. [4] Bubna G A, Lima R B, Zanardo D Y L, Dos Santos W D, Ferrarese M D L L, Ferrarese-Filho O. Exogenous caffeic acid inhibits the growth and enhances the lignification of the roots of soybean (Glycinemax). Journal of Plant Physiology, 2011, 168(14-15): 1627-1633. [5] 尹承苗, 王功帅, 李园园, 车金水, 沈向, 陈学森, 毛志泉, 吴树敬. 一种分析土壤中酚酸类物质含量的新方法—以连作苹果园土壤为试材. 中国农业科学, 2013, 46(21): 4612-4619. [6] 孙海兵, 毛志泉, 朱树华. 环渤海湾地区连作苹果园土壤中酚酸类物质变化. 生态学报, 2011, 31(1): 90-97. [7] 覃逸明, 聂刘旺, 黄雨清, 王千, 刘欣, 周科. 凤丹(PaeoniaostiiT.)自毒物质的检测及其作用机制. 生态学报, 2009, 29(3): 1153-1161. [8] Bai R, Ma F W, Liang D, Zhao X. Phthalic acid induces oxidative stress and alters the activity of some antioxidant enzymes in roots ofMalusprunifolia. Journal of Chemical Ecology, 2009, 35(4): 488-494. [9] 王青青, 胡艳丽, 周慧, 展星, 毛志泉, 朱树华. 根皮苷对平邑甜茶根系TCA循环酶的影响. 中国农业科学, 2012, 45(15): 3108-3114. [10] Han C M, Li C L, Ye S P, Wang H, Pan K W, Wu N, Wang Y J, Li W, Zhang L. Autotoxic effects of aqueous extracts of ginger on growth of ginger seedings and on antioxidant enzymes, membrane permeability and lipid peroxidation in leaves. Allelopathy Journal, 2012, 30(2): 259-270. [11] 刘苹, 赵海军, 仲子文, 孙明, 庞亚群, 马征, 万书波. 三种根系分泌脂肪酸对花生生长和土壤酶活性的影响. 生态学报, 2013, 33(11): 3332-3339. [12] Zagoskina N V, Olenichenk N A, Yun′vei C, Zhivukhina E A. Formation of phenolic compounds in various cultivars of wheat (TriticumaestivumL.). Applied Biochemistry and Microbiology, 2005, 41(1): 99-102. [13] Inderjit, Wardle D A, Karban R, Callaway R M. The ecosystem and evolutionary contexts of allelopathy. Trends in Ecology & Evolution, 2011, 26(12): 655-662. [14] 高安妮, 田长平, 胡艳丽, 陈强, 毛志泉. 外源NO对连作条件下平邑甜茶幼苗生理特性的影响. 中国农业科学, 2011, 44(10): 2184-2192. [15] 姚婷婷, 朱丽琴, 杨双, 周杰, 朱树华. 一氧化氮对采后李果实线粒体膜氧化损伤的影响. 中国农业科学, 2010, 43(13): 2767-2774. [16] Marchi U D, Campello S, Szabò I, Tombola F, Martinou J C, Zoratti M. Bax does not directly participate in the Ca2+-induced permeability transition of isolated mitochondria. Journal of Biological Chemistry, 2004, 279: 37415-37422. [17] Braidot E, Petrussa E, Macri F, Vianello A. Plant mitochondrial electrical potential monitored by fluorescence quenching of rhodamine 123. Biologia Plantarum, 1998, 41(2): 193-201. [18] Tonshin A A, Saprunova V B, Solodovnikova I M, Bakeeva L E, Yaguzhinsky L S. Functional activity and ultrastructure of mitochondria isolated from myocardial apoptotic tissue. Biochemistry (Moscow), 2003, 68(8): 875-881. [19] 陈贻竹, 帕特森B. 低温对植物叶片中超氧物歧化酶, 过氧化氢酶和过氧化氢水平的影响. 植物生理与分子生物学学报, 1988, 14(4): 323-328. [20] Omran R G. Peroxide levels and the activities of catalase, peroxidase, and indoleacetic acid oxidase during and after chilling cucumber seedlings. Plant Physiology, 1980, 65(2): 407-408. [21] Kar M, Mishra D. Catalase, peroxidase, and polyphenoloxidase activities during rice leaf senescence. Plant Physiology, 1976, 57(2): 315-319. [22] 赵世杰, 史国安, 董新纯. 植物生理学实验指导. 北京: 中国农业科学技术出版社, 2002: 136-136, 142-143. [23] 王爱国, 罗广华. 植物的超氧物自由基与羟胺反应的定量关系. 植物生理学通讯, 1990, (6): 55-57. [24] 张召, 梁元存, 王利, 杨洪强, 李龙, 孙崟崟, 谢永波. 钙对酸化处理平邑甜茶根系抗氧化酶活性及线粒体功能的影响. 林业科学, 2012, 48(8): 87-93. [25] Börner H. Liberation of organic substances from higher plants and their role in the soil sickness problem. The Botanical Review, 1960, 26(3): 393-424. [26] 张兆波, 毛志泉, 朱树华. 6 种酚酸类物质对平邑甜茶幼苗根系线粒体及抗氧化酶活性的影响. 中国农业科学, 2011, 44(15): 3177-3184. [27] 张江红, 毛志泉, 王丽琴, 束怀瑞. 根皮苷对平邑甜茶幼苗生理特性的影响. 中国农业科学, 2007, 40(3): 492-498. [28] Blokhina O, Virolainen E, Fagerstedt K V. Antioxidants, oxidative damage and oxygen deprivation stress: a review. Annals of Botany, 2003, 91(2): 179-194. [29] Chen L X, Wu F Z, Ma F M. Effects of exogenous cinnamic acids on the growth and physiological characteristics of cucumber seedlings. Agricultural Sciences in China, 2005, 4(10): 747-751. [30] Wu F Z, Ma F M. Effect of exogenous cinnamic acid on structure and function of plasmalemma in cucumber seedlings. Allelopathy Journal, 2006, 18(2): 287-298. [31] Hiradate S, Morita S, Furubayashi A, Fujii Y, Harada J. Plant growth inhibition byCis-cinnamoyl glucosides andCis-cinnamic acid. Journal of Chemical Ecology, 2005, 31(3): 591-601. [32] Mittler R. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, 2002, 7(9): 405-410. [33] Lee M G, Lee K T, Chi S G, Park J H. Costunolide induces apoptosis by ROS-mediated mitochondrial permeability transition and cytochrome C release. Biological and Pharmaceutical Bulletin, 2001, 24: 303-306. Effects of five kinds of phenolic acid on the function of mitochondria and antioxidant systems in roots ofMalushupehensisRehd. seedlings WANG Yanfang1,2, PAN Fengbing1, ZHAN Xing1, WANG Gongshuai1, ZHANG Guodong1, HU Yanli1, CHEN Xuesen1, MAO Zhiquan1,* 1StateKeyLaboratoryofCropBiology/CollegeofHorticulturalScienceandEngineering,ShandongAgriculturalUniversity,Tai′an271018,China2CollegeofChemistryandMaterialScience,ShandongAgriculturalUniversity,Tai′an271018,China replant; phenolic acids;MalushupehensisRehd.; mitochondria; antioxidant systems 现代农业产业技术体系建设专项资金(CARS-28); 山东省农业重大应用技术创新课题; 教育部长江学者和创新团队发展计划(IRT1155) 2014-02-18; < class="emphasis_bold">网络出版日期: 日期:2014-12-04 10.5846/stxb201402180284 *通讯作者Corresponding author.E-mail: mzhiquan@sdau.edu.cn 王艳芳, 潘凤兵, 展星, 王功帅, 张国栋, 胡艳丽, 陈学森,毛志泉.连作苹果土壤酚酸对平邑甜茶幼苗的影响.生态学报,2015,35(19):6566-6573. Wang Y F, Pan F B, Zhan X, Wang G S, Zhang G D, Hu Y L, Chen X S, Mao Z Q.Effects of five kinds of phenolic acid on the function of mitochondria and antioxidant systems in roots ofMalushupehensisRehd. seedlings.Acta Ecologica Sinica,2015,35(19):6566-6573.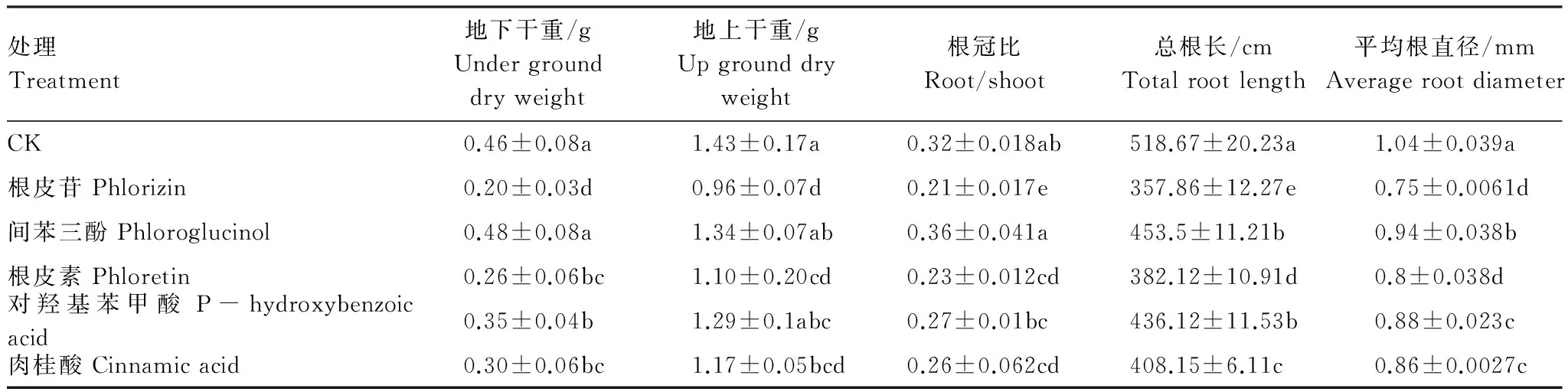
2.2 5种酚酸类物质对平邑甜茶幼苗根系线粒体功能的影响
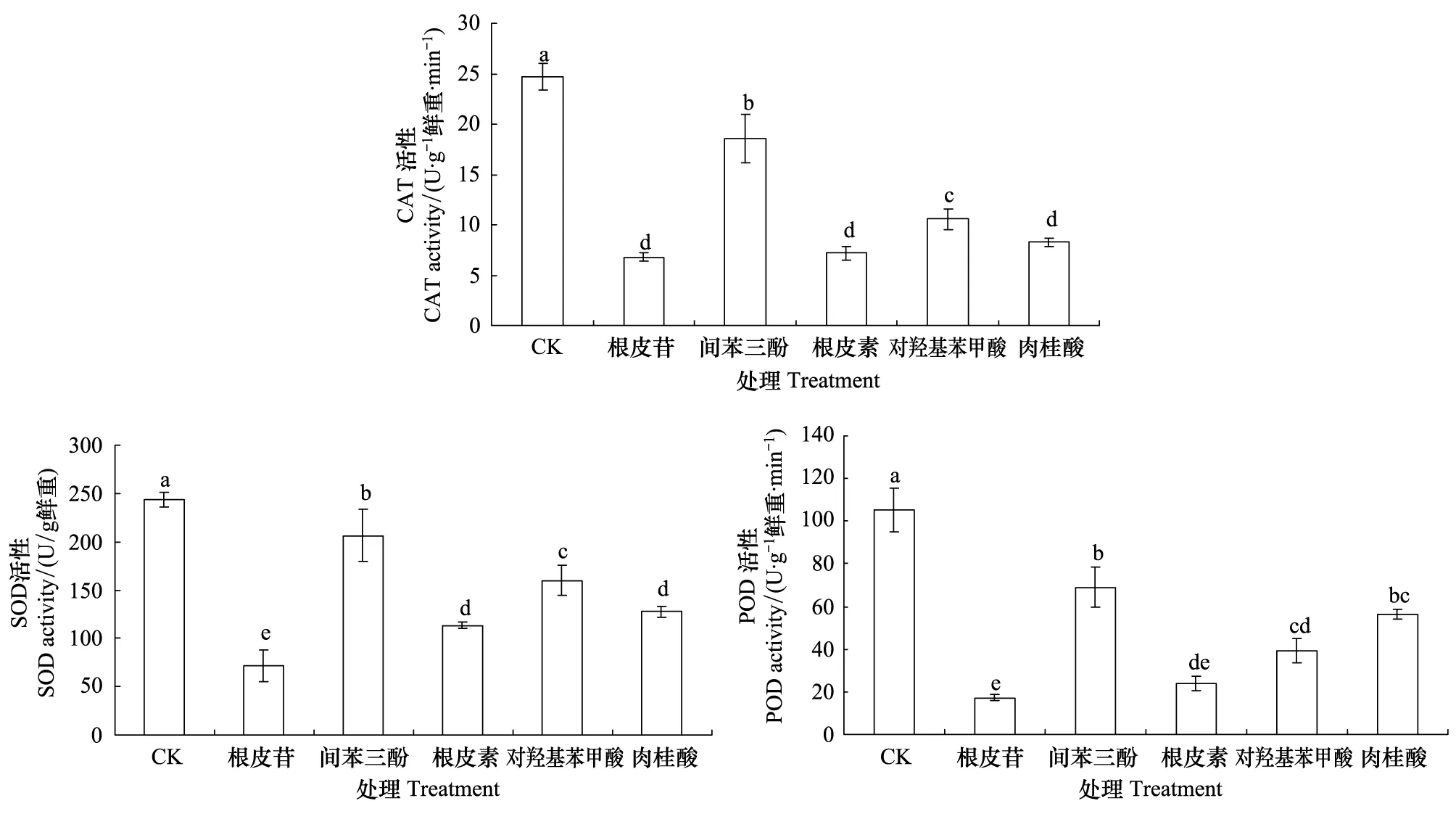
2.3 5种酚酸类物质对平邑甜茶幼苗根系抗氧化性酶活性的影响
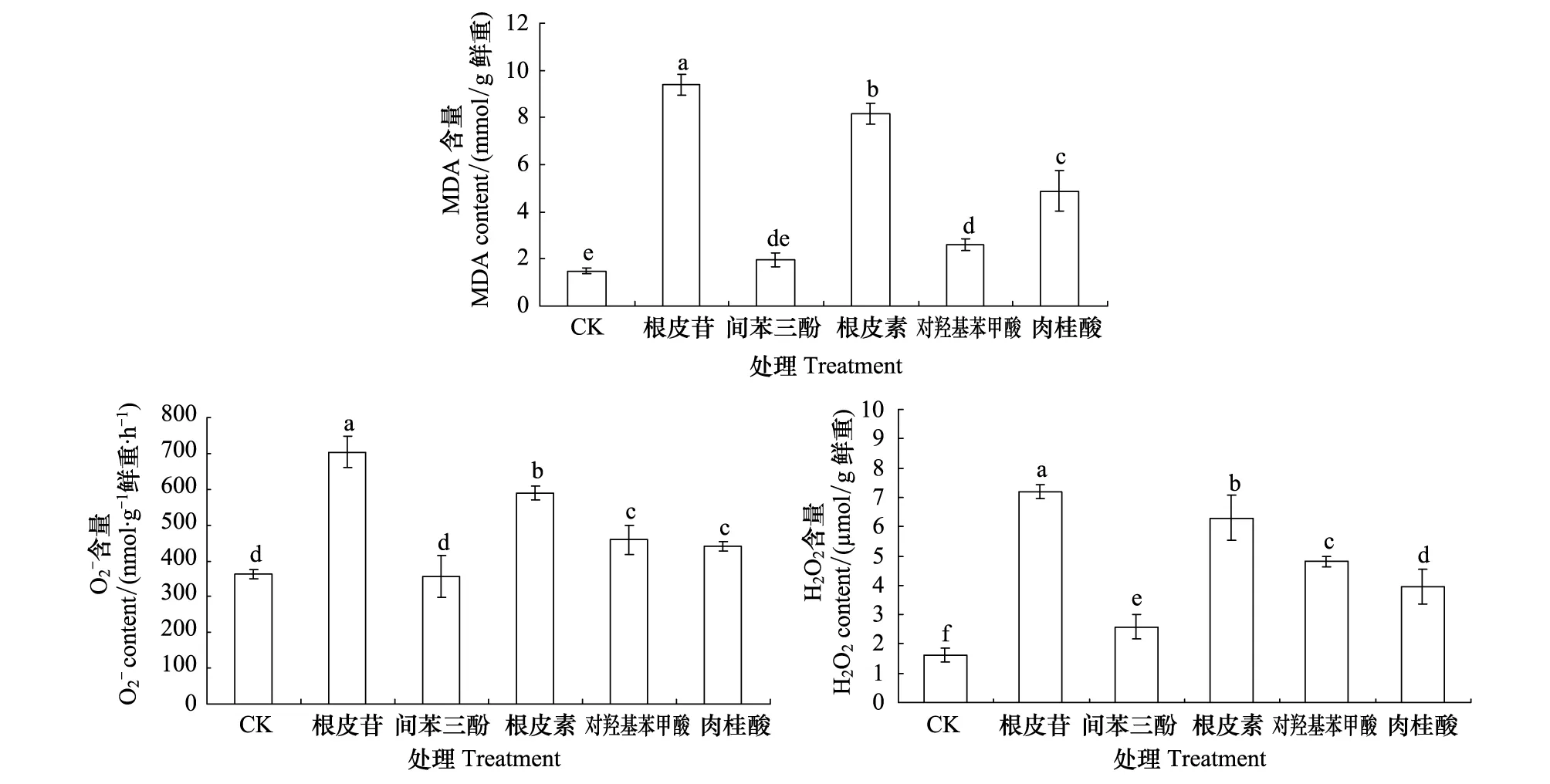
2.4 5种酚酸类物质对平邑甜茶幼苗根系膜透性和含量的影响
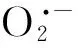
3 讨论