不同盐胁迫对柳枝稷生物量、品质和光合生理的影响
赵春桥, 李继伟, 范希峰, 侯新村, 武菊英, 胡跃高, 刘吉利
1 中国农业大学农学与生物技术学院, 北京 100193 2 北京市农林科学院草业与环境研究发展中心, 北京 100097 3 宁夏大学新技术应用研究开发中心, 银川 750021
不同盐胁迫对柳枝稷生物量、品质和光合生理的影响
赵春桥1,2, 李继伟2, 范希峰2, 侯新村2, 武菊英2, 胡跃高1,*, 刘吉利3
1 中国农业大学农学与生物技术学院, 北京 100193 2 北京市农林科学院草业与环境研究发展中心, 北京 100097 3 宁夏大学新技术应用研究开发中心, 银川 750021
为明确不同盐胁迫对柳枝稷生物量、品质及光合生理的影响,以无盐胁迫作为对照(CK),选取0.40% NaCl、0.80% Na2SO4和0.80% NaHCO3进行了土柱试验。结果表明:(1)与CK相比,NaCl、Na2SO4、NaHCO3胁迫下柳枝稷地上生物量、地下生物量、总生物量、籽粒产量及根冠比均显著降低(P< 0.05),总生物量分别降低49.39%、60.52%、76.45%,NaHCO3对柳枝稷的生长抑制作用最强,NaCl最弱;(2)NaCl胁迫下柳枝稷地上生物质灰分含量显著增高14.89%,Na2SO4胁迫下硫(S)含量显著增高262.32%,纤维素含量显著降低13.71%,NaHCO3胁迫下钾(K)含量显著增高54.95%,半纤维素含量显著增高10.87%,灰分和S含量的增高不利于柳枝稷地上生物质的燃烧利用,纤维素含量的降低和半纤维素含量的增高不利于其转化利用;(3)NaCl、Na2SO4、NaHCO3胁迫下柳枝稷叶片净光合速率(Pn)分别显著降低21.89%、29.54% 和24.59%,气孔限制因素可能是其光合作用受到抑制、生物量下降的关键因素。
柳枝稷; 盐胁迫; 生物量; 品质; 光合生理; 边际土地
利用边际土地种植能源植物,是我国获取生物质原材料、发展生物质能产业的一条重要途径[1]。盐渍化土地是我国典型的边际土地类型,总面积约为1.30×107hm2,且仍不断增加[2]。在盐渍边际土地种植能源植物,既可有效缓解生物质原材料供应不足问题,又可改善盐渍地区生态环境[3]。
柳枝稷(PanicumvirgatumL.)原产于北美地区,禾本科黍属,系多年生高大丛生C4草本植物,具有抗旱、抗寒、耐盐碱、贫瘠等多种逆境胁迫的能力,适应范围广,生物质产量高,易于管理、收获[4]。20世纪80年代柳枝稷被引种到中国,适应性强,逐渐受到人们关注[5]。柳枝稷苗期耐盐性良好,具有较好的研发潜力[6]。水培条件下柳枝稷幼苗生物量下降 50% 的盐浓度为10.44 g/L[7]。以生物量为衡量指标,柳枝稷在不同土壤盐胁迫下的适宜浓度范围分别为:NaHCO3≤ 0.40%,Na2SO4≤ 0.60%,NaCl ≤ 0.20%[8]。不同土壤盐胁迫显著影响了柳枝稷植株生长与根系垂直分布[9]。盐胁迫与pH在对柳枝稷生长的影响上存在着协同或拮抗作用[10]。对柳枝稷盐胁迫下抗氧化指标的模型构建方便了人们对其耐盐性的研究[11]。由此可见,人们对盐胁迫下柳枝稷幼苗生长、发育、根系分布及耐盐评价模型等进行了研究,而不同盐胁迫对全生育期柳枝稷生物量、品质及光合生理的影响尚不清楚。
本文根据前期研究基础得出保证柳枝稷幼苗成活最大土壤NaCl、Na2SO4和NaHCO3浓度(以下简称临界致死浓度)分别为0.40%、0.80% 和0.80%[12]。基于此,为明确不同盐胁迫对全生育期柳枝稷生物量、品质及光合生理的影响,本文选取0.40% NaCl、0.80% Na2SO4、0.80% NaHCO3进行了土柱试验。
1 材料与方法
1.1 供试材料
试验于2009年在北京草业与环境研究发展中心人工防雨棚内进行,供试柳枝稷品种为Alamo,其种子于2008年11月采集于北京草业与环境研究发展中心能源草种植基地(N39°34′,E116°28′)。土壤基质为潮褐土,有机质含量为1.72%,速效N、速效P、速效K含量分别为84.00 mg/kg,46.35 mg/kg,127.00 mg/kg,土壤pH为7.42。
1.2 试验设计
本文采用配对设计[13],土柱法[14]开展试验。土壤盐分类型及质量百分比分别为:0.40% NaCl、0.80% Na2SO4和0.80% NaHCO3,无盐胁迫作为对照(CK),按质量百分比与过筛后的壤土充分混匀,试验设3重复。土柱直径40 cm、高120 cm,管壁下部设有10个小孔(孔径大小1 cm),置于120 cm深的坑内,保持土柱内土面与地面齐平。每个土柱配有直径50 cm的桶(桶内保证有10 cm深的水),以防止盐分流失。2009年6月13日将3叶期柳枝稷幼苗移栽后首次灌足安家水12.70 L,之后维持桶内水深10 cm。盐胁迫处理1个月后测定各生理指标,至2009年11月4日试验结束,取样,测定柳枝稷生物量、品质指标。
1.3 测定项目和方法
(1)生物量 取样后将柳枝稷地上与地下部分开、洗净后装入纸袋并于105℃杀青30 min,80℃烘干至恒重,称重。柳枝稷籽粒采用人工收获,去除稃和颖后80℃下烘干至恒重,称重。
(2)光合参数 采用便携式光合系统测定仪LI-6400 (LI-COR Lincoln,USA)于晴朗的9:00—11:00选取柳枝稷第3片成熟叶片进行连体测定,所测叶片完整无损并使其保持自然取向,每叶片重复记录3组数据,结果取其平均值。光合有效辐射(PAR)为1100—1200 μmol m-2s-1。光响应曲线的测定由红蓝光源(Li-6400-02B)提供不同的PAR: 2000、1800、1500、1000、800、500、200、100、50、20、0 μmol m-2s-1。CO2浓度设定为 400 μmol/mol,流速为400 μmol/s、叶室(2 cm × 3 cm)温度设定为(30 ± 1)℃。采用直角双曲线模型进行响应曲线模拟,并计算光补偿点LCP与光饱和点LSP[15]。
(3)水分利用效率(WUE) 采用LI-6400 (LI-COR Lincoln,USA)测定得到Pn和Ci后计算得到。计算公式为:WUE =Pn/Ci。
(4)生物质品质 将烘干至恒重的柳枝稷材料粉碎并过40目筛,存放于干燥器中待测。采用直接灰化法测定灰分,马弗炉测定挥发分,N、P、K采用H2SO4-H2O2消煮-比色法测定,S含量采用H2NO4-HClO4消煮-流动注射分析仪法测定,Cl含量采用莫尔法测定,Si含量采用H2SO4-H2O2消煮-重量法测定[16],热值采用XRY-1C型氧弹式热量计测定,洗涤法测定纤维素,半纤维素和木质素含量[17]。
1.4 统计分析
采用PAIRED T-TEST(SAS 8.2)进行差异显著性检验,Excel 2003和Origin7.0统计软件进行数据分析和曲线拟合。
2 结果与分析
2.1 不同盐胁迫对柳枝稷生物量的影响
NaCl、Na2SO4和NaHCO3胁迫下,柳枝稷生长受到显著抑制(表1),就生物量而言,与CK相比,柳枝稷地上生物量分别降低56.14%、61.73%、76.90%,地下生物量分别降低36.12%、58.67%、77.57%,总生物量分别降低49.39%、60.52%、76.45%,根冠比分别降低25.00%、31.25%、32.50%,籽粒产量分别降低70.95%、52.88%、33.81%。3种盐胁迫之间比较,柳枝稷生长受抑制程度显著不同,以NaHCO3抑制作用最强,而NaCl抑制作用最弱。就籽粒产量而言,NaCl胁迫下籽粒产量最低,质量百分含量为0.92%,NaHCO3胁迫下籽粒产量最高,质量百分含量为4.50%;就根冠比而言,3种盐胁迫间差异并不显著。
2.2 不同盐胁迫对柳枝稷地上生物质品质的影响
2.2.1 不同盐胁迫对柳枝稷地上生物质燃烧特性的影响
不同盐胁迫下,柳枝稷地上生物质燃烧特性的变化较小(表2)。NaCl胁迫下,柳枝稷地上生物质灰分含量显著增高14.89%。其余两种盐胁迫对柳枝稷地上生物质燃烧特性的影响均不显著。3种盐胁迫之间比较,NaCl胁迫下,柳枝稷地上生物质灰分含量显著高于其他两种盐胁迫,其他指标则无显著差异。

表1 不同盐胁迫下柳枝稷生物量
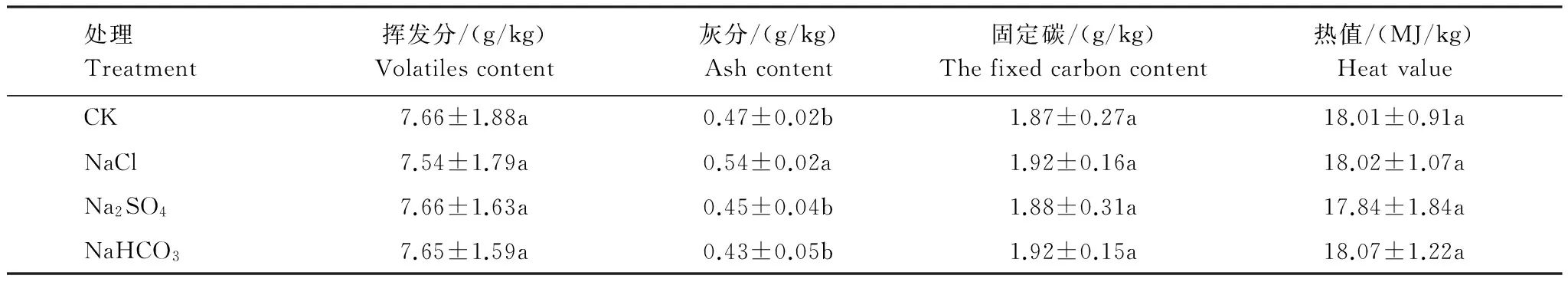
表2 不同盐胁迫下柳枝稷地上生物质燃烧特性
2.2.2 不同盐胁迫对柳枝稷地上生物质矿质元素含量的影响
不同盐胁迫下柳枝稷地上生物质矿质元素含量存在差异(表3)。与CK相比,3种盐胁迫下柳枝稷地上生物质N、P、Cl、Si含量无显著差异。Na2SO4胁迫下,S含量显著增高262.32%;NaHCO3胁迫下,K含量显著降低54.95%。3种盐胁迫间比较,Na2SO4胁迫下柳枝稷地上生物质S含量显著高于其他两种盐胁迫,NaHCO3胁迫下K含量显著低于其余两种盐胁迫。
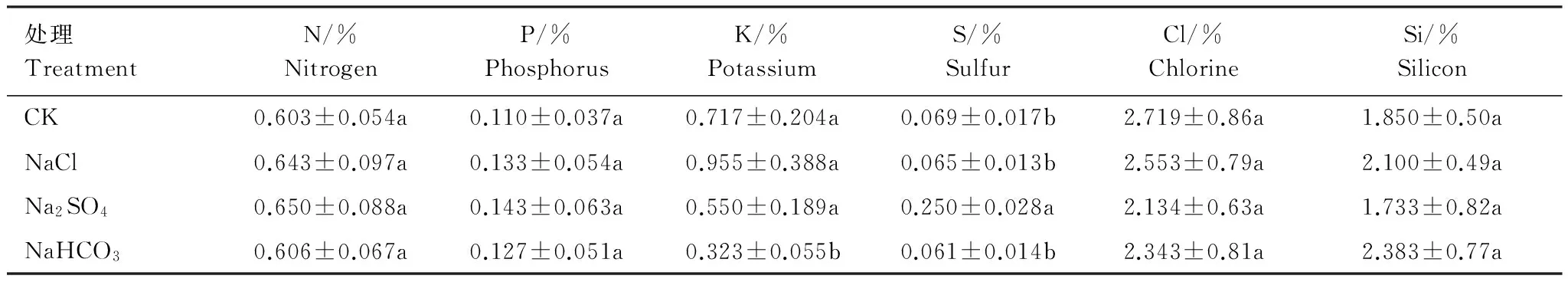
表3 不同盐胁迫下柳枝稷地上生物质矿质元素含量(干物质)
2.2.3 不同盐胁迫对柳枝稷地上生物质细胞壁组分含量的影响
与CK相比,不同盐胁迫下柳枝稷地上生物质纤维素和木质素含量都呈现出降低的趋势,半纤维素含量呈现出增高的趋势(表 4),但只有Na2SO4胁迫下纤维素含量显著降低13.71% NaHCO3胁迫下,半纤维素含量显著增高10.87%。3种盐胁迫间比较,Na2SO4胁迫下,纤维素含量显著高于其他两种盐胁迫,NaHCO3胁迫下,半纤维素含量显著高于其余两种盐胁迫。

表4 不同盐胁迫下柳枝稷地上生物质细胞壁组分含量
2.3 不同盐胁迫对柳枝稷叶片光合生理特征的影响
2.3.1 不同盐胁迫对柳枝稷光合参数的影响
不同盐胁迫对柳枝稷光合参数的影响不同(表 5),与CK相比,NaCl、Na2SO4、NaHCO3胁迫下柳枝稷Pn、Gs、Ci、Tr、Ls和SUE均显著降低,WUE变化并不显著。NaCl和Na2SO4胁迫下CUE 显著增高。3种盐胁迫间比较,Na2SO4胁迫下WUE显著高于NaCl胁迫,其余指标则无显著差异。
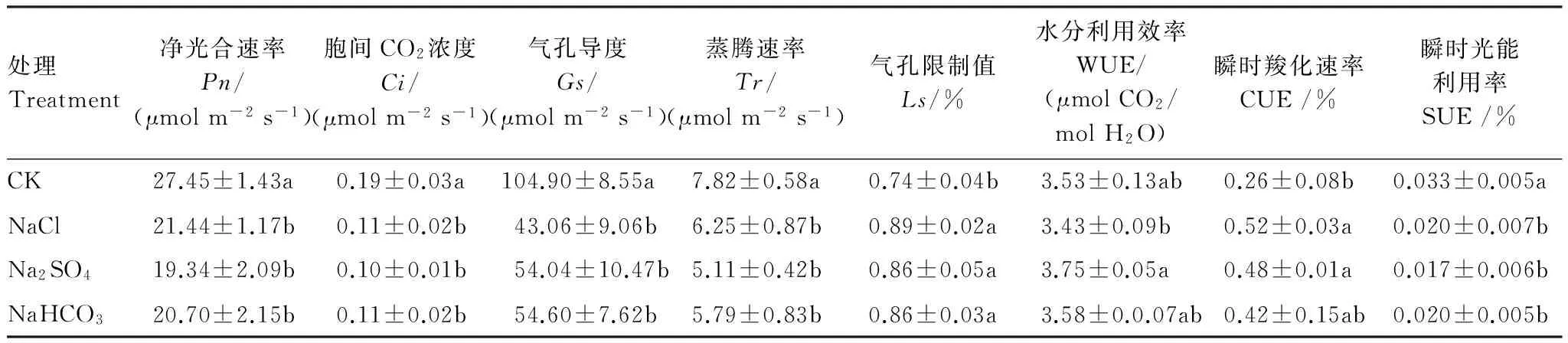
表5 不同盐胁迫下柳枝稷光合参数
Pn: net photosynthetic rate,Ci: intercellular carbon dioxide concentration,Gs: stomatal conductance,Tr: transpiration rate,Ls: limiting value of stomata, WUE: water use efficiency, CUE: Instantaneous carboxylation rate, SUE: instantaneous light energy utilization efficiency
2.3.2 不同盐胁迫对柳枝稷光合-光强响应曲线特征参数的影响
不同盐胁迫下,柳枝稷的Pn、Ci、Tr和WUE随PAR的增高呈现出较为一致的变化趋势。均表现为较低PAR时各项指标值迅速增高然后增幅逐渐平缓。本文采用直角双曲线模型对光合-光强响应曲线进行模拟,结果显示各方程的决定系数都在0.99以上,表明该模型能较好地反应叶片光合对光强的响应过程。
与对照相比,NaCl胁迫下,柳枝稷叶片Pmax、Rd、LSP均分别显著降低14.52%、10.52%、12.59%(表 6);Na2SO4胁迫下,柳枝稷叶片AQY显著增高22.73%,Pmax、LCP和LSP分别显著降低10.00%、17.41%、30.43%;NaHCO3胁迫下柳枝稷叶片Pmax、Rd、LSP分别显著降低4.10%、6.38%、20.92%。其余指标变化不显著。3种盐胁迫之间比较,Na2SO4胁迫下AQY、Rd显著高于其余两种盐胁迫,LCP显著低于其余两种盐胁迫。
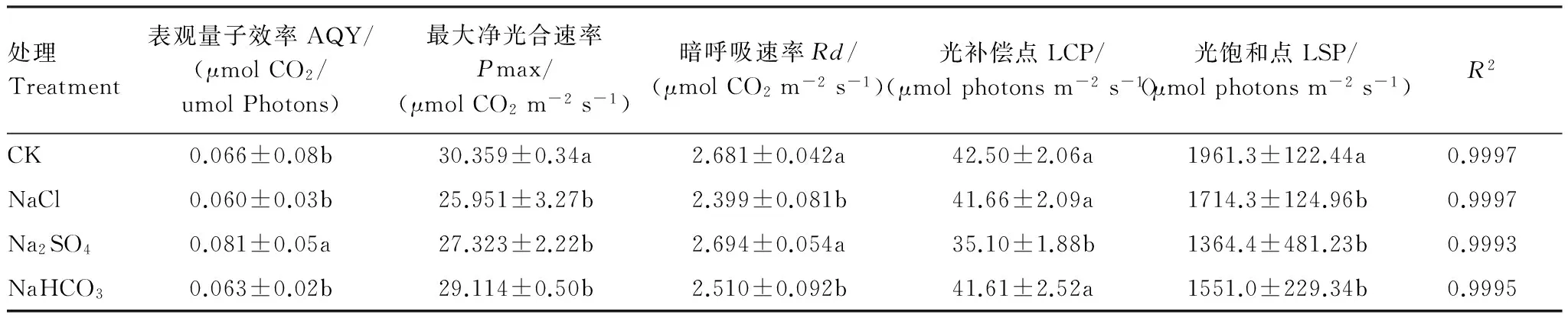
表6 直角双曲线修正模型拟合的不同盐胁迫处理柳枝稷光强响应参数
3 讨论
盐胁迫严重影响了植物的生长发育[18]。本研究表明,不同盐胁迫显著降低了柳枝稷地上生物量、地下生物量、总生物量、籽粒产量和根冠比,这与前人的研究结果相似[19]。不同盐胁迫对柳枝稷生长的抑制作用显著不同,以NaHCO3胁迫抑制作用最强。有研究表明盐分与pH在对柳枝稷的影响方面存在着协同与拮抗关系[10]。本研究表明,NaHCO3较其他两种盐对柳枝稷生长的抑制作用最强,这可能是由于NaHCO3与pH共同抑制了柳枝稷的生长。有报道表明,有些植物可通过生物量分配模式的调整来适应盐胁迫环境[20-21]。不同盐胁迫下,柳枝稷植株营养器官与生殖器官生物量的分配体现出显著差异,这可能是柳枝稷适应盐胁迫环境的一种策略。
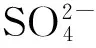
盐胁迫下,引起植物叶片光合效率降低的因素主要有两种,一种是气孔限制因素,表现为Ls显著增高,Gs下降,CO2进入叶片受阻,Ci降低,导致Pn降低[27]。另一种是非气孔限制因素,盐胁迫导致光合机构受损,电子传递速率下降,Pn、Tr、Gs显著降低,Ci升高,从而影响同化力的形成[28]。本研究表明,不同盐胁迫下,柳枝稷叶片蒸腾速率显著降低,气孔限制值显著增高,CO2进入叶片受阻,SUE显著下降,从而导致Pn和Pmax显著降低。由此可见,盐胁迫造成的气孔限制可能是导致柳枝稷光合速率降低、生物量下降的关键因素。不同盐胁迫间比较,此种抑制作用并未表现出显著性差异。
4 结论
(1) 不同盐胁迫显著抑制了柳枝稷的生长,使其生物量显著降低,生物量分配显著变化。
(2) 不同盐胁迫对柳枝稷地上生物质品质影响有限,NaCl胁迫下柳枝稷地上生物质灰分含量的显著增高和Na2SO4胁迫下S含量的显著增高对其燃烧利用不利,Na2SO4胁迫下纤维素含量的显著降低和NaHCO3胁迫下半纤维素含量的显著增高对其转化利用不利。
(3) 不同盐胁迫导致的气孔限制因素可能是导致柳枝稷生物量降低的关键因素。
[1] Tang Y, Xie J S, Geng S. Marginal land-based biomass energy production in China. Journal of Integrative Plant Biology, 2010, 52(1): 112-121.
[2] 王继和, 杨自辉, 胡明贵, 刘虎俊, 纪永福. 干旱区盐渍化土地综合治理技术研究. 中国生态农业学报, 2001, 9(1): 64-66.
[3] 侯新村, 范希峰, 武菊英, 左海涛. 纤维素类能源草在京郊地区的经济效益与生态价值评价. 草业学报, 2011, 20(6): 12-17.
[4] Sanderson M, Reed R L, McLaughlin S B, Wullschleger S D, Conger B V, Parrish D J, Wolf D D, Taliaferro C, Hopkins A A, Ocumpaugh W R, Hussey M A, Read J C, Tischler C R. Switchgrass as a sustainable bioenergy crop. Bioresource Technology, 1996, 56(1): 83-93.
[5] 范希峰, 候新村, 左海涛, 武菊英, 段留生. 边际土地类型及移栽方式对柳枝稷苗期生长的影响. 草业科学, 2010, 27(1): 97-102.
[6] 范希峰, 侯新村, 朱毅, 武菊英. 盐胁迫对柳枝稷苗期生长和生理特性的影响. 应用生态学报, 2012, 23(6): 1476-1480.
[7] 于晓丹, 杜菲, 张蕴薇. 盐胁迫对柳枝稷种子萌发和幼苗生长的影响. 草地学报, 2012, 18(6): 810-815.
[8] 左海涛, 李继伟, 郭斌, 宋尚有, 高旺盛. 盐分和土壤含水量对营养生长期柳枝稷的影响. 草地学报, 2009, 17(6): 760-766.
[9] 李继伟, 左海涛, 李青丰, 范希峰, 侯新村. 柳枝稷根系垂直分布及植株生长对土壤盐分类型的响应. 草地学报, 2011, 19(4): 644-651.
[10] Liu Y, Wang Q Z, Zhang Y W, Cui J, Chen G, Xie B, Wu C H, Liu H T. Synergistic and antagonistic effects of salinity and pH on germination in switchgrass (PanicumvirgatumL.). PloS ONE, 2014, 9(1): e85282.
[11] Wang Q Z, Wu C H, Xie B, Liu Y, Cui J, Chen G, Zhang Y W. Model analysing the antioxidant responses of leaves and roots of switchgrass to NaCl-salinity stress. Plant Physiology and Biochemistry, 2012, 58: 288-296.
[12] 李继伟. 栽培管理措施和环境胁迫对柳枝稷生长特性和生物质品质的影响[D]. 内蒙古: 内蒙古农业大学, 2011.
[13] Mass E V, Poss J A. Salt sensitivity of wheat at various growth stages. Irrigation Science, 1989, 10(1): 29-40.
[14] 黄燕, 吴平. SAS统计分析及应用. 北京: 机械工业出版社, 2007: 67-98.
[15] Farquhar G D, Von C S, Berry J A. Models of photosynthesis. Plant Physiology, 2001, 125(1): 42-45.
[16] 鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2008: 257-282.
[17] Van Soest P J, Robertson J B, Lewis B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition. Journal of Dairy Science, 1991, 74(10): 3583-3597.
[18] Zhu J K. Plant salt tolerance. Trends in Plant Science, 2001, 6(2): 66-71.
[19] Azevedo Neto A D, Prisco J T, Enéas-Filho J, Lacerda C F D, Silva J V, Costa P H A D, Gomes-Filho E. Effects of salt stress on plant growth, stomatal response and solute accumulation of different maize genotypes. Brazilian Journal of Plant Physiology, 2004, 16(1): 31-38.
[20] Mauchamp A, Mésleard F. Salt tolerance inPhragmitesaustralispopulations from coastal Mediterranean marshes. Aquatic Botany, 2001, 70(1): 39-52.
[21] Van Zandt P A, Tobler M A, Mouton E, Hasenstein K H, Mopper S. Positive and negative consequences of salinity stress for the growth and reproduction of the clonal plant,Irishexagona. Journal of Ecology, 2003, 91(5): 837-846.
[22] Hoson T, Soga K, Mori R, Saiki M, Nakamura Y, Wakabayashi K, Kamisaka S. Stimulation of elongation growth and cell wall loosening in rice coleoptiles under microgravity conditions in space. Plant and Cell Physiology, 2002, 43(9): 1067-1071.
[23] Piro G, Leucci M R, Waldron K, Dalessandro G. Exposure to water stress causes changes in the biosynthesis of cell wall polysaccharides in roots of wheat cultivars varying in drought tolerance. Plant science, 2003, 165(3): 559-569.
[24] 裴惠娟, 张满效, 安黎哲. 非生物胁迫下植物细胞壁组分变化. 生态学杂志, 2011, 30(6): 1279-1286.
[25] Cheeseman J M. Mechanisms of salinity tolerance in plants. Plant Physiology, 1988, 87(3): 547-550.
[26] 林舜华, 黄银晓, 蒋高明, 韩荣庄, 高雷明. 海河流域植物硫素含量特征的研究. 生态学报, 1994, 14(3): 235-242.
[27] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33: 317-345.
[28] 许大全. 光合作用效率. 上海: 上海科学技术出版社, 2002: 32-34.
Effects of salt stress on biomass, quality, and photosynthetic physiology in switchgrass
ZHAO Chunqiao1,2, LI Jiwei2, FAN Xifeng2, HOU Xincun2, WU Juying2, HU Yuegao1,*, LIU Jili3
1CollegeofAgricultureandBiotechnology,ChinaAgriculturalUniversity,Beijing100193,China2Research&DevelopmentCenterforGrassandEnvironment,BeijingAcademyofAgriculturalandForestrySciences,Beijing100097,China3ResearchandDevelopmentCenterofNewTechnologyApplication,NingxiaUniversity,Yinchuan750021,China
In order to study the effects of salt stress on biomass, quality, and photosynthetic characteristics in switchgrass, a soil column test was performed with different salt stresses: 0.40% NaCl, 0.80% Na2SO4, and 0.80% NaHCO3(critical lethal concentration). Switchgrass with no salt stress served as control (CK). The results obtained are as follows: (1) The aboveground biomass, underground biomass, total biomass, seed yield, and root cap ratio of switchgrass decreased significantly (P< 0.05) under salt stresses of 0.40% NaCl, 0.80% Na2SO4, and 0.80% NaHCO3compared to the CK. Aboveground biomass of switchgrass was 56.14%, 61.73%, and 76.90% lower than the CK, respectively; underground biomass was 36.12%, 58.67%, and 77.57% lower than the CK; total biomass was 49.39%, 60.52%, and 76.45% lower than the CK; seed yields were 70.95%, 52.88%, and 33.81% lower than the CK; and the root cap ratios were 25.00%, 31.25%, and 32.50% lower than the CK. The relative seed mass of switchgrass was 0.92%, 1.91%, and 4.50% of the control under 0.40% NaCl, 0.80% Na2SO4, and 0.80% NaHCO3, respectively. Large differences were observed among salt stresses in the degree to which growth was inhibited, although all were under critical lethal concentrations. Salt stress with 0.80% NaHCO3caused the most serious negative impact on switchgrass biomass, and the weakest was with 0.40% NaCl. Biomass distribution between vegetative parts and sexual organs varied greatly with salt stress. (2) Grown with 0.40% NaCl, the ash content of aboveground biomass increased 14.89% compared to the CK. Grown with 0.80% Na2SO4, the sulfur (S) content of aboveground biomass increased 262.32% and cellulose content decreased 13.71%. With 0.80% NaHCO3, potassium (K) content increased 54.95% and hemicellulose content increased 10.87%. All five of these differences were statistically significant. Other quality indexes showed no significant differences, either among salt stresses or in comparison to CK values. The increased ash content and S content observed under 0.40% NaCl and 0.80% Na2SO4negatively affected the biomass combustion quality. The reduction in cellulose content and increase in hemicellulose content rendered the transformation and utilization of switchgrass biomass more difficult. (3) Grown with 0.40% NaCl, 0.80% Na2SO4, and 0.80% NaHCO3, the net photosynthetic rate (Pn) and the maximum photosynthetic rate (Pmax) of switchgrass leaves was inhibited significantly compared to the CK.Pndecreased 21.89%, 29.54%, and 24.59%, respectively, andPmaxdecreased 14.52%, 10.00%, and 4.1%, respectively. Stomatal conductance (Gs), intercellular CO2concentration (Ci), transpiration rate (Tr), light saturation point (LSP), and instantaneous light energy utilization efficiency (SUE) all decreased significantly compared to the CK. The limiting value of stomata (Ls) increased 20.27%, 16.22%, and 16.22%, respectively. The apparent quanta efficiency (AQY), respiration rate (Rd), instantaneous carboxylation efficiency (CUE), light compensation point (LCP), and water use efficiency (WUE) showed different magnitudes of change under different salt stresses. Stoma limitation may be the key factor inhibiting the photosynthesis and growth of switchgrass. This study lays a solid foundation for the large-scale planting of switchgrass in saline marginal land in northern and northwestern China.
switchgrass; salt stress; biomass; quality; photosynthetic physiology; marginal land
国家自然科学基金(31101103); 北京市农林科学院科技创新能力建设专项(KJCX201201001); 北京市农林科学院青年科研基金(QNJJ201219)
2014-02-17; < class="emphasis_bold">网络出版日期:
日期:2014-12-04
10.5846/stxb201402170269
*通讯作者Corresponding author.E-mail: huyuegao@cau.edu.cn
赵春桥, 李继伟, 范希峰, 侯新村, 武菊英, 胡跃高, 刘吉利.不同盐胁迫对柳枝稷生物量、品质和光合生理的影响.生态学报,2015,35(19):6489-6495.
Zhao C Q, Li J W, Fan X F, Hou X C, Wu J Y, Hu Y G, Liu J L.Effects of salt stress on biomass, quality, and photosynthetic physiology in switchgrass.Acta Ecologica Sinica,2015,35(19):6489-6495.

