HPV18 E7抗原T细胞表位的鉴定及CD4+T淋巴细胞的免疫反应
余剑琴 徐云升 欧荣英 张乾 郑飞云
HPV18 E7抗原T细胞表位的鉴定及CD4+T淋巴细胞的免疫反应
余剑琴 徐云升 欧荣英 张乾 郑飞云
目的 初步鉴定人乳头瘤病毒(HPV)18型E7抗原的辅助T淋巴细胞(Th)表位及CD4+T淋巴细胞的免疫反应。方法 以免疫磁珠进一步分离HLA-DRB1*0301阳性健康人外周血单核细胞(PBMC)中的CD4+T淋巴细胞,流式细胞仪鉴定细胞纯度,用之前实验中已获得的3个HPV18 E7抗原HLA-DRB1*0301限制性Th表位刺激外周血CD4+T淋巴细胞,用5-溴脱氧尿嘧啶核苷(Brdu)检测CD4+T淋巴细胞增殖活性。ELISA方法分析表位刺激CD4+T淋巴细胞分泌的细胞因子。结果 多肽P1(HPV18 E780-94)在体外刺激CD4+T淋巴细胞后能够有效诱导CD4+T淋巴细胞增殖,P1组与阴性对照组比较差异有统计学意义(P<0.01),多肽P1(HPV18 E780-94)刺激CD4+T淋巴细胞分泌IFN-γ,P1组与阴性对照组比较差异有统计学意义(P<0.01)。结论 P1(HPV18 E780-94)可能为HPV18 E7抗原HLA-DRB1*0301限制性Th表位。
人乳头瘤病毒 E7抗原 CD4+T淋巴细胞 Th表位
宫颈癌是女性最常见的的恶性肿瘤之一,发病率居女性癌症的第2位,死亡率居女性癌症的第3位[1]。2012年国际癌症研究机构确定了导致宫颈癌的12种人乳头瘤病毒(HPV)基因型,HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56、HPV58和HPV59,而HPV18是世界大部分地区宫颈癌患者中次于HPV16的第2位常见高危HPV,HPV18较HPV16具有更强的恶性转化能力,与宫颈腺癌显著相关,利用其制备的疫苗可能对肿瘤具有治疗作用[2]。我们在前期研究中采用SYFPEITHI预测软件,对靶抗原HPV18 E7的HLA-DRB1*0301限制性Th表位进行预测及预测肽合成、纯化及质谱鉴定,用合成的多肽在体外刺激人外周血单核细胞(PBMC),结果表明预测获得的其中1个候选表位能刺激淋巴细胞增殖[3-4]。为了进一步验证候选表位是否能刺激CD4+T淋巴细胞增殖,我们进一步进行了CD4+T淋巴细胞增殖试验并检测其极化方向,为进一步研制HPV18治疗性表位疫苗提供实验依据。
1 材料和方法
1.1 材料 由Genbank获得的HPV18 E7抗原由105个氨基酸组成,其序列见文献[4]。将HPV18E7抗原氨基酸序列输入SYFPEITHI网站工作,筛选并合成出3条HLA-DRB1*0301限制性多肽,P1(80-94)ADDLRAFQQLFLNTL,P2(72-86)IELVVESSADDLRAF,P3(18-32)QNEIPVDLLCHEQLS,分离HLA-DRB1*0301阳性健康人PBMC,为本实验准备,详见文献[4]。
1.2 试剂 Dynal CD4+T淋巴细胞阴性分选试剂盒及Dynal MPC-15磁性分离架购自挪威Dynal公司,5-溴脱氧尿嘧啶核苷(BrdU)购自德国Roche公司,流式细胞仪由美国Becton Dickinson公司生产。
1.3 实验方法
1.3.1 Dynal免疫磁珠分离CD4+T淋巴细胞及纯度鉴定使用Dynal CD4+T淋巴细胞阴性分选试剂盒分离PBMC,分离后所得CD4+T淋巴细胞用流式细胞仪计数并鉴定纯度,分析软件为Cell Quest V3.2。同时检测分离前后CD4+T淋巴细胞活力。
1.3.2 CD4+T淋巴细胞增殖实验 为了进一步验证P1、P2、P3三个多肽是否能刺激CD4+T淋巴细胞增殖,本实验进一步进行了CD4+T淋巴细胞增殖试验。(1)辅助细胞的处理:将分离得到的PBMC接种于25ml培养瓶中,37℃、95%湿度、5%CO2培养箱中培养12h后经直线加速器照射(30Gy)去增殖,作为抗原递呈细胞(APC)。(2)CD4+T淋巴细胞培养:调整CD4+T淋巴细胞浓度为2×106/ml,PBMC浓度为4×106/ml,于96孔平底培养板,每孔加入CD4+T淋巴细胞2×105、照射过的PBMC 2× 105,同时分别加入稀释好的合成多肽P1、P2、P3各10μg/ml(下文简称P1组、P2组、P3组);阴性对照孔只加稀释液,不含合成多肽(NC组);阳性对照孔加入植物血凝素(PHA),终浓度10μg/ml;空白孔为不含细胞的IMDM培养液;同时设立CD4+T淋巴细胞加合成多肽(P1、P2、P3)及APC加PHA的对照孔,终体积为200μl。每组做3个平行孔,于37℃、5%CO2培养箱中培养6 d,培养结束前24 h加入BrdU20μl。用酶标仪测定吸光度(OD)值,OD值=实验组OD值-空白对照组OD值。
1.3.3 ELISA法检测细胞因子 为了分析筛选出的表位肽诱导CD4+T淋巴细胞分泌的细胞因子,采用ELISA法检测多肽与CD4+T淋巴细胞共培养上清液中的细胞因子。将CD4+T细胞悬液调成细胞浓度为1×106/ml,经照射的PBMC悬液调成细胞浓度为1×106/ml;各取100μl铺于24孔培养板,加入合成多肽(10μg/ml),总体积0.5ml/孔;阴性对照孔只加稀释液,不含合成多肽。每组做3个平行孔,37℃、95%湿度、5%CO2培养72h。培养结束后离心,1 500r/min,5min,收集细胞悬液400μl置入Eppendorf管,上清液用ELISA法测定细胞因子IFN-γ、IL-10和IL-4表达情况。
1.4 统计学处理 使用SPSS12.0统计软件,计量资料以表示,组间比较采用方差分析。
2 结果
2.1 CD4+T淋巴细胞纯度 用PE标记的抗人CD3和FITC标记的抗人CD4加入PBMC分离前后试管,经流式细胞分析,可见分离前CD4+T淋巴细胞纯度为45.25%,分离后的纯度达到90.71%以上,可以进行后续实验(图1)。
2.2 细胞悬液中CD4+T淋巴细胞的活力 台盼蓝拒染法计数细胞总数及死细胞数,计算细胞活力,免疫磁珠分离前后CD4+T淋巴细胞的活力分别为(96.15±2.36)%及(94.32±3.11)%,差异无统计学意义(P>0.05)。
2.3 CD4+T淋巴细胞增殖情况 分离的CD4+T淋巴细胞与照射后的PBMC及合成多肽共同培养,结果显示P1能刺激CD4+T淋巴细胞增殖,NC组与P1组比较差异有统计学意义(P<0.01)。PBMC在此作为APC辅助多肽刺激CD4+T淋巴细胞增殖,经直线加速器照射可以抑制其增殖,用PHA刺激照射的PBMC(即APC)不能使其增殖。APC+PHA组及未经照射PBMC+PHA组OD值分别为0.228±0.010、0.930±0.045,两组的差异有统计学意义(P<0.01),说明体系中增殖的细胞为CD4+T淋巴细胞;在CD4+T淋巴细胞增殖实验时同时还设立了CD4+T淋巴细胞加抗原的对照,发现在缺乏APC的情况下CD4+T淋巴细胞也不能增殖;P1(CD4++PBMC+多肽)组与CD4++P1多肽组比较差异有统计学意义(P<0.01),表明多肽刺激CD4+T淋巴细胞增殖需要APC的辅助,而不是非特异性的刺激反应。详见图2。
2.4 ELISA法检测多肽刺激淋巴细胞增殖后的细胞因子表达情况 P1能刺激CD4+T淋巴细胞分泌IFN-γ,P1组与NC组及P2组比较差异均有统计学意义(均P<0.01),P1组与P3组比较差异也有统计学意义(P<0.05);而P1、P2、P3组与NC组比较,IL-10、IL-4水平的差异均无统计学意义(均P>0.05),详见图3。此结果表明P1能刺激Th0细胞向Th1细胞分化。

图1 流式细胞术鉴定免疫磁珠分离前后CD4+T淋巴细胞的纯度(A:分离前;B:分离后)
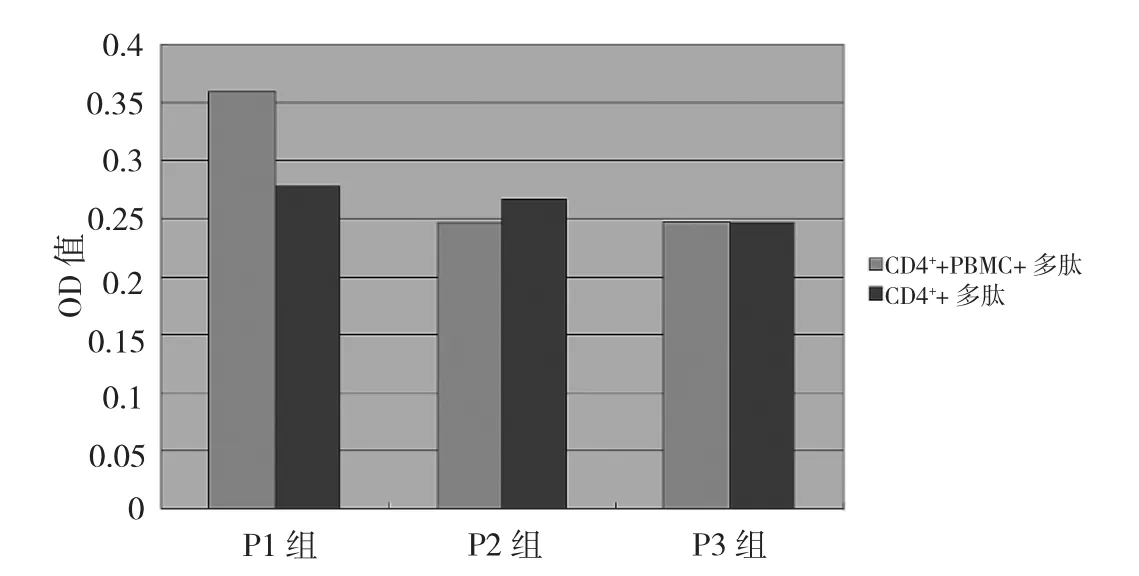
图2 不同多肽刺激CD4+T淋巴细胞增殖结果的比较
3 讨论
高危型HPV持续感染是宫颈癌发生的始动因子,宫颈癌的发生要经过一个较长的癌前病变阶段,在这个阶段可通过免疫学手段来帮助清除体内病毒,这就需要寻找HPV治疗性疫苗。其中合成多肽疫苗安全,容易储存和处理,有理想的靶特异性,是一类很有潜力的疫苗。目前对HPV16治疗性多肽疫苗研究较多,而37%~41%的宫颈腺癌是由感染HPVl8引起[5],因此,目前HPV18疫苗的研制和开发正日益受到关注。Th表位是外源蛋白经APC处理后与MHC-Ⅱ类分子结合并提呈到细胞表面供CD4+T淋巴细胞识别的短肽,其引发的CD4+T淋巴细胞应答对于辅助B细胞及CTL发挥效应具有重要作用。本研究结果也显示,多肽刺激CD4+T淋巴细胞增殖需要APC的辅助,而不是非特异性的刺激反应。

图3 不同多肽刺激CD4+T淋巴细胞增殖后细胞因子表达结果的比较
Zhao等[6]以重组痘苗病毒rVVJ18 E7、E6多肽分别免疫C57BL/6和BALB/c小鼠,检测其所诱发的细胞免疫反应,结果表明重组痘苗病毒rVVJ18 E7、E6免疫的两种品系小鼠均可测到E6肽库刺激产生的特异性细胞免疫反应,筛选确定2种多肽为CD8的T细胞表位。本研究结果显示,通过体外HPV18E7抗原多肽刺激CD4+T淋巴细胞,可检测到细胞增殖及细胞因子分泌,根据此文献可进一步做动物实验验证。
以往有关HPV治疗性多肽疫苗的研究主要是针对HLA-A2限制性CTL表位开展的。Ramos等[7]在体外试验中,给予由11个氨基酸组成的HPV16 E6/E7抗原肽(来自多肽库)刺激68例HPV相关肿瘤患者的PBMC及PBMC衍生的树突状细胞,发现HPV16 E6/E7能诱导PBMC产生特异性的CTL增殖,并能够分泌IFN-γ及IL-6等细胞因子,以上结果表明,HPV16 E6/E7多肽抗原在体外能诱导淋巴细胞产生免疫反应,与本研究的结果一致。
近年的研究策略已开始关注CD4+T淋巴细胞对HPV感染的影响。Zwaveling等[8]的研究表明,CpGDNA同HPV16 E743-77(含有H-2Kb限制性CTL表位HPV16 E749-57及Th表位E748-54)35肽合用,可使10只宫颈癌移植瘤小鼠中的8只肿瘤完全消退,另2只小鼠的肿瘤生长也较对照组缓慢,而CpGDNA同HPV16 E749-57肽合用仅能使9只宫颈癌移植瘤的小鼠中的3只肿瘤完全消退。Kim等[9]将巴氏涂片异常而行阴道镜组织活检的患者分为两组,一组是活检为CIN1,2,3为persistors组(n=51),另一组是活检正常为regressors组(n=33),检测INF-r、Tregs,结果表明regressors组CD4+T淋巴细胞反应比persistors组高,两者差异有统计学意义(P=0.015)。以上研究结果说明CD4+T淋巴细胞免疫反应在肿瘤免疫中起关键性作用。本研究结果显示,多肽P1(HPV18 E780-94)在体外刺激CD4+T淋巴细胞后能够有效诱导CD4+T淋巴细胞增殖,为今后以表位为基础的HPV疫苗设计提供了实验依据。
本研究选用BrdU比色法。BrdU与胸腺嘧啶具有结构的相似性,能代替胸腺嘧啶掺入S期细胞新合成的DNA链内。近年来进一步证实,3H-TdR和BrdU所标记的S期细胞结果完全一致,但BrdU更具有省时、简便、重复性好和无放射性等优点,BrdU具有更高的敏感性和可重复性。本研究采用淋巴细胞功能试验验证的方法鉴定出HPV18 E7抗原Th表位。在预测获得的3条多肽中,经淋巴细胞增殖试验证实P1能刺激淋巴细胞增殖。结果表明,经P1刺激后CD4+T淋巴细胞的比例较培养前以及未加多肽刺激的对照组均有明显增加,未加多肽刺激的对照组相对培养前无明显增加。同时经细胞因子检测,可以得出HPV18 E780-94能诱导活化CCD4+T淋巴细胞分泌IFN-γ。
综上所述,本研究初步证实E780-94是HPV18E7抗原HLA-DRB1*0301限制性Th1表位,为今后评价E7蛋白的细胞免疫效果提供了实验依据。
[1] Siddiqa A,Zainab M,Qadri I,et al.Prevalence and genotyping of high risk human papillomavirus in cervical cancer samples from Punjab,Pakistan[J].Viruses,2014,6(7):2762-2777.
[2] Liu TY,Hussein WM,Jia Z,et al.Self-adjuvanting polymer-peptide conjugates as therapeutic vaccine candidates against cervicalcancer[J].Biomacromolecules,2013,14(8):2798-2806.
[3]张乾,郑飞云,徐云升,等.HPV18 E7抗原HLA-A2限制性CTL表位的初步筛选[J].温州医学院学报,2007,37(2):100-103.
[4]余剑琴,郑飞云,徐云升,等.HPV18 E7抗原HLA-DRB1*0301限制性Th表位的筛选与鉴定[J].温州医学院学报,2008,38(3):193-196.
[5] Clifford G M,Smith J S,Plummer M,et al.Human papillomavirus types in invasive cervical cancer worldwide:a meta-analysis[J].Br J Cancer,2003,88:63-73.
[6] Zhao L,Ren J,Feng J,et al.Identification specific T lymphocyte epitopes on E6 protein ofhumanpapillomavirus type 18 in mice[J]. Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi,2010,24 (6):406-408.
[7]Ramos C A,Narala N,Vyas G M,et al.Human papillomavirus type 16 E6/E7-specific cytotoxic T lymphocytes for adoptive immunotherapy of HPV-associated malignancies[J].J Immunother, 2013,36(1):66-76.
[8] Zwaveling S,Ferreira Mota S C,Nouta J,et al.Established human papillomavi- rus type 16- expressing tumors are effectively eradicated following vaccination with long peptides[J].J Immunol, 2002,169(1):350-358.
[9]Kim KH,Greenfield WW,Cannon MJ,et al.CD4+T-cellresponse against human papillomavirus type 16 E6 protein is associated with a favorable clinical trend[J].Cancer Immunol Immunother, 2012,61(1):63-70.
Identification of specific T lymphocyte epitope on E7 antigen of human papillomavirus type 18 and CD4+T-cell response
YU Jianqin, XU Yunsheng,OU Rongying,et al.
Department of Obstetrics and Gynecology,the First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000,China
Objective To identify specific T lymphocyte epitope on E7 antigen of human papillomavirus type 18 and CD4+T-cell responses. Methods Three epitope candidates of human papillomavirus 18 E7 antigen(P1,P2 and P3)were obtained previously.Peripheral blood mononuclear cell(PB MC)from HLA-DRB1*0301-positive healthy donors were prepared and CD4+T cells were separated by Dynal Immunomagnetic beads isolation.The purity was determined by flow cytometry.The predicted peptides were scored as immunogenic ability to stimulate CD4+T cells.Proliferative activity was analyzed with Brdu cell proliferation assay.The cytokine production of CD4+T cells induced by the peptides was detected by ELISA. Results Peptide P1 (HPV18 E780-94)stimulated proliferation of CD4+T cells and the OD value was significantly higher than that of negative control group(P<0.01).Peptide P1(HPV18 E780-94)also stimulated CD4+T cells to secrete IFN-γ and IFN-γ value was significantly higher than that of negative control group(P<0.01). Conclusion Peptide P1(HPV18 E780-94)can be the HLA-DRB1*0301-restricted Th epitope of human papillomavirus 18 E7 antigen,which provides the basis to evaluate cellular immune response elicited by HPV18 E7 protein based vaccine.
Human papillomavirus E7 antigen CD4+T cells T lymphocyte epitopes
2015-01-21)
(本文编辑:沈叔洪)
国家自然科学基金项目(30500537)
325000 温州医科大学附属第一医院妇产科(余剑琴、欧荣英、张乾、郑飞云),皮肤科(徐云升)
郑飞云,E-mail:ZFY@hosp1.ac.cn

