热休克蛋白70反义寡核苷酸对肝癌细胞增殖及凋亡的影响
贺海斌 刘青光 杨威
热休克蛋白70反义寡核苷酸对肝癌细胞增殖及凋亡的影响
贺海斌 刘青光 杨威
目的 探讨热休克蛋白70反义寡核苷酸(HSP70 ASODN)对肝癌细胞增殖、凋亡的影响及其可能机制。方法 合成特异性靶向HSP70 ASODN,并将其转染SMMC-7721细胞;四甲基噻唑蓝(MTT)法检测HSP70 ASODN对SMMC-7721细胞增殖的影响,计算生长抑制率;荧光显微镜观察细胞凋亡形态;流式细胞仪分析细胞周期分布,计算细胞增殖指数;免疫细胞化学观察细胞内HSP70、Bcl-2、Bax的表达。结果 ASODN组细胞生长抑制率明显高于正义寡核苷酸(NSODN)组、转染试剂对照组及空白对照组(P<0.05);形态学观察到典型瘤细胞凋亡特征;流式细胞仪分析证实HSP70 ASODN主要阻止瘤细胞进入S期,细胞增殖指数下降,出现明显的凋亡峰;免疫细胞化学显示可降低细胞内HSP70、Bcl-2水平(P<0.05),提升Bax水平(P<0.05)。结论 HSP70 ASODN可抑制人肝癌SMMC-7721细胞的增殖,诱导细胞的凋亡,可能机制为中和了HSP70和细胞周期调节蛋白间的相互作用,导致细胞周期阻滞,打破了肿瘤细胞逃逸凋亡平衡,促使细胞发生凋亡。
原发性肝细胞癌 热休克蛋白70 反义寡核苷酸 凋亡
【 Abstract】 Objective To investigate the effect of heat shock protein 70 antisense oligonucleotide on proliferation and apoptosis of human hepatocellular carcinoma cell line SMMC-7721. Methods Human HCC cell line SMMC-7721 was transfected in vitro with heat shock protein antisense oligonucleotide mediated by SofastTM.Cell growth inhibition was determined as percentage by the colorimetric MTT cell viability/proliferation assay.Cell morphological change of apoptosis was observed with fluorescence microscope.Distribution of cell cycle was analyzed by flow cytometry.Immunocytochemistry staining was used to observe the intra-cellular expression of HSP70、Bcl-2、Bax. Results The inhibiting proliferation rate of SMMC-7721 cells increased with the treatment dose and incubation time of HSP70 ASODN.These effects were not observed in the cells treated with normal sense oligonucleotide or SofastTM Transfection Reagent.Apoptotic bodies were observed in SMMC-7721 cells treated with HSP70 ASODN at a concentration of 400nmol/L for 48h.Cytometric analysis showed a significant decrease in the percentage of G2/M and S-phases while a significant increase in the percentage of G0/G1 among the total cells treated with HSP70 ASODN. The results showed that treatment of SMMC-7721 cells with HSP70 ASODN for 48h resulted in a inhibition of HSP70 and Bcl-2 expression,and an increased expression of Bax.While treatment with HSP70 normal sense oligonucleotide for 48h had no effect on expression of these proteins. Conclusion The abrogation of HSP70 by HSP70 ASODN exclusively can inhibit cell growth and induce cell apoptosis.
目前,原发性肝细胞癌的临床治疗效果仍不能令人满意;基因治疗是通过改变肿瘤细胞的分子基础从而根本上抑制肿瘤的发生和发展,且对正常细胞的影响较小。笔者通过设计合成热休克蛋白70反义寡核苷酸 (heat shock protein 70 antisense oligonucleotide, HSP70 ASODN)片段,体外转染人肝癌细胞,观察和分析其对细胞增殖和凋亡的影响,探讨HSP70 ASODN治疗原发性肝细胞癌的可行性,现报道如下。
1 材料和方法
1.1 材料 FCS(杭州四季青公司);Tris碱(美国Promega公司);鼠抗人HSP70抗体(工作液)、鼠抗人Bcl-2抗体(工作液)、鼠抗人Bax抗体(工作液)、SP-9002试剂盒、DAB显色试剂盒(北京中杉金桥生物技术有限公司);二甲亚砜(DMSO)、胰蛋白酶、四甲基偶氮唑蓝(MTT)、碘化丙啶(美国Sigma公司);RPMI-1640培养液(美国GIBCO公司);细胞凋亡-Hoechst 33258染色试剂盒(江苏碧云天生物技术研究所);梭华-SofastTM(厦门太阳马生物工程有限公司);HSP70 ASODN、正义寡核苷酸(NSODN)(上海生工生物工程有限公司)。超净台(苏州净化设备厂);CO2孵育箱、低温离心机、全自动纯水装置、酶标仪(德国Heraeus公司);倒置显微镜、数码相机(日本Olympus公司);恒温水浴箱、高压锅、液氮罐(北京市医疗设备厂);78-1磁力加温搅拌器(杭州仪表电机厂);电子天平(德国Bosch公司);流式细胞仪(美国贝克曼库尔特公司);微量移液器、高速冷冻离心机(德国Eppendorf公司);恒温鼓风干燥炉(宁波自动化仪表厂);荧光照相显微镜(LEICA DM LB2,德国Leica公司);精密电子天平(瑞士Mettler公司);滤膜(天津东康公司);过滤器(德国Sartorius公司);高速台式离心机(上海安亭公司);水平摇床(北京六一公司);细胞培养瓶、细胞培养板(青岛博维生物科技公司)。
1.2 HSP70 ASODN的设计与合成 针对HSP70 mRNA翻译起始密码子及下游5个密码子设计HSP70 ASODN,HSP70 ASODN 5′-CGCCGCGGCTTTGGCCAT-3′、HSP70 NSODN 5′-ATGGCCAAAGCCGCGGCG-3′,均经全程硫代修饰,由上海生工生物工程有限公司合成。
1.3 细胞培养 人肝癌细胞株(SMMC-7721)由第二军医大学病理解剖学教研室建株,西安交通大学医学院第一附属医院检验医学中心惠赠,为高转移高侵袭细胞。采用含10%灭活小牛血清RPMI-1640培养液,于37℃、5%CO2培养箱中培养,0.25%的胰蛋白酶+0.02%的EDTA(北京中杉生物技术有限公司)消化传代。
1.4 四甲基噻唑蓝(MTT)法测定细胞生长抑制率 取对数生长期细胞,用RPMI-1640培养液配成5×104个/ ml细胞悬液,接种于96孔板中,每孔175μl,加入药物后终体积为200μl。随机分成4组,每组复设6孔。量效实验:(1)ASODN组:分别以100、200、400、600nmol/L A SODN转染 SMMC-7721细胞;(2)NSODN组:以400nmol/L NSODN转染SMMC-7721细胞;(3)转染试剂组:加入等量梭华-SofastTM;(4)空白对照组:加等量RPMI-1640培养液。按梭华-SofastTM转染试剂盒(厦门太阳马生物工程有限公司)说明进行细胞转染,在上述条件下继续48h终止培养。时效实验:选择量效实验最佳浓度作为实验浓度,分别于转染后24、48、72h终止培养。每孔加入0.5%MTT液20μl,继续孵育4h,倾尽上清液,每孔加入DMSO150μl,摇床上摇动10min充分溶解甲瓒,酶标仪波长490 nm处检测各孔光浓度值(OD值),计算细胞生长抑制率:生长抑制率=(对照组OD-实验组OD)/对照组OD×100%。
1.5 Hoechst33258染色观察细胞凋亡 2×105个/ml的单细胞悬液,接种在放置有预先处理过的盖玻片的24孔板内,每孔438μl,培养24h后换液。随机分为3组:400nmol/LHSP70 NSODN作用组、400nmol/LHSP70 ASODN作用组、正常对照组,每组6个复孔,加入RPMI-1640培养液,终体积均为500μl,继续培养48h后终止。按试剂盒说明进行染色封片。置荧光显微镜下观察并摄影,激发波长350nm,发射波长460nm。
1.6 流式细胞仪分析肿瘤细胞增殖周期分布 2×105个/ml的单细胞悬液,接种50ml培养瓶,每瓶4ml,培养24h后换液。随机分为3组:400nmol/LHSP70 NSODN作用组、400nmol/L HSP70 ASODN作用组、正常对照组,继续培养48h后终止。消化吹打成细胞悬液,离心1 500r/min×5min;细胞被重新悬浮于1ml冷盐水中,慢慢加入-20℃95%的乙醇3ml,其最终浓度为70%,并轻轻吹打,冰浴30min,4℃固定,过夜;再离心,1 500r/ min×5min,PBS液洗2遍;细胞沉淀中加入0.1%RNA酶溶液150μl,重悬细胞,4℃30min;再加入0.1%碘化丙啶染色液120μl混匀,4℃避光孵育15min。进行流式细胞检测。采用ModFit软件分析,统计各时相细胞的百分比,记录分布图,计算细胞增殖指数(proliferation index,PI):PI=(S+G2/M)/(G0/G1+S+G2/M)×100%。
1.7 免疫细胞化学 2×105个/ml的单细胞悬液,接种在放置有预先处理过的盖玻片的24孔板内,每孔438μl,培养24h后换液。随机分为3组:400nmol/ LHSP70 NSODN作用组、400nmol/LHSP70 ASODN作用组、对照组,每组6个复孔,加入RPMI-1640培养液,终体积均为500μl,继续培养48h后终止。按试剂盒说明进行染色封片。用10%多聚甲醛室温固定爬片细胞30min;吸出固定液,用PBS液手动轻轻晃动洗3遍;在爬片上滴加3%H2O2去离子水,室温孵育5~10min;滴加正常山羊血清工作液,室温孵育10~15min后,弃去血清;滴加一抗(HSP70、Bcl-2、Bax均为工作液),置4℃冰箱过夜;用PBS液手动轻轻晃动洗3遍;滴加生物素化羊抗小鼠IgG,-37℃孵育10~15min;用PBS液手动轻轻晃动洗3遍;滴加辣根酶标记链霉卵白素工作液(S-A/HRP),室温孵育10~15min;用PBS液手动轻轻晃动洗3遍;滴加二胺基联苯胺(DAB液)显色1~ 30min,肉眼和镜下观察显色效果;自来水充分冲洗,终止显色,常规梯度乙醇脱水,二甲苯透明,中性树脂封片。Nikeo光学显微镜观察,Galaxy S摄像显微镜联合Motic Images Advanced软件采集图像,并进行灰度值分析。
1.8 统计学处理 采用SPSS18.0统计软件,计量资料以表示,多组间比较采用方差分析,两组间比较采用t检验。
2 结果
2.1 HSP70 ASODN对细胞生长的影响 MTT法观察细胞生长抑制率发现,HSP70 ASODN转染SMMC-7721细胞后各时间段,细胞的生长均受到显著抑制,且这种作用呈剂量依赖性,即随着ASODN剂量的增加,细胞的生长率随之下降,详见表1;在同一浓度400nmol/L下,随着作用时间延长,细胞生长抑制率升高,详见表2;而NSODN对细胞生长的抑制作用不明显,单纯的转染试剂梭华-SofastTM对细胞的毒性很小。

表1 各浓度NSODN、ASODN作用48h对细胞增殖的影响
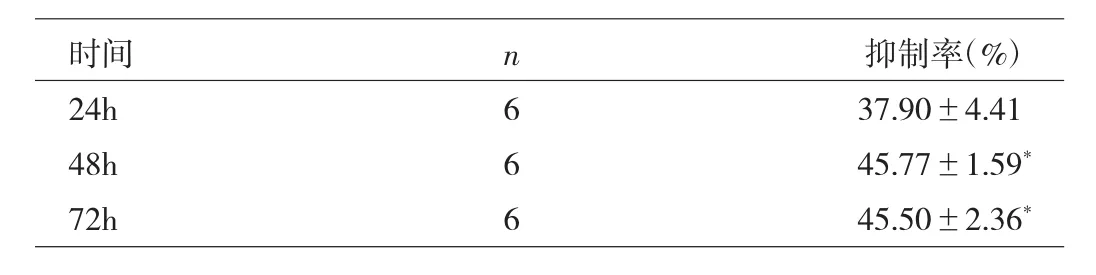
表2 400nmol/L ASODN作用24、48、72h对细胞增殖的影响
2.2 HSP70 ASODN对细胞凋亡的影响 DNA荧光染料Hoechst33258染色发现,HSP70 ASODN作用SMMC-7721细胞48h后,细胞发生凋亡。经DNA荧光染料Hoechst33258染色后,空白对照组的细胞膜完整,细胞质丰富而饱满,呈现亮度、大小均匀一致的圆形或类圆形细胞核浅蓝色荧光,而经过400nmol/L HSP70 ASODN处理48h后,可见核染色质凝集及边缘化的细胞,部分细胞内可见凋亡小体,核膜消失或突起呈小泡样,核质浓缩、碎裂。凋亡小体表现为边缘模糊、皱缩、明显较周围正常细胞核小、高亮蓝色的荧光团,详见图1。

图1 Hoechst33258染色细胞凋亡图(A:空白对照组;B:正义寡核苷酸组;C:反义寡核苷酸组;箭头示凋亡小体;×400)
2.3 HSP70 ASODN对细胞周期分布的影响 流式细胞仪检测发现,HSP70 ASODN处理后,G2/M期细胞比例显著降低,S期细胞比例下降,G0/G1期细胞比例显著上升,G0/G1期细胞PI由空白对照组的36.69%升至53.55%,S期细胞则由59.21%降至46.45%,G2/M期细胞几近消失,说明细胞主要被阻断在G0/G1期,细胞的增殖指数明显下降;NSODN组细胞各期分布自然,PI维持在64.06%,详见表3。

表3 3组各细胞周期PI的比较(%)
2.4 HSP70 ASODN对细胞内HSP70、Bcl-2、Bax表达的影响 免疫细胞化学显示人肝癌SMMC-7721细胞内HSP70有较高表达,主要在细胞质;Bcl-2呈现细胞质棕褐色着色,核膜上星点状轻微着色;Bax微弱表达,主要在细胞质。图像灰度值分析显示,经HSP70 ASODN处理48h后,图像灰度值逐渐升高,与空白对照组及NSODN组比较差异均有统计学意义(均P<0.01),细胞内HSP70显著下降(P<0.01);Bcl-2在处理后表达显著下降(P<0.01);Bax在处理后表达有显著升高(P<0.01)。NSODN组各检测蛋白图像的灰度值与空白对照组间无统计学差异,详见表4。

表4 HSP70、Bcl-2、Bax的免疫细胞化学图像分析灰度值表
3 讨论
热休克蛋白属于分子伴侣超家族成员,是细胞生长、凋亡、蛋白质稳态的生物化学调节剂[1-2]。在肿瘤细胞中,多种热休克蛋白高表达,并与肿瘤的发生、抗凋亡、免疫逃逸、恶性行为及不良预后密切相关[3-4]。近年来的研究表明,HSP70在肝细胞肝癌中高表达,是鉴别早期肝细胞肝癌与肝脏癌前病变、非肿瘤性肝病的良好生物学标志之一,细胞应激产生的HSP70有强大的抗凋亡作用,能够保护、挽救细胞,防止细胞通过凋亡途径死亡[5-7]。抗凋亡作用在肿瘤的发生、发展和耐药方面起重要作用,因此诱导肿瘤细胞的凋亡和增强化疗药物的敏感性成为近年来肿瘤治疗的重要策略。
本研究采用HSP70 ASODN阻断人肝癌癌细胞SMMC-7721内HSP70的表达,以了解HSP70对人肝癌癌细胞的增殖和存活的影响,结果发现HSP70 ASODN不仅使SMMC-7721细胞的生长受到抑制并且诱导其发生凋亡,并且呈时间剂量依赖性。流式细胞仪检测发现G2/M期细胞比例显著降低,S期细胞比例下降,G0/G1期细胞比例显著上升,有亚二倍体峰出现。免疫细胞化学显示细胞内HSP70、Bcl-2水平显著降低,Bax水平提升,而Bcl-2、Bax分别是Bcl-2家族中两个重要的抑制和促进细胞凋亡的蛋白,其参与调节细胞增殖凋亡活动中可能与HSP70有关[8-10]。由此推测,HSP70 ASODN抑制细胞增殖,诱导细胞凋亡的可能机制为中和了HSP70和细胞周期调节蛋白间的相互作用,导致细胞周期阻滞,打破了肿瘤细胞逃逸凋亡平衡,促使细胞发生凋亡。
本研究结果表明,HSP70对肿瘤的增殖和存活起着重要作用,通过反义寡核苷酸技术单独地抑制肝癌细胞中HSP70的表达即可诱导细胞凋亡显著增加,细胞生长受到显著抑制。为今后HSP70 ASODN应用于肝癌的治疗提供了新的理论依据,有望进一步提高肝癌的临床治疗效果。
[1] Daugaard M,Rohde M,Jaattela M.The heat shock protein 70 family:highly homologous proteins with overlapping and distinct functions[J].FEBS Lett,2007,581(19):3702-3710.
[2] 裘天仑,金国良,王晓明,等.热休克蛋白70在人挫伤脑组织中的表达及其意义[J].浙江医学,2007,29(3):219-221.
[3] Ciocca D R,Calderwood S K.Heat shock proteins in cancer: diagnostic,prognostic,predictive,and treatment implications [J].Cell Stress Chaperones,2005,10(2):86-103.
[4] Aurelie de Thonel,Valerie Mezger,Carmen Garrido.Implication of Heat Shock Factors in Tumorigenesis:Therapeutical Potential[J].Cancers,2011,3:1158-1181.
[5] Lee H W,Lee E H,Kim S H,et al.Heat shock protein 70 (HSP70)expression is associated with poor prognosis in intestinal type gastric cancer[J].Virchows Arch,2013,463(4): 489-495.
[6] Lim S O,Park S G,Yoo J H,et al.Expression of heat shock proteins (HSP27,HSP60,HSP70,HSP90,GRP78,GRP94)in hepatitis B virus-related hepatocellular carcinomas and dysplastic nodules[J].World J Gastroenterol,2005,11(14):2072-2079.
[7] Wang X P,Wang Q X,Li H Y,et al.Heat shock protein 70 chaperoned alpha-fetoprotein in human hepatocellular carcinoma cellline BEL-7402[J].World J Gastroenterol,2005,11(35): 5561-5564.
[8] Kim J A,Kim Y,Kwon B M,et al.The natural compound cantharidin induces cancer cell death through inhibition of heat shock protein 70 (HSP70)and Bcl-2-associated athanogene domain 3 (BAG3)expression by blocking heat shock factor 1 (HSF1)binding to promoters[J].J Biol Chem,2013,288(40): 28713-28726.
[9] MacKenzie T N,Mujumdar N,Banerjee S,et al.Triptolide induces the expression of miR-142-3p:a negative regulator of heat shock protein 70 and pancreatic cancer cell proliferation [J].Mol Cancer Ther.2013,12(7):1266-1275.
[10] Yiu C C,Chanplakorn N,Chan M S,et al.Down-regulation of heat-shock protein 70 (HSP-70)correlated with responsiveness to neoadjuvant aromatase inhibitor therapy in breast cancer patients[J].Anticancer Res,2010,30(9):3465-3472.
(本文编辑:严玮雯)
《浙江医学》对医学论文中有关实验动物描述的要求
在医学论文的描述中,凡涉及实验动物者,在描述中应符合以下要求:(1)品种、品系描述清楚,(2)强调来源,(3)遗传背景,(4)微生物学质量,(5)明确等级,(6)明确饲养环境和实验环境,(7)明确性别,(8)有无质量合格证,(9)有对饲养的描述(如饲料型、营养水平、照明方式、温度、温度要求),(10)所有动物数量准确,(11)详细描述动物的健康状况,(12)对动物实验的处理方式有单独清楚的交代,(13)全部有对照,部分可采用双因素方差分析。
本刊编辑部
Effect of heat shock protein 70 antisense oligonucleotide on proliferation and apoptosis of human hepatocellular carcinoma cell
HE Haibin,LIU Qingguang,YANG Wei.
Department of General Surgery,Ningbo Medical Treatment center Lihuili Hospital,Ningbo 315040,China
Primary hepatocellular cancer Heat shock protein 70 Antisense oligonucleotide Apoptosis
2014-07-21)
315040 宁波市医疗中心李惠利医院普通外科(贺海斌);西安交通大学医学院第一附属医院肝胆外科(刘青光、杨威)
刘青光,E-mail:liuqingguang@vip.sina.com.

