邻苯二甲酸二丁酯高效降解菌的分离、鉴定及降解特性
杨统一,高俊贤,刘 琦,连梓竹
(江苏科技大学环境与化学工程学院,江苏镇江212018)
邻苯二甲酸二丁酯高效降解菌的分离、鉴定及降解特性
杨统一,高俊贤,刘 琦,连梓竹
(江苏科技大学环境与化学工程学院,江苏镇江212018)
从土壤中分离出1株能够以邻苯二甲酸二丁酯为碳源和能源生长的细菌XHYG.经形态观察、生理生化鉴定、16S rDNA序列及系统发育分析,鉴定该菌株为无色杆菌(Achromobacter insolitus).对该菌株的降解条件进行优化,确定最佳降解条件为:温度30℃,pH=6.5~8.0.在最佳降解条件下,其在48 h内对400 mg/L DBP降解率达到90.67%,为邻苯二甲酸二丁酯的高效降解菌.底物降解广谱性试验表明,该菌株对邻苯二甲酸二辛脂(DOP)、邻苯二甲酸(2-乙基已基)酯(DEHP)都具有良好的降解能力,表明具备良好的底物降解广谱性,说明该菌株在处理邻苯二甲酸酯类化合物的污染治理中有独特的应用潜力.
邻苯二甲酸二丁酯;降解特性;生物降解;降解条件;16S rDNA
邻苯二甲酸酯类(phthalic acid esters,PAEs)是一类重要的有机化合物,被广泛用作塑料助剂、油漆溶剂、合成橡胶增塑剂及化妆品、香味品、润滑剂等生产原料中[1].然而,由于邻苯二甲酸酯增塑剂并非与树脂共价连接,因此极易扩散到环境中.目前,PAEs在环境中已到了普遍检出程度,包括在陆地生态系统及水域生态系统等都能检测到PAEs的存在[2].近期研究表明,PAEs具有致畸性、致突变性、致癌性及生殖毒性,可在极低浓度下干扰人和动物的内分泌系统,导致其发育紊乱[3].且在环境研究领域,邻苯二甲酸酯类被中国环境监测总站、美国国家环保局(EPA)和欧盟列为优先控制污染物[4].
PAEs在自然界中的降解分为生物降解和非生物降解两种,而微生物降解是其降解的主要途径[5].目前国内外有关PAEs微生物降解的研究有很多[6-7],如 Delfia sp.[8],Sphingomonsa sp.[9],Arthrobacter sp.[10],Paenibacillus sp.[11]等.但已报道的菌株能降解DBP且能降解多种邻苯二甲酸酯类化合物的还较少,因此有必要筛选高效广谱的DBP降解菌,丰富降解菌种类.本研究从镇江市江苏科技大学西校区垃圾处理站土样中分离到了1株能够高效降解邻苯二甲酸二丁酯的细菌,采用生理生化及16S rDNA序列分析等手段对该菌进行了鉴定,并研究其生长和降解特性,以期为PAEs污染物的治理及土壤修复提供一定的科学依据.
1 实验
1.1 实验材料
实验土样取自镇江市江苏科技大学西校区垃圾处理站附近土壤.
基础无机盐(MSM)培养基(g/L):K2HPO45.8,KH2PO44.5,(NH4)2SO42.0,MgCl20.16,CaCl20.02,Na2MoO4·2H2O 0.002 4,FeCl30.001 8,MnCl2·2H2O 0.001 5,pH=7.0,于121℃湿热灭菌20 min.固体培养基为含DBP的液体培养基加琼脂20 g/L.
富集培养基(g/L):牛肉膏5.0,蛋白胨10.0,NaCl 5.0,pH=7.0,于121℃湿热灭菌20 min.
主要试剂:邻苯二甲酸二丁酯(DBP,分析纯);邻苯二甲酸(2-乙基已基)酯(DEHP,分析纯);邻苯二甲酸二辛脂(DOP,分析纯);环己烷(色谱级),甲醇(色谱级).
1.2 实验方法
1.2.1 DBP降解菌的筛选与纯化
称取10 g土壤样品,加入20 ml无菌水,剧烈振荡混合均匀后于4 000 r/min离心机中离心5 min,取上清液;接着重复此步骤2次,最后取上清液获得土壤溶液.取分别稀释100倍、1 000倍、10 000倍的土壤溶液,涂布在固体MSM培养基(含DBP 100 mg/L)于30℃培养箱内培养7 d.然后挑取筛选的菌落接种于含DBP 200 mg/L的液体MSM培养基,150 r/min、30℃ 的摇床培养7 d,再用划线法划线于固体MSM培养基(含DBP 200 mg/L)于30℃培养箱内培养7 d,进一步分离单菌落.重复上述两步并逐步提高培养基中DBP含量依次为200,250,300,350,400 mg/L.最后将分离出的单菌用富集培养基富集.
1.2.2 菌株的生理生化鉴定
降解菌株形态及生理生化特性鉴定参照常见细菌系统鉴定手册[12]等文献.
1.2.3 菌株DNA的鉴定
降解菌株分子生物学鉴定采用16S rDNA序列分析.首先提取分离的降解菌DNA作为模板,利用16S rDNA基因通用引物F27和R1492进行PCR扩增.其中,引物F27为5’-AGA GTT TGA TCC TGG CTC AG-3’,引物R1492为5’-GGC TAC CTT GTT ACG ACT T-3’.
PCR扩增条件为:94℃预变性5 min;94℃变性40 s;55℃退火40 s;72℃延伸90 s,30个循环; 72℃最终延伸7 min,4℃保存.
PCR产物经1%琼脂糖凝胶电泳检测后,送上海生工生物工程技术服务有限公司完成测序工作.将测序结果提交GenBank,获得序列号KM598778,并同GenBank数据库中的基因序列进行BLAST比对,以获得相似性较高的相关菌株,采用MEGA6.0软件进行多序列比对,并构建系统进化树.
1.2.4 溶液中PAEs的含量测定
采用高效液相色谱法检测溶液中PAEs,具体处理方法如下:待测溶液于超声波振荡器中振荡10 min后取10 ml加入20 ml环己烷,剧烈振荡后放入超声波振荡器中振荡5 min,后倒入离心管在高速离心机(5 000 r/min)中离心分离取上层有机相,再用孔径为0.22 μm的有机相过滤器过滤后上机测定.
高效液相色谱条件:色谱柱为5μm Eclipse XDB-C18柱;流动相为甲醇∶水=90∶10;检测器波长为228 nm;柱温为35℃;柱压为15 bar;流速0.5 mL/min;进样量为10 μL;保留时间为11 min.
1.2.5 生物量测定方法
测定菌株的生物量,采用721型可见分光光度计在600 nm处测量培养基的光密度OD600.
1.3 降解菌底物广谱性测试
在基础无机盐培养基中分别加入邻苯二甲酸二辛脂(400 mg/L);邻苯二甲酸(2-乙基已基)酯(400 mg/L)于121℃湿热灭菌20 min.以2%的接种量将降解菌种子液接种到100 mLMSM中,160 r/min、30℃摇床培养.培养5 d后取样,用高效液相色谱法测定不同邻苯二甲酸酯的残留量.
1.4 菌株的降解特性研究
1.4.1 降解菌对DBP的降解曲线及生长曲线
将菌液离心分离获取菌体,再用MSM培养基重悬,调整菌液浓度OD600=1.0.然后将上述菌液1 ml接种到液体MSM培养基(DBP含量为400 mg/L) 25 ml中,在150 r/min、30℃ 的摇床培养,并设置一组液体MSM培养基(DBP含量为400 mg/L)不加入菌液作为对照.每24 h定时取样用高效液相色谱法测定其中DBP的含量,并测定其OD600值.
1.4.2 DBP高效降解菌的降解条件优化
1)温度
将菌株的菌液离心分离获取菌体,再用MSM培养基重悬,调整菌液浓度OD600=1.0.然后取上述菌液5份,每份1 ml分别接种到液体MSM培养基(DBP含量为400 mg/L)25 ml中,在150 r/min、温度分别为25,30,35,40,45℃ 的摇床培养5 d,并设置一组液体MSM培养基(DBP含量为400 mg/L)不加入菌液作为对照.用高效液相色谱法测定其中DBP的含量.
2)pH
将菌株的菌液离心分离获取菌体,再用MSM培养基重悬,调整菌液浓度OD600=1.0.然后取上述菌液5份,每份1 ml分别接种到液体MSM培养基(DBP含量为400 mg/L)25 ml中,将5份培养基pH分别调整为6.0,7.0,8.0,9.0,10.0在150 r/min、30℃ 的摇床培养5 d,并设置一组液体MSM培养基(DBP含量为400 mg/L)不加入菌液作为对照.用高效液相色谱法测定其中DBP的含量.
2 结果与讨论
2.1 菌株XHYG的分离及部分生理生化特征
经过富集培养,分离得到1株能够在DBP含量为400 mg/L的MSM培养基中很好生长的降解菌,此菌株能以DBP为唯一碳源很好地生长,将其命名为XHYG.XHYG菌株在MSM平板上于30℃恒温培养箱中培养5 d后,菌落呈圆形,不透明,黄色,中央部分突起,边缘部分光滑,质地致密且有光泽,不含水溶性色素,在显微镜下观察为球状.生理生化测试发现,菌株XHYG为革兰氏阴性菌,接触酶呈阳性反应,淀粉水解酶呈阴性反应,不产硫化氢气体,明胶液化反应、甲基红反应均呈阴性反应,能够发酵葡萄糖(详见表1).
2.2 降解菌底物广谱性测试
接种5 d后观察菌株XHYG都能很好地利用DOP和DEHP,根据图1所示,菌株XHYG对DOP的降解较DEHP要好.这与文献[13]中邻苯二甲酸脂类的生物降解效果与碳链长度和复杂程度呈反比相一致.

表1XHYG菌株的部分生理生化特征Table 1 Biophysical and biochemical characteristics of strain XHYG

图1 菌株XHYG对不同邻苯二甲酸酯的降解Fig.1 Degradation rate of different PAEs by strain XHYG
2.3 菌株XHYG的16S rDNA分子鉴定与系统发育分析
测序结果提交 GenBank的登录号为KM598778.在GenBank中进行BLAST比对分析,结果发现与菌株XHYG的16S rDNA序列相似性最高的是 Achromobacter insolitus,其相似性达到99%.结合其形态学和生理生化特征,可以初步确定XHYG为无色杆菌(Achromobacter insolitus).选取部分文献报道的PAEs降解菌,用MEGA 6.0软件包构建系统发育树(图2),对比降解菌的系统进化关系.由图2可以看出,文中筛选的XHYG菌株与无色杆菌(Achromobacter insolitus)处于同一分支,具有相同的进化距离,因而更进一步说明菌株XHYG为无色杆菌属.从图2还可看出,部分PAEs降解菌与XHYG菌株进化距离较远,说明PAEs降解基因广泛分布在不同种属.

图2菌株XHYG的系统发育树Fig.2 Phylogenetic tree of strain XHYG
2.4 菌株XHYG的生长曲线和降解曲线
菌株XHYG的生长和降解曲线如图3.

图3 菌株XHYG利用邻苯二甲酸二丁酯的生长和降解曲线Fig.3 Growth curves and degradation curves of DBP by strain XHYG
由图3可以看出,在0~1 d时,菌株XHYG生长缓慢,DBP的降解率较低,培养基呈现淡淡的乳白色;菌株在1~3 d为迟滞期;3~5 d为对数生长期;5 d后进入平衡期;从降解曲线上来看,菌株在48 h时对400 mg/L DBP降解率达到90.67%,在3~6 d,菌株XHYG以DBP为唯一碳源和能源迅速繁殖生长,在培养基底部逐渐产生灰白色悬浮颗粒物即菌体,而DBP也被大量降解,培养基颜色逐渐澄清;在5~6 d时期,菌株的生长进入平衡期,其OD600稳定在1.2左右,菌株的生长量逐渐达到最大值,DBP的残留量仅为4.09 mg/L,降解率达到98.99%.因此,确认菌株XHYG为DBP的高效降解菌.
2.5 温度对菌株XHYG降解DBP的影响
由图4看出,菌株XHYG对DBP的降解效果先随温度的升高而升高,达到最大值后,随着温度的升高而降低,菌株XHYG的最适生长温度为30℃,在温度超过35℃后降解活性大大降低.由此表明,温度过高或过低都会使菌株XHYG的生长受到抑制,降解活性降低.这与文献[11]的研究结果一致.这可能由于当温度过低时,菌体内酶的活性在低温下大大降低,导致菌株对DBP的降解效率降低;当温度过高时酶活性失活导致降解效率降低.
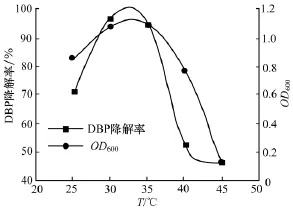
图4 温度对菌株XHYG降解邻苯二甲酸二丁酯的影响Fig.4 Effect of temperature on DBP degradation by strain XHYG
2.6 pH对菌株XHYG降解DBP的影响
由图5可以看出菌株XHYG的最适生长pH值在6.5~8.0左右,菌株的降解率能达到85%以上,而当pH值过低或者过高时菌株的生长均受到抑制,降解活性降低.由此表明,中性环境更利于这株菌株对DBP的降解.这与文献[16]分离出的HS-B1菌株相似,该菌株被鉴定为不动杆菌(Acinetobacter sp.),当pH>8.0,菌株的降解效率大大降低.
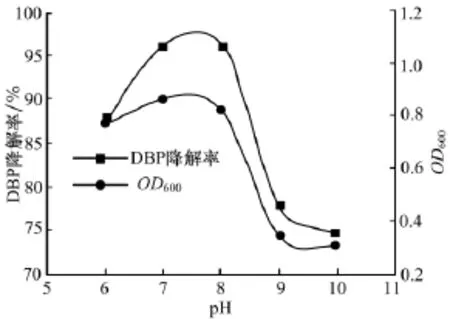
图5 pH对菌株XHYG降解邻苯二甲酸二丁酯的影响Fig.5 Effect of pH on DBP degradation by strain XHYG
3 结论
1)从土壤中分离得到了一株能够以DBP为碳源和能源生长的细菌XHYG,经过形态学特征、生理生化特征和16S rDNA序列系统学分析,初步鉴定该菌株为无色杆菌(Achromobacter insolitus).
2)XHYG生长和降解DBP的最佳培养条件为:温度30℃,pH 7.0;在此条件下,菌株迅速利用DBP作为碳源和能源进行生长,能够在DBP浓度为400 mg·L-1的无机盐培养基中生长良好,有较高的耐受性和降解效率.
References)
[1]Blount B C,Milgram K E,Silva M J,et al.Quantitative detection of eight phthalate metabolites in human urine usingHPLC-APCI-MS/MS[J].Analytical Chemistry,2000,72(17):4127-4134.
[2]Zolfaghari M,Drogui P,Seyhi B,et al.Occurrence,fate and effects of Di(2-ethylhexyl)phthalate in wastewater treatment plants:a review[J].Environmental Pollution,2014,194:281-293.
[3]Gu J D,Li J,Wang Y.Biochemical pathway and degradation of phthalate ester isomers by bacteria[J].Water Science Technology,2005,52(8):241-248.
[4]骆祝华,黄翔玲,叶德赞.环境内分泌干扰物:邻苯二甲酸酯的生物降解研究进展[J].应用与环境生物学报,2008,14(6):890-897.Luo Zhuhua,Huang Xiangling,Ye Dezan.Advances in research of biodegradation of environmental endocrine disruptors-phthalate esters[J].Chinese Journal of Applied&Environmental Biology,2008,14(6): 890-897.(in Chinese)
[5]Staples C A,Peterson RT.F.The environmental fate of phthalate esters:a literature review[J].Chemosphere,1997,35(4):667-749.
[6]Fang C,Long Y,Shen D.Removal of dibutyl phthalate from refuse from different phases of landfill in the presence of its dominant bacterial strains[J].Ecological Engineering,2014,71:87-93.
[7]Fang C,Yao J,Zheng Y,et al.Dibutyl phthalate degradation by Enterobacter sp.T5 isolated from municipal solid waste in landfill bioreactor[J].International Biodeterioration&Biodegradation,2010,64(6):442-446.
[8]刘洋,马保华,王兆梅,等.食品塑料包装中邻苯二甲酸酯类增塑剂的调查分析[J].现代食品科技,2013,29(1):181-185.Liu Yang,Ma Baohua,Wang Zhaomei,et al.Investigation of phthalates contamination in the market-sold plastic food packages[J].Modern Food Science and Technology,2013,29(1):181-185.(in Chinese)
[9]周洪波,胡培磊,刘飞飞,等.DBP降解菌株XJ1的分离鉴定及其降解特性[J].生物技术,2008,18 (2):64-67.Zhou Hongbo,Hu Peilei,Liu Feifei,et al.Isolation and identification of DBP-degrading strain XJ1 and its degradation characters[J].Biotechnology,2008,18 (2):64-67.(in Chinese)
[10]Jin D C,Liang R X,Dai Q Y,et al.Biodegradation of di-n-butyl phthalate by Rhodococcus sp.JDC-11 and molecular detection of 3,4-phthalate dioxygenase gene[J].Journal of Microbiol Biotechnol,2010,20 (10):1440-1445.
[11] 金雷,陈瑜,严忠雍,等.邻苯二甲酸二丁酯高效降解菌H-2的分离鉴定及其降解特性[J].食品科学,2014,35(15):202-206.Jin Lei,Chen Yu,Yan Zhongyong,et al.Isolation and identifi cation of a di-n-butyl phthalate(DBP)-degrading strain H-2 and its degradation characteristics[J].Food Science,2014,35(15):202-206.(in Chinese)
[12] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[13]Chang B V,Yang C M,Cheng C H,et al.Biodegradation of phthalate esters by two bacteria strains[J].Chemosphere,2004,55(4):533-538.
[14]吴学玲,金德才,赵维良,等.4株邻苯二甲酸二丁酯降解菌的分离鉴定及其相关降解基因的克隆[J].环境科学,2009,30(9):2722-2727.Wu Xueling,Jin Decai,Zhao Weiliang,et al.Isolation and identification of four DBP-degrading strains and molecular cloning of the degradation genes[J].Environmental Science,2009,30(9):2722-2727.(in Chinese)
[15] 金雷,严忠雍,施慧,等.邻苯二甲酸二丁酯DBP降解菌S-3的分离、鉴定及其代谢途径的初步研究[J].农业生物技术学报,2014,22(1):101-108.Jin Lei,Yan Zhongyong,Shi Hui,et al.Identification of a dibutyl phthalate(DBP)-degrading strain S-3 and preliminary studies on the metabolicpathway[J].Journal of Agricultural Biotechnology,2014,22(1): 101-108.(in Chinese)
[16] 陈湖星,杨雪,张凯,等.1株高效BBP降解菌的分离与特性研究[J].环境科学,2013,34(7):2882-2888.Chen Huxing,Yang Xue,Zhang Kai,et al.Isolation and characterization of a highly efficient BBP-degrading bacterium[J].Environmental Science,2013,34(7): 2882-2888.(in Chinese)
(责任编辑:顾 琳)
Isolation and identification of highly efficient DBP-degrading strain and its degradation study
Yang Tongyi,Gao Junxian,Liu Qi,Lian Zizhu
(School of Environmental and Chemical Engineering,Jiangsu University of Science and Technology,Zhenjiang Jiangsu 212018,China)
A bacterial strain XHYG which can utilize Dibutyl phthalate(DBP)as the source of carbon and energy was isolated from soil.Based on its morphology,physiological and biochemical identification,and 16S r DNA sequence analysis,XHYG was identified as Achromobacter insolitus.The results also showed that the optimum temperature and pH for its growth and styrene-degradation were 30℃and 6.5~8.0,respectively.Under the optimal conditions,strain XHYG degraded more than 90.67%of 400 mg/L DBP within 48 h.Diversity of degradable substrates also showed that HS-B1 can efficiently utilize many other phthalate esters such as di-n-octyl phthalate(DOP)and bis(2-ethylhexyl)phthalate(DEHP).It revealed that the strain XHYG has special application potential in dealing with the pollution caused by phthalate esters.
DBP;degrading characteristics;biodegradation;degradation condition; 16S rDNA
X172
A
1673-4807(2015)06-0607-05
10.3969/j.issn.1673-4807.2015.06.018
2015-03-18
国家自然科学基金资助项目(31400448);江苏省博士后基金资助项目(1401084B);江苏科技大学本科生创新计划资助项目
杨统一(1980—),男,博士,讲师,研究方向环境生物技术及土壤生态学.E-mail:tongyi@just.edu.cn
杨统一,高俊贤,刘琦,等.邻苯二甲酸二丁酯高效降解菌的分离、鉴定及降解特性[J].江苏科技大学学报(自然科学版),2015,29(6):607-611.

