PMLA-PEG-TAT纳米接枝物的合成和生物活性研究
郭松岩,崔明凤,周 青,乔友备,吴 娟,桑广泽,王玉琨*,吴 红*(.第四军医大学药学院药物分析学教研室,西安 7003;.第四军医大学西京医院妇产科,西安 7003)
PMLA-PEG-TAT纳米接枝物的合成和生物活性研究
郭松岩1,崔明凤1,周 青1,乔友备1,吴 娟2,桑广泽1,王玉琨1*,吴 红1*(1.第四军医大学药学院药物分析学教研室,西安 710032;2.第四军医大学西京医院妇产科,西安 710032)
目的 合成药物载体聚苹果酸(PMLA),制备纳米接枝物PMLA-Hyd-PEG5000/PEG2000-TAT/Doxorubicin(DOX),研究PEG对穿膜肽的保护作用及入胞特性。方法 以L-天冬氨酸为原料合成PMLA,将不同相对分子质量聚乙二醇(PEG5000)和PEG2000-TAT分别通过腙键和酰胺键与PMLA相连。阿霉素(DOX)作为模型药物,通过酰胺键与PMLA相连。采用Hela细胞研究纳米接枝物的细胞毒性和细胞内摄作用。结果 成功制备了药物载体PMLA和纳米接枝物PMLA-Hyd-PEG5000/PEG2000-TAT/DOX,筛选出当TAT含量为0.3%(TAT与PMLA的摩尔比,mol/mol)可发挥很好地穿膜入胞作用,PEG5000含量为3.2%(PEG与PMLA的摩尔比,mol/mol,下同)时对0.3%TAT有很好的保护作用,激光共聚焦实验(CLSM)验证了MTT实验结果。结论 一定量PEG5000对TAT有很好的保护作用,为后续去保护后,TAT发挥高效入胞作用提供前期研究基础。
TAT;聚乙二醇;聚苹果酸;纳米接枝物
纳米药物载体在癌症化疗领域具有巨大潜力[14]。以前药形式组成的聚合物纳米药物通过共价键与聚合物键合后,在血液循环过程中相对稳定,载药率可控,药物连续释放,不会出现暴释现象[5]。聚苹果酸(PMLA)是由多个单位苹果酸组成的一种线性阴离子C4-聚酯,其中α位具有悬挂羧基,β位具有酯形式的羧酸盐。PMLA的代谢产物苹果酸是三羧酸循环的一种中间体,故具备生物可降解性、生物组织相容性、无免疫原性的特点[6]。同时,PMLA具有多个悬挂羧基,可共价连接多种不同生物学功能的基团[78]。因此,PMLA是一种非常有潜力的聚合物药物载体。但研究中发现,PMLA较强的负电性(-30mV)影响了其携带抗肿瘤药物进入细胞的能力。配体受体介导的靶向药物体系本身存在缺陷,例如:肿瘤细胞有可能通过基因突变改变受体表型,从而使配体与受体无法结合,导致无法发挥靶向作用[9]。为了解决PMLA的入胞难题而提高纳米接枝物的抗肿瘤效率,引入细胞穿膜肽。
细胞穿膜肽(cell penetrating peptide,CPP)是20世纪中期开始认识到的一类具有生物膜穿透功能,可携带其他分子甚至超分子颗粒进入细胞中的短肽[1011]。其中,TAT是最先被发现并被证实的具有穿膜功能的多肽分子,它源于人类免疫缺陷病毒(HIV-1)的反式激活蛋白中的一段特殊氨基酸序列[12]。具有净正电荷性和两亲性,并可以携带其本身数倍甚至数十倍相对分子质量的物质进入细胞,但由于其可以导入几乎所有的细胞,这种非选择特异性导致其肿瘤蓄积较低。
因此,本研究选用PMLA为载体,利用不同相对分子质量PEG实现对穿膜肽的保护。TAT通过短链PEG2000与PMLA连接,长链PEG5000通过pH敏感的腙键与PMLA连接以实现对TAT的保护。在正常组织pH环境下,TAT隐蔽在长链PEG5000中;当纳米接枝物到达肿瘤区域,肿瘤弱酸环境下(pH6.0)腙键断裂,失去长链PEG5000保护作用,TAT裸露在外进而发挥穿膜作用,从而提高药物载体的入胞率。PEG的存在,有利于纳米接枝物在体内的长循环,使得更多的纳米接枝物在肿瘤部位聚积,但体内过多的PEG会产生抗PEG抗体,这种抗体会导致药物载体失去作用[13-14],因此控制PEG的含量至关重要。本研究通过MTT与CLSM实验对PEG含量进行优化和筛选,为上述构想奠定工作基础。纳米接枝物的示意图见图1。

图1 纳米接枝物的示意图Fig.1 Schematic presentation of the nanoconjugate
1 仪器与试药
1.1 仪器 核磁共振波谱仪(美国Bruker公司,400MHz,1H-NMR);RCT型磁力搅拌器(德国IKA公司);Hei-VAPI旋转蒸发仪(德国Heidolph公司);Olympus FV1000激光共聚焦显微镜(日本Olympus公司);BIO-RAD酶联免疫检测仪(美国伯乐公司)。
1.2 试药 L-天冬氨酸,购自上海楷洋生物技术有限公司;苯甲酸四乙基铵,参考文献方法,实验室自制;NH2-PEG2000-MAL,mPEG5000-NH2,购自西安瑞喜生物有限公司;二环己基碳二亚胺、N-羟基琥珀酰亚胺、2-HEH、MTT、胎牛血清,购自Sigama-aldrich公司;细胞穿膜肽TAT,购自上海强耀生物有限公司;胰蛋白酶和DMEM,购自杭州四季青生物工程材料有限公司;硫酸、氯仿、二氧六环、二氯甲烷、二甲基亚砜、四氢呋喃、苯甲醇,均为分析纯,购自国药集团上海化学试剂有限公司;三氟乙酸酐,购自济南万兴达化工有限公司,为分析纯试剂。
2 方法
2.1 聚苹果酸的合成 参考课题组前期工作[15],并加以改进,将L-天冬氨酸和溴化钠溶于2mol·L-1硫酸,逐滴加入亚硝酸钠溶液,经重氮化反应生成溴代丁二酸;将得到的溴代丁二酸溶于无水四氢呋喃中,逐滴加入三氟乙酸酐,室温反应3h后得到溴代丁二酸酐;再把得到的溴代丁二酸酐溶于无水四氢呋喃中,加入苯甲醇45℃油浴反应12h;减压蒸馏除去溶剂,用2mol·L-1的氢氧化钠调节pH至7.4,1∶1加入无水二氯甲烷,45℃油浴反应24h,分离,水洗3次,经硅胶柱(规格:3,粒度:300~400目的柱层析硅胶填充)分离纯化得到质量分数较高的β-苄氧羰基-β-丙内酯。向所得β-苄氧羰基-β-丙内酯中加入苯甲酸四乙基铵溶液,真空聚合后得β-聚苹果酸苄基酯;将β-聚苹果酸苄基酯溶于1,4-二氧六环,加入钯碳氢化于乙醚中沉淀,得到白色产物聚苹果酸。
2.2 PMLA-PEG2000-TAT/DOX的合成 取116mg PMLA溶于12mL无水DMSO中,同时称取38.4mg DCC(0.2mmol)和23mg NHS(0.2mmol)加入反应液中,室温搅拌反应12h;与此同时,取相应比例的TAT与MAL-PEG-NH2溶于DMSO中,室温搅拌反应12h得到NH2-PEG2000-TAT;将反应所得NH2-PEG-TAT溶液加入PMLA反应液中,室温搅拌12h,得到PMLA-PEG2000-TAT;取50mg DOX加入反应液中,室温避光搅拌反应24h;反应后用无水DMSO透析1d,用蒸馏水透析2d后,将透析袋内的溶液冷冻干燥,得到红色固体PMLA-PEG2000-TAT/DOX。
2.3 PMLA-Hyd-PEG5000/PEG2000-TAT/DOX的合成 合成路线见图2,称取116mg PMLA溶于12mL无水DMSO中,同时称取38.4mg DCC(0.2mmol)和23mg NHS(0.2mmol)加入反应液中,室温搅拌反应12h;与此同时,称取相应比例的PEG5000-CHO与2-HEH(摩尔比1∶5)溶于无水乙醇反应液中,室温反应12h;将所得产物旋干,与PMLA-NHS反应液合并,室温反应12h,得到PMLA-Hyd-PEG5000;取相应比例的TAT与MALPEG2000-NH2溶于DMSO中,室温搅拌反应12h得到NH2-PEG2000-TAT;将反应所得NH2-PEG-TAT溶液加入PMLA-Hyd-PEG5000反应液中,室温搅拌12h得到PMLA-Hyd-PEG5000/PEG2000-TAT;取50mg DOX加入反应液中,室温避光搅拌反应24h;反应后用无水DMSO透析1d,用蒸馏水透析2d后,将透析袋内的溶液冷冻干燥,得到淡红色固体PMLA-Hyd-PEG5000/PEG2000-TAT/DOX。

图2 PMLA-Hyd-PEG5000/PEG2000-TAT/DOX的合成路线Fig.2 Synthetic route of PMLA-Hyd-PEG5000/PEG2000-TAT/DOX
2.4 结构表征 采用1H-NMR表征PMLA。
2.5 细胞毒性研究
2.5.1 PMLA-PEG2000-TAT/DOX的细胞毒性研究收集对数期的Hela细胞,调节细胞悬液浓度为1 ×105个·mL-1,在96孔板上每孔种200μL,加入不同比例TAT的PMLA-PEG2000-TAT/DOX(TAT与PMLA上羧基摩尔比为0.1%,0.2%,0.3%,0.4%和0.5%,DOX=10μg·mL-1),每组设定3个复孔并设定空白对照。培养24h后,每孔加入MTT溶液(5mg·mL-1),继续培养4h,倒掉培养液,加入200μL DMSO溶液,震荡10min后,用酶标仪在490nm处测每孔A值。
2.5.2 PMLA-Hyd-PEG5000/PEG2000-TAT/DOX的细胞毒性研究 收集对数期的Hela细胞,调节细胞悬液浓度为1×105个·mL-1,在96孔板上每孔种200μL,加入不同比例、不同浓度的PMLA-Hyd-PEG5000/PEG2000-TAT/DOX,每种浓度的纳米接枝物设定3个复孔为空白对照。培养24h后,每孔加入MTT溶液(5mg·mL-1),继续培养4h,倒掉培养液,加入200μL DMSO溶液,震荡10min后,用酶标仪在490nm处测每孔A值。
2.6 细胞摄取实验 将Hela细胞计数后用DMEM培养基(体积分数10%胎牛血清,青霉素和链霉素100U·mL-1)接入激光共聚焦培养皿,接种密度为104/孔,24h后加入不同含量的纳米接枝物,孔内DOX浓度为0.003μmol·mL-1,于37℃、5%CO2,孵育4h后,用PBS(pH7.4)洗3遍,用40g·L-1多聚甲醛固定后,用DAPI染核,PBS缓冲液洗3次,置于激光共聚焦显微镜下观察药物入胞情况。
3 结果
3.1 PMLA与PMLA-Hyd-PEG5000/PEG2000-TAT/DOX的合成与结构表征 PMLA合成是通过阴离子开环聚合,文献中报道的MLABz的产率通常在15%左右[15],本课题通过前期提纯反应物,控制反应时间及反应温度等将产率提高至30%~35%。PMLA核磁图谱中2.92为亚甲基氢,5.38为次甲基氢,证明PMLA合成成功。见图3。PMLA-Hyd-PEG5000/PEG2000-TAT/DOX由于有多肽的存在,无法进行核磁表征,其结构可通过生物学实验予以证明。
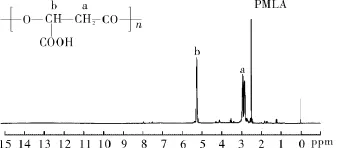
图3 PMLA的核磁图谱Fig.3 1H-NMR spectrum of PMLA
3.2 细胞毒性研究
3.2.1 PMLA-PEG2000-TAT/DOX中TAT含量的研究 通过MTT实验筛选出纳米接枝物中TAT的最佳含量,结果表明该纳米接枝物中当TAT的含量为0.3%及以上时,细胞毒性较0.1%和0.2%提高;当TAT含量大于0.3%时,纳米接枝物细胞毒性并没有显著提高。见图4。

图4 不同含量TAT(TAT与PMLA的摩尔比,mol/mol)的PMLA-PEG2000-TAT/DOX的细胞毒性Fig.4 Cytotoxicity of Hela cells after incubating with different TAT content of PMLA-PEG2000-TAT/DOX in various drug concentrations at 37℃for 24h
当TAT含量为0.3%(mol/mol)可发挥很好地穿膜入胞作用。由于PEG的含量会随着TAT含量的增加而增加。而根据文献报道,PEG含量过多时,将会降低药物载体的利用率,我们利用TAT含量为0.3%的纳米接枝物进行研究。
3.2.2 PMLA-Hyd-PEG5000/PEG2000-TAT/DOX中PEG含量的研究 选用TAT含量为0.3%,PEG含量为0,2%,4%和6%(PEG与PMLA中羧基的摩尔比,下同)4组纳米接枝物进行细胞毒性研究。结果表明,当PEG含量为4%和6%时,纳米接枝物的细胞毒性较PEG5000含量为0和2%的纳米接枝物细胞毒性低,而PEG含量为4%和6%的细胞毒性无显著差异。如图5A。由此可以推断,当TAT含量为0.3%,PEG含量为4%时,TAT可隐蔽在长链PEG中,无法发挥作用。为了更准确地找寻出PEG的最佳含量,我们选用TAT含量为0.3%,PEG含量为2.4%,2.8%,3.2%和3.6%的纳米接枝物进行细胞毒性研究。结果表明(图5B),当PEG含量为3.2%及以上时,纳米接枝物的细胞毒性降低;PEG含量为3.2%与3.6%的两组纳米接枝物的细胞毒性并无显著差异,故由此得出结论,PEG5000含量为3.2%(mol/mol)时对0.3%TAT有很好的保护作用。
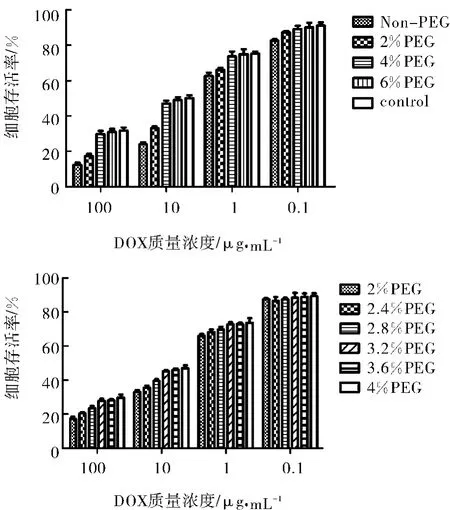
图5 不同含量PEG的PMLA-Hyd-PEG5000/PEG2000-TAT/DOX的细胞毒性Fig.5 Cytotoxicity of Hela cells after incubating with different PEG contents of PMLA-Hyd-PEG5000/PEG2000-TAT/DOX in various drug concentrations at 37℃for 24h
3.3 细胞摄取实验 激光共聚焦显微镜评估细胞对不同含量PEG的纳米接枝物的内摄作用见图6(蓝色为细胞核染料DAPI,红色为阿霉素)。由图6可知,PEG含量为3.2%及以上时,阿霉素的荧光强度较弱,说明该组药物进入细胞的量较少。PEG含量为0时,阿霉素荧光强度最高,说明该组药物进入细胞最多。由此说明PEG5000具有屏蔽TAT的作用,并且当PEG含量为3.2%时,屏蔽效果最好。

图6 纳米接枝物与Hela细胞在pH5.5(A),pH6.0(B),pH7.4(C)37℃共孵育4 h后的激光共聚焦照片Fig.6 Cellular uptake observed by CLSM into Hela cells after incubating with nanoconjugates in pH 5.5(A),pH 6.0(B),pH 7.4(C)for 4hat 37℃
4 讨论
聚合物药物载体分为天然高分子和合成高分子,常见的天然高分子药物载体有壳聚糖和明胶等,具有生物相容性好、无毒、可降解等优点[5]。但存在溶解性差、药物释放慢等缺陷而受到局限。与天然高分子药物载体相比,通过化学方法合成的高分子药物载体具有易于制备、能改善难溶药物的水溶性等优势,并且由于其无毒性、无免疫原性,近年来受到关注。例如:PEG已被美国FDA认证用于临床治疗[16]。这些具有生物相容性的高分子材料作为小分子药物的载体,可以在病灶部位有选择性地释放药物,极大地提高了药物的利用率。PMLA具有上述作为药物载体的合成高分子材料的特点,其降解产物为人体三羧酸循环中间产物,利于代谢。本课题以聚苹果酸为药物载体,键合抗肿瘤药物阿霉素制备聚合物前药PMLA-DOX,但由于PMLA带有较强的负电荷,不利于携带药物入胞。因此,本研究引入细胞穿膜肽TAT提高药物载体的入胞效率。但是由于其非特异性降低了运载效率,增加了药物的毒性和不良反应[17]。利用酸敏腙键键合长链PEG对TAT进行屏蔽,使TAT在正常生理pH环境下难以发挥作用,降低不良反应。实验结果表明,长链PEG具有屏蔽TAT的功能。由于PEG具有不可降解性、并会引起机体过敏等缺点[13-14],所以控制PEG的用量也至关重要。
本研究通过体外生物学实验得到结论,当PEG含量为3.2%时,能够有效地屏蔽含量为0.3%的TAT,有望在体内实验中达到最大的肿瘤蓄积从而提高药物的抗肿瘤效率。细胞内摄取实验同样证实了上述论点,通过激光共聚焦实验可知,随着pH下降,PEG5000发生断裂使TAT裸露并发挥作用,从而提高了药物的入胞率。所以,用腙键连接PEG屏蔽TAT,使其在pH7.4正常生理环境下无法发挥作用,以实现对肿瘤细胞的靶向介导。未来,我们将继续进行纳米接枝物的TAT去保护实验,为体内抗肿瘤应用奠定基础。
[1] Kam K R,Desai T A.Nano-and microfabrication for overcoming drug delivery challenges[J].J Mater Chem B Mater Biol Med,2013,1(14):1878-1884.
[2] Kim D,Lee E S,Park K,et al.Doxorubicin loaded pH-sensitive micelle:antitumoral efficacy against ovarian HELA/DOXR tumor[J].Pharm Res,2008,25(9):2074-2082.
[3] Bae Y,Fukushima S,Harada A,et al.Design of environment-sensitive supramolecular assemblies for intracellular drug delivery:polymeric micelles that are responsive to intracellular pH change[J].Angew Chem Int Ed Engl,2003,42(38):4640-4643.
[4] Ye W L,Du Jb,Zhang B L,et al.Cellular uptake and antitumor activity of DOX-hyd-PEG-FA nanoparticles[J].PLoS One,2014,9(5):e97358.
[5] 任天斌,侠文娟,吴畏,等.刺激响应型聚合物前药[J].化学进展,2013,25(5),775-784.
[6] Ding H,Helguera G,Rodriguez J A,et al.Polymalic acid nanobioconjugate for simultaneous immunostimulation and inhibition of tumor growth in HER2/neupositive breast cancer[J].J Control Release,2013,171(3):322-329.
[7] Ljubimova J Y,Fujita M,Khazenzon N M,et al.Nanoconjugate based on polymalic acid for tumor targeting[J].Chem Biol Interact,2008,171(2):195-203.
[8] Portilla-Arias J,Patil R,Hu J,et al.Nanoconjugate platforms development based in poly(beta,L-malic acid)methyl esters for tumor drug delivery[J].J Nanotechnol,2010,2010:825363.
[9] 谢云飞.配体-受体系统介导的药物靶向性研究进展[J].药物生物技术,2004,11(2),130-134.
[10] Wadia J S,Dowdy S F.Protein transduction technology.[J].Curr Opin Biotechnol,2002,13(1):52-56.
[11] 孙春萌,沈雁,涂家生.细胞穿膜肽的研究进展[J].中国药学杂志,2013,48(14):1143-1147.
[12] 蒋怡彬,俞仲望,徐晓辉.Tat穿膜肽的临床应用研究进展[J].第二军医大学学报,2008,29(2):215-217.
[13] Brouwers A H,De Jong D J,Dams E T,et al.Tc-99m-PEG-liposomes for the evaluation of colitis in Crohn′s disease[J].J Drug Target,2000,8(4):225-233.
[14] Assal C,Watson P Y.Angioedema as a hypersensitivity reaction to polyethylene glycol oral electrolyte solution[J].Gastrointest Endosc,2006,64(2):294-295.
[15] 李伟,段晓,范黎,等.叶酸介导的聚乙二醇-聚苹果酸-喜树碱聚合物前药的制备和性质初探[J].西北药学杂志,2013,28(4):396-399.
[16] Zhao H,Rubio B,Sapra P,et al.Novel prodrugs of SN38using multiarm poly(ethylene glycol)linkers[J].Bioconjug Chem,2008,19(4):849-859.
[17] Torchilin V P,Rammohan R,Weissig V,et al.TAT peptide on the surface of liposomes affords their efficient intracellular delivery even at low temperature and in the presence of metabolic inhibitors[J].Proc Natl Acad Sci U S A,2001,98(15):8786-8791.
TAT-conjugated poly(β-malic acid)-poly(ethylene glycol)nanoconjugate:synthesis and biological evaluation
GUO Songyan1,CUI Mingfeng1,ZHOU Qing1,QIAO Youbei1,WU Juan2,SANG Guangze1,WANG Yukun1*,WU Hong1*
(1.Department of Pharmaceutical Analysis,School of Pharmacy,the Fourth Military Medical University,Xi′an 710032,China;2.Department of Gynaecology and Obstetrics,Xijing Hospital,the Fourth Military Medical University,Xi′an 710032,China)
Objective The drug carrier of poly(β-malic acid)(PMLA)was synthesized to afford a novel nanoconjugate named poly(β-malic acid)-hydrazone bond-poly(ethylene glycol)5000(PEG5000)/PEG2000-TAT peptide/doxorubicin(DOX)for active tumor targeting.Methods The drug carrier PMLA was synthesized by L-aspartic acid.Different molecular weight PEGs were conjugatedwith PMLA by hydrazone bond and amide bond,respectively.The cytotoxicity and the cellular uptake assay were conducted by Hela cells.Result PMLA and nanoconjugate PMLA-Hyd-PEG5000/PEG2000-TAT/DOX were successfully prepared.The appropriate content of PEG(3.2%,mol/mol)was screened for hiding of TAT(0.3%,mol/mol)by cytotoxicity assay.The CLSM assay confirmed the result.Conclusion The TAT peptide was effectively protected by the appropriate content of PEG5000.This study provided an early foundation for the TAT peptide efficiently exerted cellular uptaking when the PEG5000was taken off.
TAT;poly(ethylene glycol);poly(β-malic acid);nanoconjugate
10.3969/j.issn.1004-2407.2015.02.022
R914
A
1004-2407(2015)02-0176-06
2014-11-20)
国家自然科学基金项目(编号:81271687)
郭松岩,男,在读硕士研究生
*通信作者:吴红,女,教授,博士生导师;王玉琨,男,教授,硕士生导师

