紫参片的质量标准研究
何 悦,肖会敏,党 珍,王四旺(第四军医大学药学院新药研究中心,西安 710032)
紫参片的质量标准研究
何 悦,肖会敏,党 珍,王四旺*(第四军医大学药学院新药研究中心,西安 710032)
目的 研究紫参片的质量标准控制方法。方法 ①采用TLC法对制剂中当归、灵芝、丹参药材及丹参酮ⅡA进行鉴别;②采用HPLC法,以乙腈-3.0mg·mL-1磷酸溶液为流动相,运用梯度洗脱法分别测定制剂中甘草苷、丹酚酸B、甘草酸、丹参酮ⅡA的含量,使用Inter sustain C18色谱柱(250mm×4.6mm,5.0μm),检测波长为260nm。结果 ①制剂中当归、灵芝、丹参药材及丹参酮ⅡA的薄层鉴别具有较好的专属性;②甘草苷、丹酚酸B、甘草酸、丹参酮ⅡA的线性范围分别为0.006 4~0.256 0,0.042 0~1.680 0,0.006 5~0.260 0和0.002 3~0.092 0mg·mL-1;相关系数(r)分别为0.999 6,0.999 1,0.999 3和0.999 4;③甘草苷、丹酚酸B、甘草酸、丹参酮ⅡA平均加样回收率分别为98.9%,99.0%,99.3%和99.9%;RSD分别为0.64%,0.46%,0.29%和0.78%;④10批制剂中甘草苷、丹酚酸B、甘草酸与丹参酮ⅡA的平均含量分别为0.83,10.55,1.43和0.20mg·g-1,RSD分别为1.22%,1.13%,0.98%和1.19%。结论 所建立的标准科学合理,可用于该制剂的质量控制。
紫参片;质量标准;薄层色谱法;高效液相色谱法
紫参片主要由紫河车、丹参、当归、灵芝、甘草等中药组成,主要用于放疗与化疗的防治。紫河车成分复杂,其主要含有氨基酸、激素、细胞因子等成分,具有双重滋补作用,既能壮阳,又能滋阴,为滋补珍品[12]。丹参主要活性成分有丹参酮类、丹酚酸类等,具有活血化瘀等功能[3-5]。当归主要活性成分有多糖类、黄酮类、挥发油等,具有补血活血、调经止痛等功能[68]。灵芝中含有有机锗、灵芝多糖、三萜类等,具有提高免疫力、降血脂、降血糖等作用[9]。甘草主要活性成分有三萜皂苷和黄酮类等,具有补脾益气、清热解毒、调和诸药等功效[10]。紫参片采用水提与醇提取[11],经喷雾干燥[12]、压片、包衣制成。为了保证制剂的疗效,对该制剂进行了质量标准研究。
1 仪器与试药
1.1 仪器 岛津高效液相色谱仪(型号2010CHT,Lab Solusion色谱工作站,日本岛津公司);万分之一电子分析天平(型号ME235S,德国赛多利斯公司);SK250-LHC超声波发生器(上海科导超声仪器有限公司)。
1.2 试药 丹参、当归及灵芝对照药材与甘草苷、丹酚酸B、甘草酸、丹参酮ⅡA对照品等,均购自中国食品药品检定研究院;紫参片(批号20130501,20130502,20130503,20130504,20130605,20130506,20130607,20130608,20130609,20130610),第四军医大学药物研究所研制;乙腈、甲醇(色谱级,美国Honeywell公司);水为自制超纯水(由Millipore纯水仪制备,北京同泰联科技发展公司);其余为分析纯。
2 方法与结果
2.1 丹参药材及丹参酮ⅡA TLC鉴别 取本品5片,除去薄膜衣,研细,加石油醚(30~60℃)5mL,振摇,放置2h,滤过,滤液挥干,残渣加乙酸乙酯1mL使溶解,作为供试品溶液。另取丹参对照药材1g,同法制成对照药材溶液与阴性样品(按处方比例根据本品制备工艺制成缺丹参的片剂)溶液。再取丹参酮ⅡA对照品,加乙酸乙酯制成每1mL含1mg的溶液,作为对照品溶液。按照文献方法[13]实验,吸取供试品溶液10μL及对照药材溶液和对照品溶液各4 μL,分别点于同一硅胶G薄层板上,以苯-乙酸乙酯(19∶1)为展开剂,展开,取出,晾干。结果在供试品色谱中,在与对照药材和对照品色谱相应的位置上,显相同颜色的斑点。
2.2 当归药材TLC鉴别 取本品5片,除去薄膜衣,研细,加石油醚(30~60℃)20mL,超声提取25min,滤过,滤液挥至1mL,作为供试品溶液。另取当归对照药材0.5g,同法制成对照药材溶液与阴性样品(按处方比例根据本品制备工艺制成缺当归的片剂)溶液。按照文献[13]实验,吸取供试品溶液10μL及对照药材溶液4μL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以石油醚(30~60℃)-乙酸乙酯(9∶1)为展开剂,展开,取出,晾干,置于紫外光灯(365nm)下检测。结果在供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。
2.3 灵芝药材TLC鉴别 取本品5片,除去薄膜衣,研成细粉,加氯仿10mL,超声处理30min,滤过,滤液挥至1mL,作为供试品溶液。另取灵芝对照药材2g,加氯仿15mL,同法制成对照药材溶液与阴性样品(按处方比例根据本品制备工艺制成缺灵芝的片剂)溶液。按照文献方法[13]实验,吸取供试品液10μL及对照药材溶液8μL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以苯-乙酸乙酯(19∶1)为展开剂,展开,取出,晾干,置于紫外光灯(365nm)下检视。结果在供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。
2.4 含量测定
2.4.1 色谱条件 色谱柱:Inter sustain C18色谱柱(250mm×4.6mm,5μm);流动相:乙腈(A)-3.0 g·L-1磷酸溶液(B)梯度洗脱,0~45min:B 10%~64%;45~60min:B 64%~99%:60~70min:B 99%。体积流量:1.0mL·min-1;柱温:25℃;检测波长:260nm;进样量:20μL[14]。
2.4.2 对照品溶液的配制 分别精密称取甘草苷12.80mg、甘草酸13.00mg、丹参酮ⅡA4.60mg,置于5mL量瓶中,加体积分数70%甲醇至刻度,摇匀,即得3个对照品的混合溶液(A溶液);另精密称取丹酚酸B 16.80mg,置于10mL量瓶中,加入精密量取的A溶液1.0mL,再加体积分数70%甲醇至刻度,摇匀,即得4个对照品的混合溶液,作为储备液。
2.4.3 供试品溶液的制备 取10片本品,去除薄膜衣,研成细粉,称取1.0g,精密称定,置于25mL量瓶中,加体积分数70%甲醇适量,超声30min,放凉,加体积分数70%甲醇至刻度,滤过(0.45μm滤膜),滤液作为供试品溶液。
2.4.4 线性关系 精密量取储备液0.025,0.125,0.250和0.500mL,分别置于1mL的量瓶中,分别加体积分数70%甲醇至刻度,摇匀,即得;储备液作为线性关系最高质量浓度溶液。上述溶液分别滤过(0.22μm滤膜),取20μL,分别注入液相色谱仪,考察对照品质量浓度与峰面积的线性关系及相关系数r,结果见图1和表1,表明其在相应质量浓度范围内具有良好的线性关系。
2.4.5 精密度实验 取线性考察样品溶液(0.25 mL储备液加体积分数70%甲醇定容至1mL)连续进样6次,测定甘草苷、丹酚酸B、甘草酸与丹参酮ⅡA峰面积的RSD分别为0.68%,0.75%,0.88%和0.92%,说明仪器精密度良好。
2.4.6 稳定性实验 取线性考察样品溶液(同2.4.5项),按上述色谱条件测定,分别在第0,1,2,4,8,12和24h进样1次。结果甘草苷、丹酚酸B、甘草酸与丹参酮ⅡA峰面积RSD分别为0.70%,0.86%,0.86%和0.98%,说明在24h内稳定。
2.4.7 重复性实验 分别称取紫参片(批号20130501)6份样品,精密称定,按供试品制备方法制备,按上述色谱条件测定,结果制剂中甘草苷、丹酚酸B、甘草酸与丹参酮ⅡA平均含量(mg·g-1)分别为1.186,15.073,2.040和0.293mg·g-1,RSD分别为1.25%,1.07%,1.01%和0.95%,说明该方法重复性良好。

图1 HPLC图A.混合对照品;B.紫参片供试品;C.缺丹参阴性对照;D.缺甘草阴性对照;1.甘草苷;2.丹酚酸B;3.甘草酸;4.丹参酮ⅡAFig.1 HPLC chromatogramsA.mixed reference;B.sample;C.negative control(lack of Salvia miltiorrhiza);D.negative control(lack of licorice)1.liquiritin;2.salvianolic acid B;3.glycyrrhizic acid;4.tanshinoneⅡA
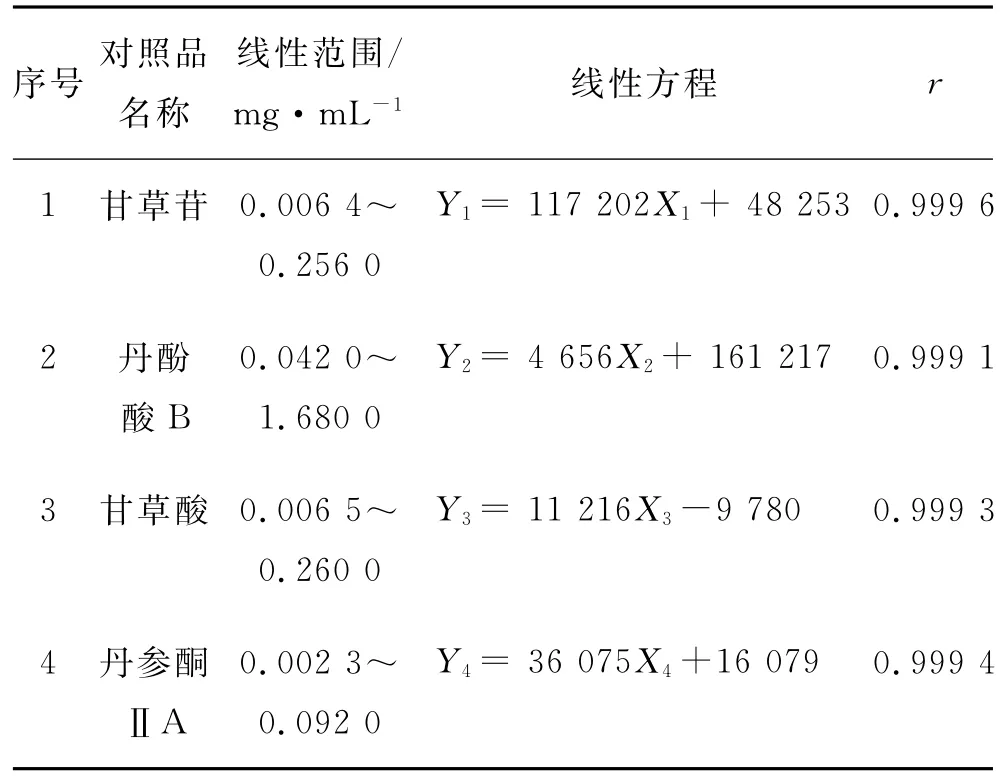
表1 各对照品的线性方程及其质量浓度范围Tab.1 Linear equations of each control sample and its concentration range
2.4.8 加样回收率实验 取本品10片(批号20130501,其中甘草苷、丹酚酸B、甘草酸与丹参酮ⅡA平均含量分别为1.186,15.073,2.040和0.293 mg·g-1),除去薄膜衣,研细,称取细粉1g,精密称定,添加1.0或2.0或4.0mL混合对照品溶液(分别精密称取甘草苷9.00mg、丹酚酸B 60.00mg、甘草酸15.00mg、丹参酮ⅡA 2.10mg,加体积分数70%甲醇15mL,摇匀,即得),按照供试品溶液制备方法制备,按上述色谱条件进行测定,结果见表2,表明本方法具有良好的回收率。
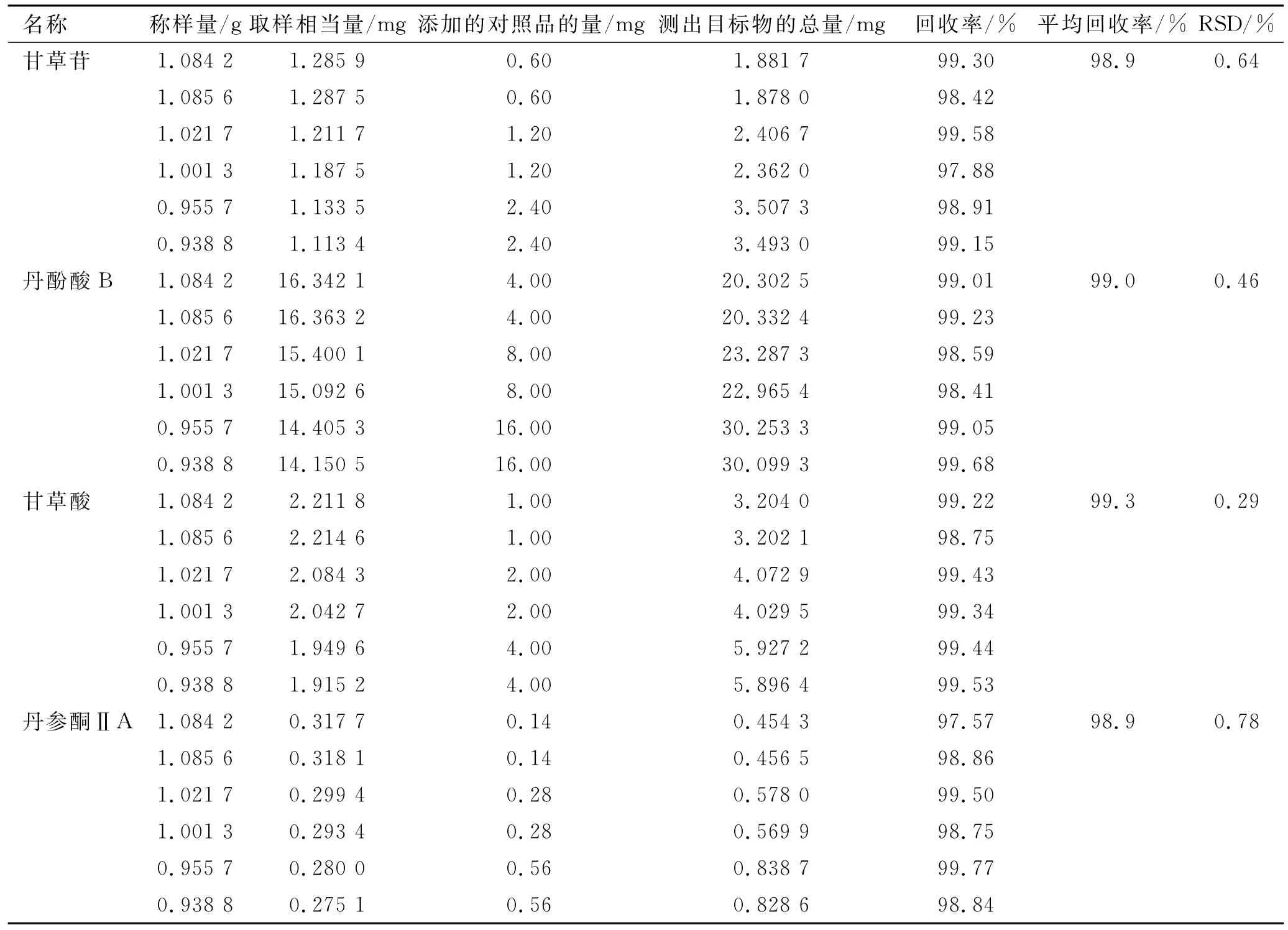
表2 加样回收率实验结果Tab.2 Results of the recovery test
2.4.9 含量测定 按照供试品溶液制备方法制备,按上述色谱条件测定,按外标法计算,10批制剂中甘草苷、丹酚酸B、甘草酸与丹参酮ⅡA的平均含量分别为0.83,10.55,1.43和0.20mg·g-1,RSD分别为1.22%,1.13%,0.98%和1.19%,说明不同批次间均一性较好。
3 分析讨论
3.1 TLC鉴别 丹参为方中臣药,成分明确,其水溶性有效成分和脂溶性有效成分均对低剂量辐射损伤有保护作用。因此,曾对丹参药材及其丹参酮ⅡA和丹酚酸B进行鉴别,结果检出丹参药材及丹参酮ⅡA特征斑点,由于该展开系统简单,重复性好,阴性对照无干扰,方法简便灵敏,故列入正文;而丹酚酸B特征斑点不清晰,经增加取样量及更换展开剂系统,结果依然不清晰,故未列入质量标准。当归是臣药,依据文献[15]方法,曾对当归中阿魏酸进行鉴别,结果特征斑点不清晰,且阴性对照产生干扰;经选用不同的制样方法与不同的展开系统实验,结果特征斑点依然不清晰,故未列入质量标准;而依据文献[13]对当归药材进行鉴别,结果检出清晰的当归特征斑点,同时阴性对照无干扰,重复性好,故列入质量标准。灵芝是臣药,依据文献[13]对灵芝药材进行鉴别,结果可检出特征清晰的灵芝斑点,且阴性对照无干扰,重复性好,故列入质量标准。甘草为方中调和药,曾对甘草酸或甘草次酸进行鉴别,结果因制剂中含量低,未检出。依据文献[13],对制剂中甘草药材进行鉴别,结果可以检出特征斑点但不清晰,同时重复性较差,故未列入质量标准。
3.2 含量测定 丹参为方中臣药,甘草为方中调和药,丹参酮ⅡA、丹酚酸B、甘草苷、甘草酸等为其主要活性成分。根据其制备工艺,已经大部分提出。对丹酚酸B、甘草进行TLC鉴别不具有专属性,因此选择HPLC测定其含量,结果表明,该方法稳定性与重复性好,专属性强,简单灵敏,故列入质量标准。紫河车为方中君药,目前对紫河车成分含量研究的文献报道不多,已知其主要成分为蛋白质、多肽、磷脂等,还含多种激素、干扰素等。由于成品为干燥品,其生物活性成分受加工炮制影响损失较大,对动物类蛋白质选用茚三酮鉴别反应[16],阴性对照有干扰。因此,采用半微量法进行了总氮含量测定,但考虑该指标没有实际用途,故未列入正文。
综上所述,把具有良好稳定性与重复性的含量测定项即甘草苷、丹酚酸B、甘草酸与丹参酮ⅡA含量测定,以及专属性强、重复性好的TLC鉴别项即丹参ⅡA以及丹参酮、当归、灵芝药材鉴别,纳入质量标准,可以很好地控制制剂质量。
[1] 孙冬梅,程晓英,赵艳渡,等.紫河车的炮制药理及临床应用[J].中国中医药杂志,2006,4(12):406-407.
[2] 朱照熙.紫河车与其伪劣品的紫外鉴别[J].中成药,1996,18(10):16-17.
[3] 徐丽君,黄光英.丹参的化学成分及其药理作用研究概述[J].中西医结合研究,2009,1(1):45-48.
[4] 李婧,刘汉清,孙小芬.丹参注射液多成分定量测定和指纹图谱研究[J].中成药,2011,33(4):553-556.
[5] 程茜菲,刘银环,许苗苗,等.丹参饮片HPLC指纹图谱研究[J].西北药学杂志,2013,28(6):556-558.
[6] 王雪梅,李应东.当归有效成分及其药理作用的研究进展[J].甘肃中医,2009,22(11):821-822.
[7] 李丽丽,刘向前,张晓丹.当归属植物研究进展[J].中成药,2009,31(4):601-607.
[8] 郭延生,华永丽,邓红娟,等.当归不同炮制品清除自由基谱效关系研究[J].中成药,2010,32(12):2107-2111.
[9] 李抒诗,于丽薇.灵芝中的化学成分及其药物作用和保健价值[J].中国医药指南,2009,7(4):108-109.
[10] 王巧娥,任虹,曹学丽.甘草研究开发与利用现状[J].中国农学通报,2011,27(4):290-295.
[11] 崔雪娜,王四旺 ,赫少清,等.正交实验优选紫参片的醇提工艺[J].现代生物医学进展,2010,10(18):3544-3546.
[12] 崔雪娜,王四旺 ,赫少清,等.不同干燥方式对紫参片质量的影响[J].西北药学杂志,2011,26(2):81-82.
[13] 国家药典委员会.中国药典2010年版[S].一部.北京:中国医药科技出版社,2010:7.
[14] 肖会敏,何悦,王四旺,等.紫参片的HPLC指纹图谱研究及多成分含量测定[J].药物分析杂志,2012,32(10):1756-1761.
[15] 胡亚楠,冯素香,王淑美,等.脑脉通有效部位中阿魏酸的含量测定[J].河南中医学院学报,2008,23(4):34-35.
[16] 李莹.胎盘提取液氨基酸分析[J].河南医药信息,2000,8(7):49-50.
Study on the quality standard for Zishen Tablets
HE Yue,XIAO Huimin,DANG Zhen,WANG Siwang*(New Materia Research Center,School of Pharmacy,the Fourth Military Medical University,Xi′an 710032,China)
Abstract:Objective To establish the quality standard for Zishen Tablets.Methods①Angelica root,Ganoderma lucidumand Salvia miltiorrhizain the preparation were identified by TLC.②HPLC with a gradient elution using acetonitrile-3.0mg·mL-1phosphoric acid as mobile phase was adopted to determine the contents of liquiritin,salvianolic acid B,glycyrrhizic acid and tanshinoneⅡA in the preparation.The analytical column was Inter sustain C18column(250mm×4.6mm,5.0μm).And the UV detection wavelength was set at 260nm.Results①TLCs of Angelica root,Ganoderma lucidumand Salvia miltiorrhiza showed good specificity.②For liquiritin,salvianolic acid B,glycyrrhizic acid and tanshinoneⅡA,concentration range of regression equations were 0.006 4-0.256 1,0.042 0-1.680 0,0.006 5-0.260 0and 0.002 3-0.092 0mg·mL-1,respectively.And r were 0.999 6,0.999 1,0.999 3and 0.999 4,respectively.③The average recoveries of liquiritin,salvianolic acid B,glycyrrhizic acid and tanshinoneⅡA were 98.9%,99.0%,99.3%and 99.9%,respectively.And their RSDs were 0.64%,0.46%,0.29%and 0.78%,respectively.④In 10batches′preparation,the average contents of liquiritin,salvianolic acid B,glycyrrhizic acid and tanshinoneⅡA were 0.83,10.55,1.43and 0.20mg per tablet,respectively.And their RSDs were 1.22%,1.13%,0.98%and 1.19%,respectively.Conclusion The standard can be used for the preparation quality control.
Zishen Tablets;quality standard;TLC;HPLC
10.3969/j.issn.1004-2407.2015.02.003
R282
A
1004-2407(2015)02-0117-05
2014-09-10)
国家科技重大专项课题(编号:2008BMX01-1)
何悦,女,药师
*通信作者:王四旺,男,硕士,博士生导师

