壶瓶枣多糖的分离及其抗氧化活性
张耀雷, 黄立新*, 张彩虹,2, 谢普军, 游 凤
(1.中国林业科学研究院林产化学工业研究所,生物质化学利用国家工程实验室,国家林业局林产化学工程重点开放性实验室,江苏省生物质能源与材料重点实验室,江苏南京210042;2.中国林业科学院林业新技术研究所,北京100091)
壶瓶枣多糖的分离及其抗氧化活性
张耀雷1, 黄立新1*, 张彩虹1,2, 谢普军1, 游 凤1
(1.中国林业科学研究院林产化学工业研究所,生物质化学利用国家工程实验室,国家林业局林产化学工程重点开放性实验室,江苏省生物质能源与材料重点实验室,江苏南京210042;2.中国林业科学院林业新技术研究所,北京100091)
目的研究壶瓶枣多糖的分离纯化及其抗氧化活性。方法壶瓶枣粗多糖用D900型大孔吸附树脂和DEAE-纤维素-52柱层析分离,以去离子水和0~1mol/L的NaCl溶液梯度洗脱,并考察其不同组分清除DPPH自由基、羟基自由基和超氧阴离子自由基的能力。结果分离纯化得到3个中性多糖组分(ZJP-1、ZJP-3和ZJP-5)和2个酸性多糖组分(ZJP-2和ZJP-4),并对DPPH自由基均有一定的清除能力。其中ZJP-2清除超氧阴离子自由基能力较强;ZJP-4清除羟基自由基能力较强;ZJP-5清除以上两种自由基能力均较强。结论D900型大孔吸附树脂和DEAE-纤维素-52的分离纯化效果较好,而且分离所得的5种多糖组分的抗氧化活性各有特点。
壶瓶枣;多糖;纯化;抗氧化活性
红枣是鼠李科枣属植物枣树Ziziphus Jujuba Mill.的果实,在我国栽培历史悠久,种植面积大,现已发展出包括壶瓶枣Ziziphus Jujuba Mill. cv.Hupingzao在内的700多个品种。红枣不仅是滋补佳品,而且也是一味传统的中药,因富含营养和保健成分而享誉中外,为我国传统药食兼用果品[1]。多糖是自然界浓度最丰富的生物聚合物,是构成生命的四大基本物质之一。研究发现多糖为红枣的主要功能性成分之一[2],具有抗肿瘤、降血脂、抗衰老、抗病毒、抗溃疡等多种生理活性[3],并且多糖类药物在癌症的辅助治疗中,具有毒副作用小、安全性高、抑瘤效果好等优点[4]。因此,多糖类产品是红枣深加工的可选择方向之一。目前关于红枣多糖的研究主要停留在提取分离阶段,而其后续研究相对较少。本实验采用D900型大孔吸附树脂和DEAE-纤维素-52柱层析对壶瓶枣粗多糖进行分离纯化,并研究了其不同组分的抗氧化作用,以期获得具有良好生物活性的高纯度多糖组分,为开发红枣功能性食品及药品提供理论基础,进一步提高我国红枣资源的深加工附加值。
1 材料与仪器
1.1 材料 红枣,产地为山西省太谷县,购于南京市锁金村农贸市场,经中国林科院林产化学工业研究所王成章研究员鉴定为壶瓶枣;D900型大孔吸附树脂,购于沧州宝恩吸附材料科技有限公司;DEAE-纤维素-52,购于阿拉丁试剂有限公司;MD44透析袋(分子质量为3 500),购于Biosharp生物科技有限公司。
1.2 试剂 葡萄糖、浓硫酸、苯酚、乙醇、DPPH、考马斯亮蓝G-250、磷酸、七水合氯化亚铁、水杨酸、双氧水、三羟甲基氨基甲烷、Vc、盐酸、邻苯三酚,均为分析纯 (国药集团化学试剂有限公司)。
1.3 仪器设备 JM型胶体磨(温州市康而达实业有限公司);DHG-9070A型电热恒温鼓风干燥箱(上海索谱仪器有限公司);Wizard 2.0型真空冷冻干燥机(美国VirTis公司);分析天平(美国奥豪斯公司);SHZ-D(Ⅲ)循环水式真空泵和RE-5299型旋转蒸发仪 (上海东玺制冷仪器有限公司);UV-2102PC紫外可见分光光度仪 (上海尤尼科光谱设备有限公司);HH-4型数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司)。
2 实验及测定方法
2.1 壶瓶枣粗多糖的分离纯化 壶瓶枣粗多糖溶液400 mL(多糖质量浓度20.12 mg/mL),以D900型大孔吸附树脂作为柱子 (75 mm×1 200 mm)的层析填料进行分离纯化,4倍体积的去离子水以10 m L/min的体积流量进行洗脱,每50 m L隔管检测,作洗脱曲线 (苯酚-硫酸法跟踪检测多糖质量浓度,280 nm下吸光值跟踪检测蛋白质浓度);用DEAE-纤维素-52层析柱(20 mm×500 mm)对所得不同组分多糖进行纯化,用去离子水和0~1 mol/L的NaCl溶液以0.5 mL/min的体积流量洗脱,每6 mL隔管检测,作洗脱曲线,收集不同组分,浓缩后透析48 h。
2.2 多糖的测定 采用苯酚-硫酸法[5],制作葡萄糖标准曲线:准确称取80℃下干燥至恒定质量的葡萄糖对照品0.100 g,定容至1 000 mL,配成0.1 mg/mL的标准溶液。精确移取标准溶液0、0.2、0.4、0.6、0.8、1.0 mL,置于带塞试管中,各以蒸馏水补充至2.0 mL,加入质量分数为6%的重蒸苯酚1.0 mL及浓硫酸5.0 mL,水浴10 min,室温放置20 min后,于490 nm下测吸光度,得标准曲线的回归方程C=0.066 6A-0.000 3(r= 0.999 1)。
2.3 蛋白质的测定 采用考马斯亮蓝法[6],制作牛血清白蛋白 (BSA)标准曲线:准确称取0.1 g牛血清白蛋白,定容至100 m L,配成1 mg/mL的标准溶液,精确移取标准溶液0、0.2、0.4、0.6、0.8、1.0 mL于试管中,各以蒸馏水补充至1.0 mL,加入4 mL考马斯亮蓝溶液,室温下反应5 min,在595 nm下测其吸光度,得标准曲线的回归方程C=0.123 2A-0.006 5(r=0.998 1)。
2.4 多糖的紫外-可见光谱分析 取壶瓶枣粗多糖溶液与D900型大孔吸附树脂柱层析后所得不同组分多糖,配制成多糖质量浓度为0.4 mg/m L的溶液,在190~700 nm的紫外-可见波长范围内进行扫描,考察纯化效果。
2.5 多糖的抗氧化活性分析
2.5.1 DPPH自由基清除能力的测定 参照文献[7]并做部分修改,1 mg/mL的多糖溶液2 mL与0.2 mmol/L的DPPH乙醇溶液2 mL在室温下保存30 min于517 nm下测吸光值A1;取蒸馏水代替多糖溶液,测吸光值A0;取乙醇代替DPPH溶液,测吸光值A2,按下式计算清除率,以VC作对照。
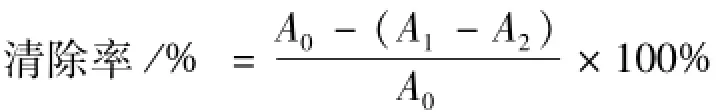
2.5.2 羟基自由基清除能力的测定 采用Fenton体系产生·OH,水杨酸法检测羟基及样品清除·OH的能力[8]。1 mg/m L的多糖溶液1 mL,9 mmol/L的FeSO4溶液1 m L,9 mmol/L的水杨酸乙醇溶液1 mL,8.8 mmol/L的H2O2溶液1 mL在37℃下水浴30 min,于510 nm下测吸光值A1;取蒸馏水代替多糖溶液,测吸光值A0;1 mL多糖溶液与3 mL蒸馏水混合,测吸光值A2,按下式计算清除率,以VC作对照。
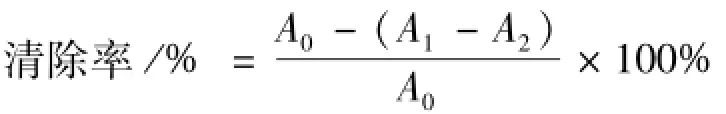
2.5.3 超氧阴离子自由基清除能力的测定 采用邻苯三酚自氧化法[9],1 mg/mL的多糖溶液0.5 mL与5mL PH为8.2的Tris-HCl溶液于25℃下反应20 min,加10 mmol/L邻苯三酚0.5 mL于320 nm下测吸光度A1;取蒸馏水代替多糖溶液,测吸光值A0,绘制吸光度值与时间曲线,斜率即为自氧化速率。按下式计算清除率,以VC作对照。

3 结果与讨论
3.1 壶瓶枣粗多糖的分离 利用D900型大孔吸附树脂层析柱对壶瓶枣粗多糖进行分离纯化,洗脱结果如图1所示。由图1可知,粗多糖经过柱色谱洗脱分离后,可以收到Ⅰ、Ⅱ和Ⅲ三个部分,多糖回收率为86.75%,脱蛋白率为89.41%。
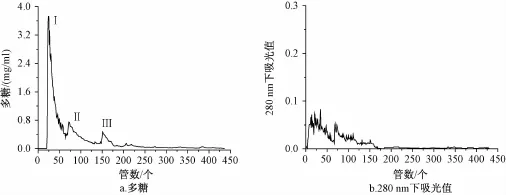
图1 粗多糖的D900型大孔吸附树脂柱层析洗脱曲线Fig.1 Elution curve of crude polysaccharides on themacroporous adsorption resin D900 colum n
3.2 多糖的紫外-可见光谱分析 为了考察D900型大孔吸附树脂柱的分离纯化效果,对原液及Ⅰ、Ⅱ和Ⅲ三部分多糖溶液进行全波长扫描,结果见图2。由图2可知,未经色谱柱处理的壶瓶枣粗多糖溶液在280 nm处有一个肩峰,且在可见光区有较大吸收,经层析后,280 nm处肩峰消失,且多糖溶液在可见光区无吸收,说明粗多糖的分离纯化效果较为明显。这是因为D900型大孔吸附树脂可吸附含羟基、氨基、共扼双键和氢键的物质。由于蛋白质是一种富含氨基酸和氢键的物质,因此可以被大孔树脂吸附[10],并且蒸馏水不能将其洗脱下来。多糖虽然具有多羟基结构,但由于其易形成分子内氢键,故减弱了与大孔树脂形成氢键的能力[11],因此,蒸馏水可以将多糖从D900型大孔吸附树脂柱上洗脱下来,达到将其与蛋白质及其他杂质分离的目的。
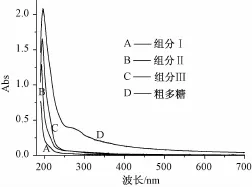
图2 多糖溶液的紫外-可见光吸收曲线Fig.2 Ultraviolet-visible absorption curve of the polysaccharides solution
3.3 粗多糖的分级纯化 用DEAE-纤维素-52层析柱对Ⅰ、Ⅱ和Ⅲ三部分多糖进行分级纯化,洗脱曲线分别见图3、图4及图5。在洗脱曲线中,各个组分洗脱峰狭窄对称,说明分离效果较好。由图3和图4可知,组分Ⅰ和Ⅱ的多糖经柱层析后均可得到两个组分,其中由去离子水洗脱后,可得到一个中性多糖组分和一个酸性多糖组分,分别为ZJP-1和ZJP-3;由0~1.0 mol/L的NaCl溶液线性梯度洗脱后,可得到一个酸性多糖组分,分别为ZJP-2和ZJP-4。由图5可知,组分Ⅲ经柱层析后,只得到一个中性多糖组分ZJP-5。
3.4 5种多糖组分的抗氧化活性
3.4.1 5种多糖组分的DPPH自由基清除能力
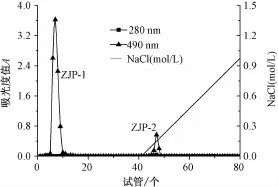
图3 组分Ⅰ的DEAE-纤维素-52柱层析洗脱曲线Fig.3 Elution curve of fractionⅠon the DEAE-cellulose-52 column
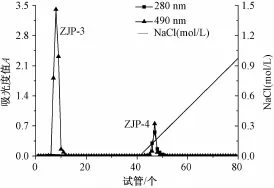
图4 组分Ⅱ的DEAE-纤维素-52柱层析洗脱曲线Fig.4 Elution curve of fractionⅡon the DEAE-cellulose-52 column
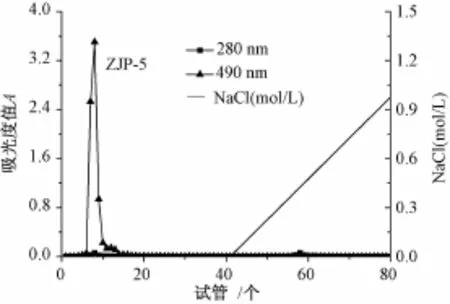
图5 组分Ⅲ的DEAE-纤维素-52柱层析洗脱曲线Fig.5 Elution curve of fractionⅢon the DEAE-cellulose-52 column
DPPH自由基在有机溶剂中是一种稳定的自由基,其孤对电子在517 nm附近有强吸收,有机清除剂可使孤对电子被配对,通过测定吸收减弱的程度可评价自由基清除剂的活性[12]。由图6可知,5种多糖组分均具有一定的DPPH自由基清除能力,但作用较弱,且其清除率随浓度变化而增加缓慢;同质量浓度壶瓶枣多糖的DPPH自由基清除能力弱于Vc,顺序为ZJP-5>ZJP-4>ZJP-1>ZJP-2>ZJP-3,其中当ZJP-5质量浓度为3.5 mg/mL时,其清除率趋于稳定,为21.32%。
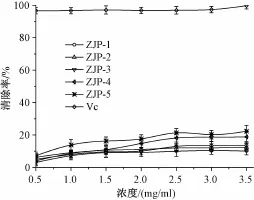
图6 5种多糖组分的DPPH自由基清除能力Fig.6 Scavenging capacity to·DPPH of five fractions
3.4.2 5种多糖组分的羟基自由基清除能力 羟基自由基是活性氧中最活泼的自由基,但是毒性最大,它几乎能与活细胞中任何分子发生反应,且反应速度极快,对机体破坏作用最大,因此羟基自由基清除率是反映药物抗氧化作用的重要指标[13]。由图7可知,5种多糖组分均具有羟基自由基清除能力,与多糖浓度在一定范围内呈正相关,质量浓度越高,其清除能力越强;同质量浓度壶瓶枣多糖的羟基自由基清除能力弱于Vc,顺序为ZJP-5>ZJP-4>ZJP-2>ZJP-3>ZJP-1,其中当ZJP-4和ZJP-5质量浓度为3.5 mg/mL时,其清除率分别为43.82%和53.31%。

图7 5种多糖组分的羟基自由基清除能力Fig.7 Scavenging capacity to hydroxyl radical of five fractions
3.4.3 5种多糖组分的超氧阴离子自由基清除能力 超氧阴离子自由基在氧化反应中扮演着非常重要的角色,是所有自由基的前身。在生物体内氧化还原反应中,有2%~5%的氧会产生超氧阴离子自由基,其毒性是机体发生氧中毒的主要原因,因此超氧阴离子自由基清除率也是反映药物抗氧化作用的重要指标之一[14]。由图8可知,5种多糖组分均具有超氧阴离子自由基清除能力,与多糖质量浓度在一定范围内呈正相关,质量浓度越高,其清除能力越强;同质量浓度壶瓶枣多糖的羟基自由基清除能力弱于Vc,顺序为ZJP-2>ZJP-5>ZJP-3>ZJP-1>ZJP-4,其中当ZJP-2和ZJP-5质量浓度为3.5 mg/mL时,其清除率分别为 46.12%和32.30%。
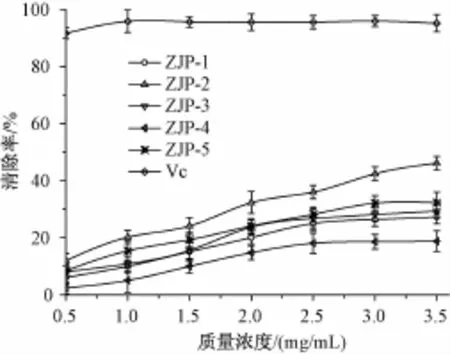
图8 5种多糖组分的超氧阴离子自由基清除能力Fig.8 Scavenging capacity to superoxide anion radical of five fractions
4 结论
壶瓶枣粗多糖经过D900型大孔吸附树脂柱层析后可得到Ⅰ、Ⅱ和Ⅲ三个部分,多糖回收率和脱蛋白率分别为86.75%和89.41%;全波长扫描后发现,三个部分多糖在可见光区几乎无吸收,在280 nm处也无吸收峰。综上可知,D900型大孔吸附树脂柱的分离纯化效果较为明显。
DEAE-纤维素-52层析柱对所得3个组分进行纯化,其中组分Ⅰ可得到一个中性多糖组分ZJP-1和一个酸性多糖组分ZJP-2,组分Ⅱ可得到一个中性多糖组分ZJP-3和一个酸性多糖组分ZJP-4,组分Ⅲ只能得到一个中性多糖组分ZJP-5。
对纯化后所得5种多糖组分进行抗氧化活性研究,以Vc作参照物。结果表明,多糖的抗氧化活性均弱于Vc,且5种多糖组分对DPPH自由基的清除能力均较弱;ZJP-2清除超氧阴离子自由基能力较强,当多糖质量浓度为3.5 mg/mL时,其清除率为46.12%;ZJP-4清除羟基自由基能力较强,当多糖质量浓度为3.5 mg/mL时,其清除率为43.82%;ZJP-5清除羟基自由基和超氧阴离子自由基能力都比较强,当多糖质量浓度为3.5 mg/m L时,其清除率分别为53.31%和32.30%。因此,ZJP-2、ZJP-4和ZJP-5的组成有必要做进一步分析,以确定其中活性多糖组分。
[1]冯新光,吕吉鸿,郭泽峰,等.中国不同产地红枣的组分分析与评价[J].中国酿造,2012,31(9):30-33.
[2]王 军,张宝善,陈锦屏.红枣营养成分及其功能的研究[J].食品研究与开发,2003,24(2):68-72.
[3]唐 洁.植物多糖生物活性功能的研究进展[J].食品研究与开发,2006,27(5):130-132.
[4]王雪姣,徐文清.地衣多糖的结构特征与生物活性[J].天津药学,2007,19(2):62-64.
[5]Li JW,Fan L P,Ding SD.Isolation,purifcation and structure of a new water-soluble polysaccharide from Zizyphus jujuba cv.Jinsixiaozao[J].Carbohydr Polym,2011,83(2):477-482.
[6]Bradford M M.A rapid and sensitivemethod for the quantitation ofmicrogram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(2):248-254.
[7]Wang D Y,Zhao Y,Jiao Y D,etal.Antioxidative and hepatoprotective effects of the polysaccharides from Zizyphus Jujuba cv.Shaanbeitanzao[J].Carbohydr Polym,2012,88(4):1453-1459.
[8]Wang B.Chemical characterization and ameliorating effect of polysaccharide from Chinese Jujuba on intestine oxidative injury by ischemia and reperfusion[J].Int J Biol Macromol,2011,48(3):386-391.
[9]Chang SC,Hsu B Y,Chen B H.Structural characterization of polysaccharides from Zizyphus jujuba and evaluation of antioxidant activity[J].Int J Biol Macromol,2010,47(4):445-453.
[10]罗艳玲,欧仕益.大孔树脂在食品活性成分分离中的应用[J].食品与机械,2005,21(5):81-83.
[11]王小梅,孙润广,张 静,等.两种方法提取的麦冬多糖结构及聚集行为的比较研究[J].电子显微学报,2013,32(1):54-61.
[12]田春莲,蒋凤开,文赤夫.飞龙掌血清除自由基活性的研究[J].食品工业科技,2011,32(11):106-108.
[13]郅 洁,李炳奇,廉宜君,等.沙枣多糖的提取及其抗氧化活性的研究[J].中成药,2009,31(5):796-798.
[14]丁宏伟,李志香,蔡云飞.微波辅助超声提取南瓜多糖及其抗氧化性研究[J].食品研究与开发,2013,34(1):35-39.
Purification of polysaccharides from Ziziphus Jujuba M ill.cv.Hupingzao and the antioxidant activities
ZHANG Yao-lei1, HUANG Li-xin1*, ZHANG Cai-hong1,2, XIE Pu-jun1, YOU Feng1
(1.Instituteof Chemical Industry of Forest Products,Chinese Academy of Forestry;National Engineering Laboratory for BiomassChemical Utilization;Key and Open Laboratory on Forest Chemical Engineering,State Forestry Administration;Key Laboratory of Biomass Energy and Material,Nanjing 210042,China;2.Institute of New Technology of Forestry,Chinese Academy of Forestry,Beijing 100091,China)
AIMTo study the isolation and purification of polysaccharides from Ziziphus Jujuba Mill.cv. Hupingzao and the antioxidantactivity of these polysaccharides.METHODSThe crude polysaccharideswere purified bymacroporous adsorption resin D900 and DEAE-cellulose-52 column chromatography,eluted with deionized water and 0~1 mol/L NaCl solution.The scavenging capacities of DPPH,hydroxy-and superoxide-free radicals were alsomeasured.RESULTSThree neutral polysaccharide fractions(ZJP-1,ZJP-3,ZJP-5)and two acidic polysaccharide fractions(ZJP-2,ZJP-4)were obtained.The five fractions all had scavenging capacity for DPPH. Among them,ZJP-5 was the strong scavenger for hydroxyl and superoxide anion radicals,ZJP-2 for superoxide anion radical,and ZJP-4 for hydroxyl radical.CONCLUSIONThemacroporous adsorption resin D900 and DEAE-cellulose-52 both have good purifying effect on polysaccharides,and the antioxidant activities of isolated five polysaccharides have different characteristics.
Ziziphus Jujuba Mill.cv.Hupingzao;polysaccharide;purification;antioxidant activity
R284.1
:A
:1001-1528(2015)06-1267-05
10.3969/j.issn.1001-1528.2015.06.023
2014-09-16
国家林业局948项目 (2012-4-12);中央级公益性科研院所基本科研业务费专项资金 (CAFINT2013C04)
张耀雷 (1989—),男,硕士,从事农林产品深加工研究工作。
*通信作者:黄立新 (1967—),男,博士,研究员,博士生导师,从事天然产物提取分离纯化及新型干燥技术研究。E-mail:l_x_ huang@163.com

