老年缺血性卒中住院患者他汀药物治疗短期预后及不良反应相关性研究
吴佳,吴硕琳,李菁晶,王琰,王春雪
随着我国老龄化进程逐步增快,高龄老年人(≥75岁)人口数目显著增加。高龄老年人群与其他年龄人群相比,缺血性卒中患病率、发病风险及复发风险更高,患病后死亡率和致残率也更大[1-4]。对此类人群缺血性卒中的防治工作显得格外重要。他汀类药物治疗是缺血性卒中二级预防的主要措施之一[5],其疗效也得到了广泛认可[6-7]。目前针对高龄缺血性卒中人群使用他汀类药物治疗的依从性、疗效及相关不良反应的研究鲜有报道。本研究以年龄为60~74岁的老年缺血性卒中患者为对照,旨在研究高龄(≥75岁)缺血性卒中患者他汀类药物治疗依从性、安全性及其与短期卒中预后的关系,为高龄缺血性卒中患者制订合理的调脂方案提供理论依据。
1 对象与方法
1.1 研究对象 于2012年1月~2013年12月间,连续入组首都医科大学附属北京天坛医院神经内科急性缺血性卒中住院患者。入选标准为:①患者年龄≥60岁;②符合中华医学会神经病学分会2010年中国急性缺血性脑卒中诊治指南[8];③发病14 d以内;④经计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)等检查证实;⑤发病前改良Rankin量表(modified Rankin Scale,mRS)评分≤4分;⑥签署知情同意书。排除标准为:①患恶性肿瘤、血液病或严重脏器功能损害或疾病;②发病前mRS评分=5分;③无症状性卒中;④伴有局灶或全脑症状的非脑血管病或脑血管病诊断不明确者;⑤既往有脑出血病史患者;⑥拒绝参与此项研究者。
1.2 数据收集
1.2.1 基线资料收集 入组患者依据年龄分为两组,分别为高龄组(≥75岁)和老龄组(60~74岁)。入院后收集患者人口学资料如性别、年龄、体重指数[(body mass index,BMI),计算公式为BMI=体重(kg)/身高2(m2)];询问患者的既往史如高血压(2008年《中国高血压防治指南》[9])、糖尿病(2013年《中国2型糖尿病防治指南》[10])、脂代谢紊乱(《2007年中国成人血脂异常防治指南》[11])、冠状动脉粥样硬化性心脏病(2013年《欧洲心脏病学会冠状动脉粥样硬化性心脏病诊治指南》[12])、心房颤动(2012年《欧洲心脏病学会心房颤动治疗更新指南》[13])、缺血性卒中(依据2010年《中国急性缺血性脑卒中诊治指南》[8])、周围血管病(2011年《美国心脏病学院基金会和美国心脏协会周围血管疾病诊断和治疗更新指南》[14])、吸烟史(判断标准为每天吸卷烟1支以上,连续或累计6个月)、饮酒史[标准为男性平均每周饮用白酒超过500 g(女性为350 g),持续5年以上]等基本信息;记录入院时化验的血脂各项指标如甘油三酯(triglyceride,TG)、总胆固醇(cholestrol,CHO)、高密度脂蛋白胆固醇(high-density lipoproteincholestrol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein-cholestrol,LDL-C)、载脂蛋白α1(Apoα1)、载脂蛋白β(Apoβ)及不良反应相关指标如谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、肌酸激酶(creatine kinase,CK);由高年资主治医师及以上资质的医师判断患者中国缺血性卒中亚型(Chinese ischemic stroke subclassification,CISS);分别采用mRS评分评估入院时卒中患者的功能,采用美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评估入院时患者神经功能缺损程度。
CISS分型包括大动脉粥样硬化型、心源性卒中、穿支动脉疾病、其他病因及不明原因[15]。
1.2.2 入院期间数据收集 记录患者他汀类药物的治疗情况,包括住院期间规律使用他汀药物情况,未使用、停用、出现他汀相关不良反应情况,以及他汀使用的剂量大小,分为高、中、低三类。规律使用他汀药物定义为他汀类药物连续服用≥7 d。高剂量定义为各类他汀药物说明中上限的剂量,包括阿托伐他汀80 mg、辛伐他汀80 mg、普伐他汀40 mg、瑞舒伐他汀20 mg等;低剂量定义为下限的剂量,包括阿托伐他汀10 mg、辛伐他汀10 mg、普伐他汀10 mg、瑞舒伐他汀5 mg等;中等剂量定义位于上、下限之间的剂量[16-17]。
患者入院后(14±3)d抽取患者空腹静脉血检测血脂及肝酶等各项指标。依据《他汀类药物防治缺血性卒中/短暂性脑缺血发作专家共识》,LDL-C达标定义为与入院前实验室检查相比,LDL-C下降≥50%或LDL-C水平<1.8 mmol/L[5]。
评估住院期间患者使用他汀药物后的不良反应,包括:①一般不良事件:包括变态反应、感觉异常皮疹/瘙痒等;②孤立性肝酶增高:轻度增高定义为患者入院(14±3)d测得转氨酶值在1~3倍正常值上限之内,显著增高定义为转氨酶大于3倍正常值上限[18-19];③肌酶增高:患者入院(14±3)d测得CK值>194.0 U/L;④骨骼肌肉不良事件:定义服用他汀药物后出现骨骼肌、关节疼痛或无力等症状,包括肌病(不伴CK升高)、肌炎(伴有CK升高)、横纹肌溶解症(CK值大于10倍正常值,出现肌红蛋白尿、尿色加深等症状)[20-21]。
患者出院前进行NIHSS测评,统计卒中好转率及卒中恶化率,纳入卒中结局。卒中恶化定义为出院NIHSS评分较入院NIHSS评分增加≥4分;卒中好转定义为出院NIHSS评分较入院NIHSS评分减少≥4分或者出院时NIHSS评分=0[22]。
1.2.3 卒中后3个月随访 对出院所有患者卒中发生后(90±7)d行电话随访,询问3个月期间他汀类药物使用情况(同1.2.2)并判断其卒中预后。卒中预后包括mRS评分、卒中复发、其他血管事件(非卒中类血管缺血事件:如心肌梗死等)及死亡。mRS≤2分定义为预后良好,mRS 3~5分定义为预后不良[23-24]。
1.3 统计学处理 运用SPSS 19.0软件建立数据库并进行统计分析。对计量资料进行正态性检验。符合正态分布的计量资料,用表示,并用独立样本t检验;非正态分布的计量资料用中位数(四分位数)表示,采用非参数检验。计数资料用例数(百分比)表示并采用χ2检验。以上检验均以P<0.05为标准认定有统计学意义。对单因素分析中有统计学意义的变量再进一步纳入Logistic回归分析模型,计算比值比(odds ratio,OR)和95%可信区间(confidence interval,CI)。
2 结果
2.1 基线信息 2012年1月~2013年12月期间入组患者为437例,失访12例,失访率2.7%,剩余425例患者纳入本研究。其中高龄组151例,平均年龄(79.90±3.72)岁;老龄组274例,平均年龄(66.59±4.17)岁。与老龄组相比,高龄组男性比例偏低;冠状动脉粥样硬化性心脏病、心房颤动及卒中病史比例偏高;吸烟比例、中重度饮酒史比例较低。实验室检查方面,TG浓度和HDL-C浓度偏低。CISS分型统计高龄组大动脉粥样硬化较低,而心源性卒中比例较高。肝酶等其余基线资料未见显著差异(表1)。
2.2 院内他汀药物使用、血脂指标及不良反应情况 高龄组和老龄组规律使用他汀药物比例分别为95.4%和96.0%,无显著差异(P=0.761)。
相较于老龄组,高龄组使用低剂量他汀比例高。未使用他汀药物比例及具体原因两组间无显著差异。(14±3)d复查实验室检查各项指标,高龄组HDL-C均值略高于老龄组,其AST中位数也略高于老龄组。其他指标及LDL-C达标率无显著差异。不良反应方面,高龄组和老龄组他汀相关不良反应分别有17例和19例,无显著差异;其中,高龄组和老龄组孤立性肝酶轻度升高各有17例,占比分别为11.3%和6.2%,无显著差异(P=0.066)(统计结果详见表2)。
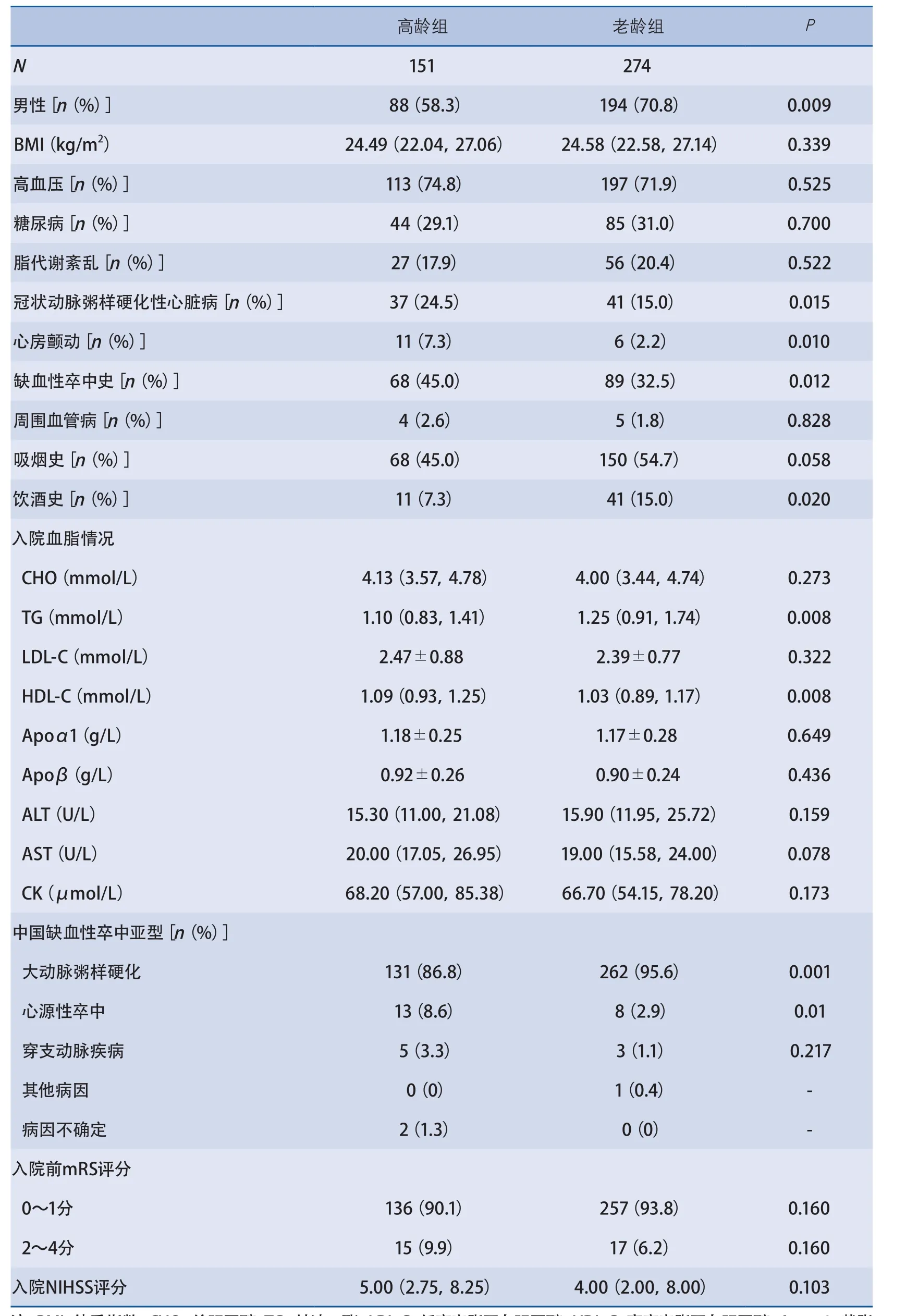
表1 高龄组和老龄组基线资料比较
2.3 随访期间他汀药物使用及卒中预后 住院期间高龄组院内死亡4例,老龄组死亡1例。对出院时存活的420例患者进行随访,两组患者他汀使用率较住院期间均有下降。与老龄组相比,高龄组规律使用他汀药物比例低。未使用他汀药物原因中,医师未处方例数分别为12例和11例,所占比为8.1%和4.0%,但无显著差异(P=0.076)。高龄组患者出院时NIHSS评分较老龄组偏高;卒中好转率及恶化率两组间均未见显著差异(统计结果详见表3)。
表2 不同年龄组住院期间使用他汀药物情况、(143)d复查实验室相关指标及他汀相关不良反应

表2 不同年龄组住院期间使用他汀药物情况、(143)d复查实验室相关指标及他汀相关不良反应
注:CHO:总胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;Apoα1:载脂蛋白α1;Apoβ:载脂蛋白β;ALT:谷丙转氨酶;AST:谷草转氨酶;CK:肌酸激酶
(90±7)d随访结果显示,高龄组3个月预后不良患者显著高于老龄组。随访期间出现卒中复发及其他血管事件患者高龄组与老龄组间无显著差异。从患者发病至卒中后3个月,共13例患者死亡,高龄组10例,老龄组3例,高龄组与老龄组患者相比,3个月总死亡数较高(统计结果详见表3)。
2.4 不同年龄组他汀药物使用情况与卒中预后的相关性分析 对高龄组、老龄组患者不同用药情况的卒中结局及他汀不良反应进一步研究发现,无论是老龄组还是高龄组,相较于未规律使用者,规律使用他汀药物的患者出院时卒中恶化比例均低,3个月预后不良发生比例均显著降低。规律使用他汀能够使老龄组卒中好转率增加,而不能使高龄组的卒中好转率增加;他汀不良反应方面,高龄组规律使用他汀药物较未规律使用孤立性肝酶升高比例明显升高,而老龄组未见显著性差异(统计结果详见表4)。
引入Logistic回归模型并对年龄和性别校正后显示,老龄组患者规律使用他汀治疗显著改善卒中好转率(OR2.379,P<0.05)、降低卒中恶化(OR0.135,P<0.05)及3个月不良预后(OR0.439,P<0.05);高龄患者中,规律使用他汀治疗可显著降低发生卒中恶化(OR0.092,P<0.05)和3个月卒中预后不良(OR0.539,P<0.05)情况;同时增加孤立性肝酶升高(OR1.04,P<0.05)比率。进一步调整了其他危险因素(高血压、糖尿病、卒中史、脂代谢紊乱、吸烟、入院mRS评分、肺部感染、卒中CISS分型)后,所得到的结论相同(统计结果详见表5)。

表3 随访期间不同年龄组他汀药物使用情况及卒中结局和预后
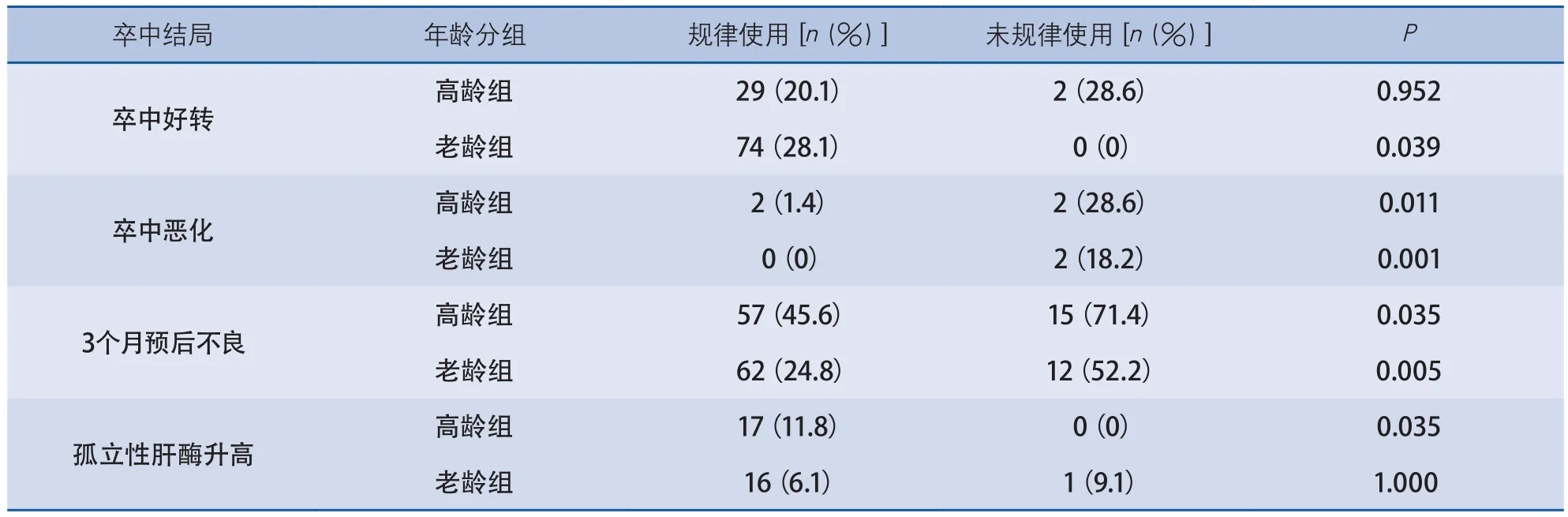
表4 不同年龄组他汀药物使用情况与卒中结局的关系
3 讨论
缺血性卒中目前已经成为我国人口死亡和致残的第一位原因[25-26]。高龄缺血性卒中患者具有发病率、复发风险、致残率、死亡率均高于其他年龄段患者的特点[3-4],因此,对高龄人群的缺血性卒中预防及治疗理应得到更多的重视。强化降低胆固醇水平预防卒中研究(the Stroke Prevention with Aggressive Reductions in Cholesterol Levels,SPARCL)对他汀类药物应用于卒中二级预防给予了重要的理论支持[27]。基于国内发布的《他汀类药物防治缺血性卒中/短暂性脑缺血发作专家共识》相关推荐,他汀药物已常规应用于缺血性卒中急性期治疗及一级、二级预防[5]。然而,目前在全球范围内关于高龄卒中患者他汀药物应用的相关研究较少,我国高龄缺血性卒中患者的他汀药物使用率、有效性、达标率、安全性及对预后的影响也鲜有报道。很多问题尚未阐明,在一定程度上阻碍了他汀药物治疗应用于高龄缺血性卒中患者的进程。本课题通过对北京天坛医院高龄缺血性卒中患者的他汀药物的院内及出院后使用情况,并对其短期预后及相关不良反应进行观察性研究,拟得出他汀药物使用对高龄卒中患者短期预后及安全性方面的相关证据,以便于更好地指导他汀药物应用于高龄卒中患者的临床实践。
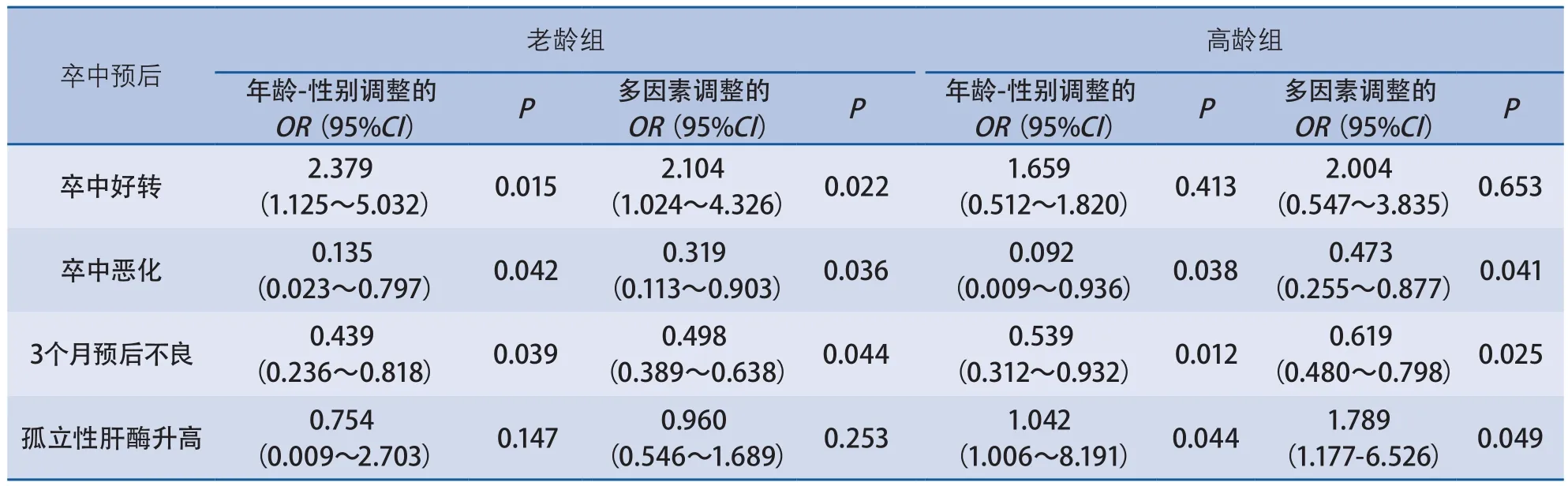
表5 规律使用他汀药物与卒中结局的多因素Logistic回归分析
国内外已有大量报道有关缺血性卒中的危险因素,如年龄、性别、种族及高血压、糖尿病、高脂血症、代谢综合征等[28]。而高龄老年缺血性卒中患者的危险因素与一般人群有所不同。本研究显示高龄组较老年组冠状动脉粥样硬化性心脏病比例偏高,心房颤动病史、卒中史比例偏高,甘油三酯偏低,饮酒史比例低,吸烟比例低,与既往文献报道相一致[3-4]。高龄组患者男性比例偏低,可能与高龄老年人口男性比例较低有关,在诊治高龄卒中患者时,应关注女性患者的生理特点和用药禁忌。
近年来,越来越多研究认为他汀类药物可以预防全身动脉粥样硬化病变进展,包括全面减少缺血性卒中、心肌梗死以及其他与动脉粥样硬化病变相关事件[29];2006年发表的SPARCL肯定了他汀药物在非心源性卒中和TIA二级预防中的重要作用,他汀强化治疗可降低卒中或TIA患者16%的再发卒中风险,降低35%主要冠状动脉事件风险[27]。新近发表的美国卒中二级预防指南扩大了缺血性卒中患者的适用范围[30]。本研究中高龄组和老龄组住院期间他汀规律使用率分别为95.4%、96.0%;卒中后(90±7)d该比例分别为85.0%和91.6%。从卒中患者院内他汀药物的使用情况已看出,他汀药物已作为针对不同病因分型卒中二级预防的重要治疗手段。而对他汀治疗剂量研究发现,高龄组他汀药物低剂量使用比例高,这可能由于主管医师考虑其年龄及可能带来的潜在不良反应及风险,因此给予谨慎的用量。
本研究在患者入院(14±3)d复查血脂相关指标,LDL-C水平在高龄组和老龄组均较入院基线水平明显下降,两组LDL-C达标率分别为74.5%和73.1%,无显著差异。Ovbiagele等的研究提示在卒中接受他汀治疗的患者中,LDL-C达标率仅为42%[31],本研究中两组LDL-C达标率均高于上述研究,与我院对强化他汀药物治疗指导意见[5,30]的积极实践密切相关。
对于高龄患者他汀药物安全性的研究,高龄组住院期间接受他汀治疗后孤立性肝酶轻度升高比例与老龄组相比,尽管未得出显著性差异,但已有升高趋势;随后分别对两组人群进一步分析发现,高龄组规律使用他汀药物的患者发生孤立性肝酶轻度升高的比例高于未规律使用他汀患者,在老龄组中并无类似结论。多因素Logistic回归分析也证实,孤立性肝酶轻度升高与高龄卒中患者规律使用他汀相关(OR1.789,P<0.05)。但根据以往研究报道,使用他汀药物引起的孤立性肝酶升高并不等同于肝功能损害[32],其转氨酶升高可能由多种因素参与其中[33]。国内《非酒精性肝病治疗指南》对于轻度肝酶升高且无明显肝功能不全的情况下可安全使用他汀类药物[34]。但对于高龄卒中患者使用他汀药物是否增加其肝损害或影响其功能预后有待于进一步研究证实。
高龄组和老年组出院后对他汀药物治疗依从性均有下降,且高龄组较老年组出院后依从性更低(85.0%vs91.6%,P=0.039)。未规律使用他汀药物的原因主要为主管医师未开具处方,这可能与主管医师考虑到他汀药物可能对高龄卒中患者带来潜在不良反应有关。也有研究发现女性对药物的依从性较男性差[35-37],表明在高龄卒中患者中,女性比例较高可能是他汀药物依从性差的潜在原因之一。对于他汀药物依从性与性别的相关性研究有待于进一步探讨。
高龄组相较于老龄组3个月预后不良、总死亡率均有升高,提示高龄老年人卒中结局差。多项研究均证明年龄是预后不良和卒中后死亡的预测因素[38-39],本研究与以往研究结果基本一致。对两组患者分别根据不同他汀使用情况与卒中预后进一步分析,无论是老龄组还是高龄组,相较于未规律用药者,规律使用他汀药物的患者卒中恶化比例、3个月预后不良发生比例均显著降低。规律使用他汀能够使普通老龄组卒中好转率增加,但不能增加高龄组的卒中好转率。一则纳入113 148例患者27项研究的系统回顾和Meta分析得出,卒中患者发病时即实行他汀治疗与90 d时功能转归相关(OR1.41,95%CI1.29~1.56,P<0.001)[6]提示他汀药物用于卒中二级预防能改善其短期预后,本研究与上述结论相符。对高龄和老龄卒中患者而言,规律使用他汀类药物均是短期不良预后的保护性因素。因此,本研究对于高龄老年卒中患者使用他汀药物治疗具有较好的指导意义。
本研究的不足之处在于,因研究人群为单中心,具有一定的局限性,不能代表国内其他医院的治疗现况;高龄卒中患者往往伴有其他基础性疾病如糖尿病、高血压、冠状动脉粥样硬化性心脏病等,临床用药较为复杂多元,本研究关注他汀类药物的使用,运用单因素分析和Logistic回归分析仅能排除部分其他药物使用的混杂因素。
1 Koton S, Schneider AL, Rosamond WD, et al. Stroke incidence and mortality trends in US communities,1987 to 2011[J]. JAMA, 2014, 312:259-268.
2 Heuschmann PU, Di Carlo A, Bejot Y, et al. Incidence of stroke in Europe at the beginning of the 21st century[J]. Stroke, 2009, 40:1557-1563.
3 Bejot Y, Rouaud O, Jacquin A, et al. Stroke in the very old:incidence, risk factors, clinical features, outcomes and access to resources--a 22-year population-based study[J]. Cerebrovasc Dis, 2010, 29:111-121.
4 Lee M, Huang WY, Weng HH, et al, First-ever ischemic stroke in very old Asians:clinical features, stroke subtypes, risk factors and outcome[J]. Eur Neurol,2007, 58:44-48.
5 他汀类药物防治缺血性卒中/短暂性脑缺血发作专家共识组. 他汀类药物防治缺血性卒中/短暂性脑缺血发作专家共识[J]. 中国卒中杂志, 2013, 8:565-575.
6 Ni CD, Asplund K, Asberg S, et al. Statin therapy and outcome after ischemic stroke:systematic review and meta-analysis of observational studies and randomized trials[J]. Stroke, 2013, 44:448-456.
7 Amarenco P, Labreuche J, Lavallee P, et al. Statins in stroke prevention and carotid atherosclerosis:systematic review and up-to-date meta-analysis[J]. Stroke, 2004,35:2902-2909.
8 中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组. 中国急性缺血性脑卒中诊治指南2010[J]. 中华神经科杂志, 2010, 43:146-153.
9 刘力生, 王文, 姚崇华, 中国高血压防治指南(2009年基层版)[J]. 中华高血压杂志, 2010, 18:11-30.
10 中华医学会糖尿病学分会. 中国2型套尿病防治指南(2013年版)[J]. 中华糖尿病杂志, 2014, 6:447-498.
11 中国成人血脂异常防治指南制订联合委员会. 中国成人血脂异常防治指南[J]. 中华心血管病杂志,2007(05):390-419.
12 Montalescot G, SechtemU, Achenbach S, et al. 2013 ESC guidelines on the management of stable coronary artery disease:the Task Force on the management of stable coronary artery disease of the European Society of Cardiology[J]. Eur Heart J, 2013, 34:2949-3003.
13 Camm AJ, Lip GY, De Caterina R, et al. 2012 focused update of the ESC guidelines for the management of atrial fibrillation:an update of the 2010 ESC guidelines for the management of atrial fibrillation--developed with the special contribution of the European Heart Rhythm Association[J]. Europace, 2012, 14:1385-1413.
14 Rooke TW, Hirsch AT, Misra S, et al. 2011 ACCF/AHA focused update of the guideline for the management of patients with peripheral artery disease (updating the 2005 guideline):a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines:developed in collaboration with the Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society for Vascular Medicine, and Society for Vascular Surgery[J]. Catheter Cardiovasc Interv, 2012, 79:501-531.
15 Gao S, Wang YJ, Xu AD, et al. Chinese ischemic stroke subclassification[J]. Front Neurol, 2011, 2:6.
16 Preiss D, Seshasai SR, Welsh P, et al. Risk of incident diabetes with intensive-dose compared with moderatedose statin therapy:a meta-analysis[J]. JAMA, 2011,305:2556-2564.
17 Paraskevas KI, Mikhailidis DP, Veith FJ. Optimal statin type and dosage for vascular patients[J]. J Vasc Surg, 2011, 53:837-844.
18 Bjornsson E, Jacobsen EI, Kalaitzakis E.Hepatotoxicity associated with statins:reports of idiosyncratic liver injury post-marketing[J]. J Hepatol,2012, 56:374-380.
19 Aithal GP, Watkins PB, Andrade RJ, et al. Case definition and phenotype standardization in drug-induced liver injury[J]. Clin Pharmacol Ther, 2011,89:806-815.
20 Rosenson RS, Baker SK, Jacobson TA, et al. An assessment by the Statin Muscle Safety Task Force:2014 update[J]. J Clin Lipidol, 2014, 8(3 Suppl):S58-S71.
21 Thompson PD, Clarkson PM, Rosenson RS. An assessment of statin safety by muscle experts[J]. Am J Cardiol, 2006, 97(8A):69C-76C.
22 Kamouchi M, Matsuki T, Hata J, et al. Prestroke glycemic control is associated with the functional outcome in acute ischemic stroke:the Fukuoka Stroke Registry[J]. Stroke, 2011, 42:2788-2794.
23 Uyttenboogaart M, Stewart RE, Vroomen PC, et al.Optimizing cutoff scores for the Barthel index and the modified Rankin scale for defining outcome in acute stroke trials[J]. Stroke, 2005, 36:1984-1987.
24 Hacke W, Albers G, Al-Rawi Y, et al. The Desmoteplase in Acute Ischemic Stroke Trial (DIAS):a phase II MRI-based 9-hour window acute stroke thrombolysis trial with intravenous desmoteplase[J]. Stroke, 2005, 36:66-73.
25 Yang G, Wang Y, Zeng Y, et al. Rapid health transition in China, 1990-2010:findings from the Global Burden of Disease Study 2010[J]. Lancet, 2013, 381:1987-2015.
26 Wu X, Zhu B, Fu L, et al. Prevalence, incidence, and mortality of stroke in the Chinese island populations:a systematic review[J]. PLoS One, 2013, 8:e78629.
27 Amarenco P, Bogousslavsky J, Callahan AR, et al. High-dose atorvastatin after stroke or transient ischemic attack[J]. N Engl J Med, 2006, 355:549-559.
28 O'Donnell MJ, Xavier D, Liu L, et al. Risk factors for ischaemic and intracerebral haemorrhagic stroke in 22 countries (the INTERSTROKE study):a case-control study[J]. Lancet, 2010, 376:112-123.
29 Baigent C, Keech A, Kearney PM, et al. Efficacy and safety of cholesterol-lowering treatment:prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins[J]. Lancet, 2005, 366:1267-1278.
30 Furie KL, Kasner SE, Adams RJ, et al. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2011, 42:227-276.
31 Ovbiagele B, Saver JL, Bang H, et al. Statin treatment and adherence to national cholesterol guidelines after ischemic stroke[J]. Neurology, 2006, 66:1164-1170.
32 Cohen DE, Anania FA, Chalasani N. An assessment of statin safety by hepatologists[J]. Am J Cardiol, 2006,97(8A):77C-81C.
33 Mukai M, Ozasa K, Hayashi K, et al. Various S-GOT/S-GPT ratios in nonviral liver disorders and related physical conditions and life-style[J]. Dig Dis Sci, 2002,47:549-555.
34 范建高. 中国非酒精性脂肪性肝病诊疗指南(2010年修订版)[J]. 中国医学前沿杂志(电子版), 2012(07):4-10.
35 Paquet M, Pilon D, Tetrault JP, et al. Protective vascular treatment of patients with peripheral arterial disease:guideline adherence according to year, age and gender[J]. Can J Public Health, 2010, 101:96-100.
36 Castberg I, Westin AA, Spigset O. Does level of care, sex, age, or choice of drug influence adherence to treatment with antipsychotics?[J] J Clin Psychopharmacol, 2009, 29:415-420.
37 De Schryver EL, van Gijn J, Kappelle LJ, et al. Nonadherence to aspirin or oral anticoagulants in secondary prevention after ischaemic stroke[J]. J Neurol, 2005,252:1316-1321.
38 Weimar C, Ziegler A, Konig IR, et al. Predicting functional outcome and survival after acute ischemic stroke[J]. J Neurol, 2002, 249:888-895.
39 Heuschmann PU, Kolominsky-Rabas PL, Misselwitz B, et al. Predictors of in-hospital mortality and attributable risks of death after ischemic stroke:the German Stroke Registers Study Group[J]. Arch Intern Med, 2004, 164:1761-1768.

