白内障超声乳化吸除术中灌注水流方向对角膜内皮的影响
杨晓岗,汪 玲,马 强,高 伟(西安市第一医院眼科,西安 710002)
随着白内障超声乳化吸除术技术的逐步普及,如何减少术中角膜内皮的损失,降低术后角膜水肿的发生率越来越受到广大眼科医师的重视。角膜水肿是白内障超声乳化吸除术后的常见并发症,尽管超声乳化手术设备日趋完善,手术水平不断提高,但手术对角膜内皮细胞的损伤仍难以避免。角膜内皮受损使其失去液体屏障和主动液泵功能,引起角膜基质和上皮下水肿,角膜透明性下降,当内皮细胞损伤达到一定程度时,角膜内皮功能将失代偿,最终导致大泡性角膜病变而影响手术效果[1]。根据相关研究表明[2],术后角膜内皮无法完全恢复至术前水平。因此,认真做好术前的评估工作,尤其是术前检查术眼的角膜内皮细胞密度和六角形细胞密度[3],改进术中的操作方法对于预防和减少术后的角膜水肿有至关重要的意义。
1 材料和方法
1.1 材料
本研究选取我院2015-01~2015-05的80例单纯白内障患者,其中男性52例,女性28例,年龄介于65-75岁之间,根据Emery及Little分级标准白内障核分级均为Ⅲ级。
1.2 方法
1.2.1 手术方法 手术均由同一位操作熟练的手术者完成,术中使用infiniti超乳仪(Alcon公司)。术前30 min复方托吡卡胺滴眼液散瞳,盐酸奥布卡因滴眼液点术眼,做3次表面麻醉。常规消毒、铺巾。3.2 mm刀作上方11点位透明角膜切口,15°穿刺刀作3点位角膜缘辅助切口。前房内注入黏弹剂(爱维),以撕囊镊连续环形撕囊,行水分离。双手协作劈核,超声乳化探头将晶状体核乳化后吸除,直注吸探头注吸晶状体皮质。作后囊膜抛光后,囊袋内注入黏弹剂,植入人工晶状体,使之位于囊袋内。抽吸黏弹剂,水密形成前房。术毕结膜囊内涂妥布霉素地塞米松眼膏,包扎术眼。术中超声能量统一设定为40%,负压为350 mmHg,流速为35 ml/min,灌注瓶高度为90 cm。I/A过程中负压为500 mmHg,流速为30 ml/min,灌注瓶高度为80 cm。Polish过程中负压为20 mmHg,流速为10 ml/min,灌注瓶高度为80 cm。为术中抽吸能量及负压根据实际情况和手术进程通过脚踏做相应调整[4]。眼内操作时间严格控制在10 min以内,分别记录术中累积超声乳化能量(cumulative dissipated energy,CDE)和有效超声乳化时间(phaco time,PT)[5]。术毕记录两组的灌注时间(perfusion time,PT)。
1.2.2 分组 根据术中超声乳化探头和注吸探头(直头)两侧灌注液水流方向与虹膜平面的夹角大小分为两组。A组:术中超声探头和直注吸探头灌注水流方向与虹膜平面夹角<45°;B组:术中超声探头和直注吸探头灌注水流方向与虹膜平面夹角持续或多次出现过≥45°的情况。其中术中严格保持灌注水流方向与虹膜平面平行和完全垂直的的病例做单独标注(其中灌注水流方向与虹膜平面的夹角通过超声探头的楔形斜面和直注吸探头的注吸口来判断,因灌注水流方向与超声探头楔形斜面以及直注吸口是垂直的关系)。
1.2.3 术前及术后观察 术前用非接触式角膜内皮镜检查并记录每一位患者术眼的中央角膜内皮六角形细胞密度。术后第1天,开放点眼(妥布霉素地塞米松滴眼液+普拉洛芬滴眼液,点眼,4次/d),裂隙灯观察角膜水肿情况,如有角膜水肿发生则连续观察至角膜水肿消退为止,并记录水肿的消退时间。术后2周,患者复诊时,应用同一台非接触式角膜内皮镜再次检查并记录术眼的中央角膜内皮六角形细胞密度。
1.2.4 角膜水肿的分级 0级为角膜透明无水肿;1级为角膜局限性薄雾状水肿,角膜内皮面光滑,虹膜纹理尚清晰可见;2级为角膜浅灰色水肿,角膜内皮面粗糙,虹膜纹理模糊;3级为角膜弥漫性灰白色水肿,角膜内皮面呈龟裂状,虹膜纹理窥视不清;4级为角膜乳白色水肿,眼内结构窥视不清[2]。
1.3 统计学分析
应用SPSS 19.0统计分析软件分析数据,评价术后两组角膜水肿程度应用两独立样本的非参数检验。两组术前和术后中央角膜内皮六角形细胞密度比较采用两因素重复测量资料的方差分析。术中两组累积超声乳化能量和有效时间以及术中灌注时间的比较应用两独立样本均数的t检验。
2 结果
80例患者(眼)的手术均顺利完成,满足A组条件的有46例,满足B组条件的34例,其中A组术中严格使灌注水流方向与虹膜平面呈水平的为9例,术后均未出现角膜水肿;B组术中持续或多次出现灌注水流与虹膜平面呈接近垂直方向情况的为7例,其中有5例出现角膜水肿。
两组患者出现角膜水肿的情况见表1。A组46只术眼有9例出现1级角膜水肿,1例出现2级角膜水肿。B组34例术眼有12例出现1级角膜水肿,5例出现2级角膜水肿。应用两独立样本的非参数检验,认为两组术后角膜水肿程度存在统计学差异(Z=-5.012,P=0.000)。
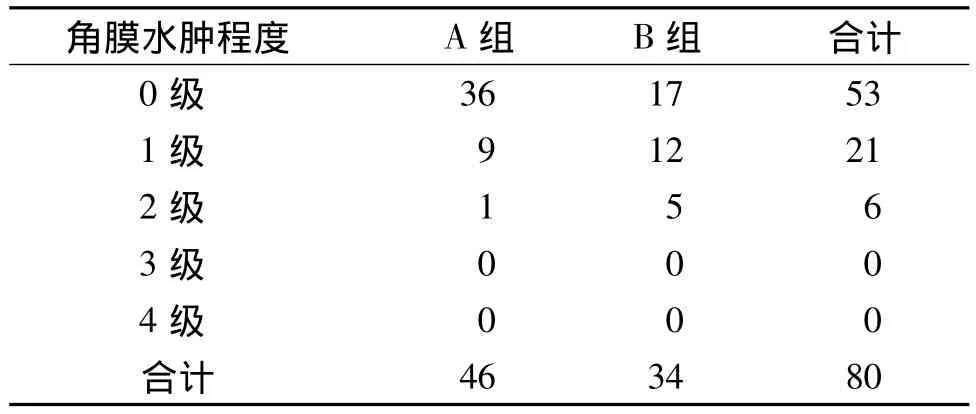
表1 术后两组角膜发生角膜水肿的程度比较Table 1 The degree of corneal edema after surgery in two groups
两组术前的中央角膜内皮六角形细胞密度比较无统计学差异,术后B组中央角膜内皮六角形细胞密度明显低于A组(P<0.001,见表2)。两组的有效超声乳化能量(CDE)和有效超声乳化时间(PT)比较无明显统计学差异(见表3)。两组的灌注时间(PT)比较也无统计学差异(见表3)。
表2 术后两组中央角膜六角形内皮细胞密度(±s,个/mm2)Table 2 Corneal endothelial cell density in the two groups after surgery(±s,/mm2)
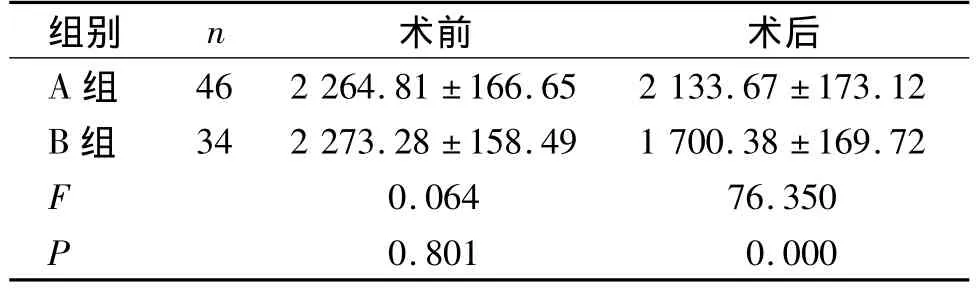
表2 术后两组中央角膜六角形内皮细胞密度(±s,个/mm2)Table 2 Corneal endothelial cell density in the two groups after surgery(±s,/mm2)
组别 n 术前 术后A组46 2 264.81 ±166.65 2 133.67 ±173.12 B 组 34 2 273.28 ±158.49 1 700.38 ±169.72 F 0.064 76.350 P 0.801 0.000
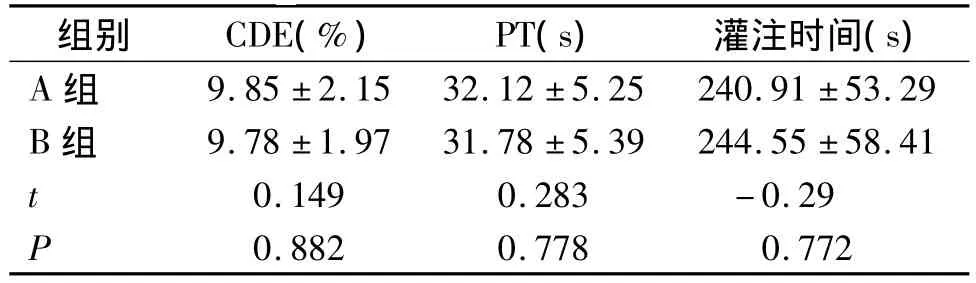
表3 术中两组累积超声乳化能量,超声乳化时间和灌注时间比较Table 3 Cumulative dissipated energy,phaco time,and perfusion time during the operation in two groups
3 讨论
超声乳化白内障吸除术后的角膜水肿是影响患者视力恢复的常见并发症,如何减少术中操作对角膜内皮细胞的损伤一直是眼科手术医师追求的目标。众所周知,超声乳化白内障吸除术本身,术中对角膜内皮的损伤是不可避免的[6,7],其中超声乳化手术造成角膜内皮细胞受损的主要原因有:①超声能量对角膜细胞的热灼伤。②手术器械、核碎块及人工晶状体刮蹭角膜内皮造成的机械损伤。③灌注液的大量快速持续冲洗对角膜内皮细胞的物理性以及化学性损伤。④超声探头高频振动对角膜内皮的震荡影响[8]。多年来,通过不断改进手术操作方式、手术器械、灌注液和术中使用的黏弹剂[9-11],同时在术前严格的筛选病例后,我们已经有效地降低了术后角膜水肿的发病率,但是术后仍有相当一部分患者发生了不同程度的角膜水肿。排除了术前部分患者因其角膜内皮数量过少,缺乏修复补偿能力的因素[12]以及术中的不当操作之后,也许术中超声探头以及注吸探头的灌注水流方向是一个被我们所忽略的重要因素。
一直以来,我们始终强调超声乳化白内障吸除术的操作规范,要求超声探头尽量保持于瞳孔区中央在囊袋内或虹膜水平面超声碎核[13],避免主动追逐晶状体核块,从而减少手术并发症的发生,这一方面是出于保护晶状体后囊膜及悬韧带的完整性的考虑,另一方面,如果主动用超声探头追逐核块,不可避免的会出现位于超声探头两侧灌注水流方向出现较大角度的偏转,甚至出现垂直冲涮角膜内皮的情况发生,如此多次反复或持续冲刷角膜内皮,必然会对角膜内皮细胞造成较大的机械性损伤。通过上述临床实验证实,在术中超声探头及直注吸探头出现较大角度偏转,致使灌注水流方向与虹膜平面夹角持续或多次出现过≥45°的情况的病例,术后角膜水肿的程度和例数较多,两组之间存在统计学差异。其中术中多次或持续出现灌注水流方向与虹膜平面呈接近垂直方向情况的7例病例,术后有5例出现不同程度的角膜水肿。术后待术眼的角膜水肿完全消退后,再次检测中央角膜内皮六角形细胞密度,发现A组和B组之间存在明显的统计学差异。由此可知,在排除了其余已知的可能对角膜内皮造成损伤的因素后,术中灌注水流对角膜内皮细胞的冲刷性损伤是很明显的。再者,探头出现较大偏转的时候,其灌注水流对于晶状体后囊的冲击也较为明显,对于特殊病例,如高度近视、眼外伤、高龄等晶状体后囊膜及悬韧带较为脆弱的患者会增加相应并发症发生的概率[13]。
由此可知,在排除了如术中超声能量、灌注时间、操作方式、患者自身因素等诸多可能引起术后角膜内皮细胞损伤从而发生角膜水肿的因素之后,我们可以得知,术中严格规范控制超声探头及注吸探头的方向,即严格控制其两侧灌注水流的方向对于减少超声乳化白内障吸除术后角膜水肿的发生有极其重要的意义,需在临床操作中引起关注。
[1]Zetterstrom C,Laurell CG.Comparison of endothelial cell loss and phacoemulsification energy during endocapsular phacoemulsification surgery[J].J Cataract Refract Surg,1995,21(1):55-58.
[2]谢立信,姚瞻,黄钰森,等.超声乳化白内障吸除术后角膜内皮细胞损伤和修复的研究[J].中华眼科杂志,2004,40(2):90-93.
[3] 刘家琦,李凤鸣.实用眼科学[M].3版.北京:人民卫生出版社,2012:677.
[4]谢田华,栾兰,禹倩倩,等.白内障超声乳化术后角膜水肿的观察[J].中国实用眼科杂志,2013,31(8):978-981.
[5]梅媚,赵军民,孟云.两种模式下的晶状体超声乳化吸出术对比研究[J].眼外伤职业眼病杂志,2009,31(10):752-755.
[6]Vargas LG,Holzer MP,Solomon KD,et al.Endothelial cell integrity after phacoemulsification with 2 different handpieces[J].J Cataract Refract Surg,2004,30:478-482.
[7]Baradaran-Rafii A,Rahmati-Kamel M,Eslani M,et al.Effect of hydrodynamic parameters on corneal endothelial cell loss after phacoemulsification[J].J Cataract Refract Surg,2009,35(4):732-737.
[8]吴峥峥,瞿佳,樊映川.白内障超声乳化术对角膜内皮细胞的影响[J].国际眼科纵览,2006,30(4):262-265.
[9]Peck CMC,Joos ZP,Zaugg BE,et al.Comparison of the corneal endothelial protective effects of Healon-D and Viscoat[J].Clin Experiment Ophthalmol,2009,37(4):397-401.
[10]Storr-Paulsen A,Norregaard JC,Ahmed S,et al.Endothelial cell damage after cataract surgery:Divide-and-conquer versus phacochop technique[J].J Cataract Refract Surg,2008,34(6):996-1000.
[11]姜宏钧,罗清礼,谢培英.BSS与LR对角膜内皮影响的评价[J].眼外伤职业眼病杂志,2003,25(8):533-535.
[12]庞旭,彭秀军.低密度角膜内皮细胞白内障的超声乳化术效果分析[J].中华眼外伤职业眼病杂志,2011,33(2):109-111.
[13] 李凤鸣,谢立信.中华眼科学[M].3版.北京:人民卫生出版社,2014:1576.

