毛细管电泳法测定螺内酯片剂中螺内酯的含量
于海霞,李 露,马慧芬,张红芬,陈安家(山西医科大学细胞生理学省部共建教育部重点实验室,太原03000;山西医科大学药学院;通讯作者,E-mail:chenanjia888@63.com;共同通讯作者,E-mail:zhanghf_007@6.com)
螺内酯片是一种弱的保钾利尿药,主要用于水肿性疾病、高血压、原发性醛固酮增多症、低钾血症的预防等。其主要成分螺内酯的化学结构与醛固酮相似,可与醛固酮竞争远曲小管及集合管细胞质内的醛固酮受体,进而影响醛固酮和受体结合,从而阻碍醛固酮诱导蛋白的合成,抑制K+-Na+交换,使钾的排出减少,可起到保钾利尿作用[1]。
螺内酯片的主要成分螺内酯又名安体舒通、螺旋内酯,分子式为C24H32O4S,为白色或类白色细微结晶性粉末,无臭或有轻微硫醇臭,微有苦味。不溶于水,溶于乙醇,易溶于苯或醋酸乙酯,极易溶于氯仿,熔点 207-208 ℃,其结构如图 1[2]。
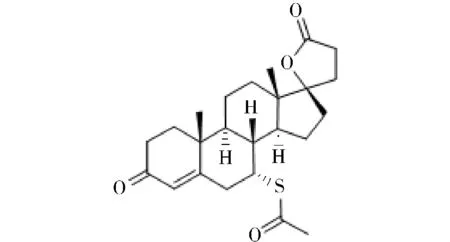
图1 螺内酯的化学结构Figure 1 Chemical structure of spironolactone
通过系统地查阅国内外相关资料发现,目前文献报道的螺内酯含量测定方法多采用 HPLC 法[2,3],尚未见用毛细管电泳法对螺内酯片中螺内酯进行含量测定的相关报道。考虑到毛细管电泳技术在药物分析方面具有高效、快速、分离效能高、进样量少、污染小及应用越来越广泛等优点[4],本文采用毛细管电泳法对市售螺内酯片中螺内酯进行含量测定。
1 仪器与试剂
无水甲醇和乙腈均为分析纯,十六烷基三甲基溴化铵(CTAB),二水磷酸二氢钠,超纯水,螺内酯片(浙江杭州民生药业有限公司,批号:T14J048、T10J504;上海信谊药厂有限公司,批号:046140702),螺内酯对照品(中国食品药品检定研究院)。P/ACE MDQ贝克曼库尔特毛细管电泳仪[贝克曼库尔特商贸(中国)有限公司],SB-120DT超声波清洗机(宁波新芝生物科技股份有限公司),PHS-3G型PH计(上海仪电科学仪器股份有限公司),FA2004电子天平(上海衡平仪器仪表厂);
2 方法与结果
2.1 样品溶解性的考察
螺内酯属于内酯类,不溶于水,易溶于有机溶剂,故溶解时用甲醇而不能用水作为溶剂。实验采用无水甲醇20 ml溶解螺内酯片后用pH 6.5浓度为0.02 mol/L的磷酸盐缓冲液定容至100 ml,溶液无混浊;若供试品溶液中不加上述缓冲液,峰拖尾严重。故实验选择使用无水甲醇20 ml溶解螺内酯片后用 pH 6.5浓度为0.02 mol/L的磷酸盐缓冲液稀释定容至100 ml,摇匀后静置,待淀粉等辅料沉淀后样品溶液澄清透明。每次进样前吸取上清液并用0.45 μm 微孔滤膜过滤。
2.2 溶液的配制
2.2.1 缓冲溶液的配制 精密称取二水磷酸二氢钠适量,配制成浓度为0.20 mol/L的储备液。取适量磷酸盐储备液加入适量CTAB及乙腈配制成含0.004 mmol/L CTAB、20% 乙腈及 0.020 mol/L 磷酸二氢钠的磷酸盐缓冲液,摇匀,用NaOH调节pH至6.5,即得所需电泳缓冲液Ⅰ。量取适量储备液加水配制成浓度为0.020 mol/L磷酸盐缓冲液,用NaOH调pH至6.5,得到用于稀释样品和对照品的缓冲液Ⅱ。
2.2.2 对照品溶液的配制 精密称取螺内酯对照品适量,用少量无水甲醇溶解后,转移至10 ml容量瓶中,继续用无水甲醇稀释至刻度,摇匀,配制得到0.54 mg/ml的溶液作为螺内酯储备液。精确量取一定量储备液于容量瓶中,加入pH 6.5的缓冲液Ⅱ,定容,摇匀,得20 μg/ml的对照品溶液。
2.2.3 供试品溶液的配制 每个批号的螺内酯分别取20片,精密称定,研成粉末,精密称取适量(约相当于螺内酯50 mg),置于50 ml烧杯中,加入无水甲醇20 ml,超声30 min使样品完全溶解,转移到100 ml容量瓶中,加pH 6.5的缓冲液Ⅱ至刻度,摇匀,得供试品储备液。精密量取5 ml储备液于25 ml容量瓶中,加入pH 6.5缓冲液Ⅱ,定容,即得供试品溶液。
2.3 电泳条件的选择
2.3.1 缓冲液浓度的选择 离子强度可以影响样品的迁移速度、电流强度及峰宽,离子强度越大,迁移速度越小,电流越大。而电流增大会使产热增加,引起焦耳热效应使谱带展宽。离子强度过低会使扩散增加,也会导致峰展宽,而且电泳能力降低;过低的离子强度也会使pH的稳定性下降。缓冲液的浓度直接影响离子强度,所以要选择合适的缓冲液浓度。经试验优化后,以浓度为0.020 mol/L的缓冲液最佳。不同浓度缓冲液时电泳峰形见图2。
2.3.2 缓冲液pH的选择 缓冲溶液pH可以改变电渗流从而影响样品的迁移时间,还可以影响样品解离度进而影响检测灵敏度,所以缓冲溶液的pH是影响电泳分析的重要因素[4]。故分析时要根据样品的性质选择pH。本文考察了pH范围在4.5-9.0的磷酸二氢钠(0.020 mol/L)缓冲液,结果表明:样品在pH 6.5时峰形最好,且迁移时间适中。当pH<6.5或>6.5时峰拖尾严重,故实验选择pH为6.5的缓冲液。不同pH缓冲液时的峰形见图3。
2.3.3 改性剂的选择 有机溶液加入到缓冲液中可以改变电渗流、改善峰形。采用pH 6.5,浓度为0.020 mol/L的缓冲液时峰有轻微的拖尾,经过试验发现在缓冲液中加入20%乙腈可以明显改善拖尾,但不能改善前沿峰。十六烷基三甲基溴化铵(CTAB)是一种阳离子表面活性剂,它可以降低样品吸附从而改善拖尾,并且可以控制电渗流以提高重现性。但是CTAB的浓度要在临界胶束浓度(9.2 ×10-4mol/L)以下[5-9],通过实验发现浓度为0.004 mmol/L时效果最佳。
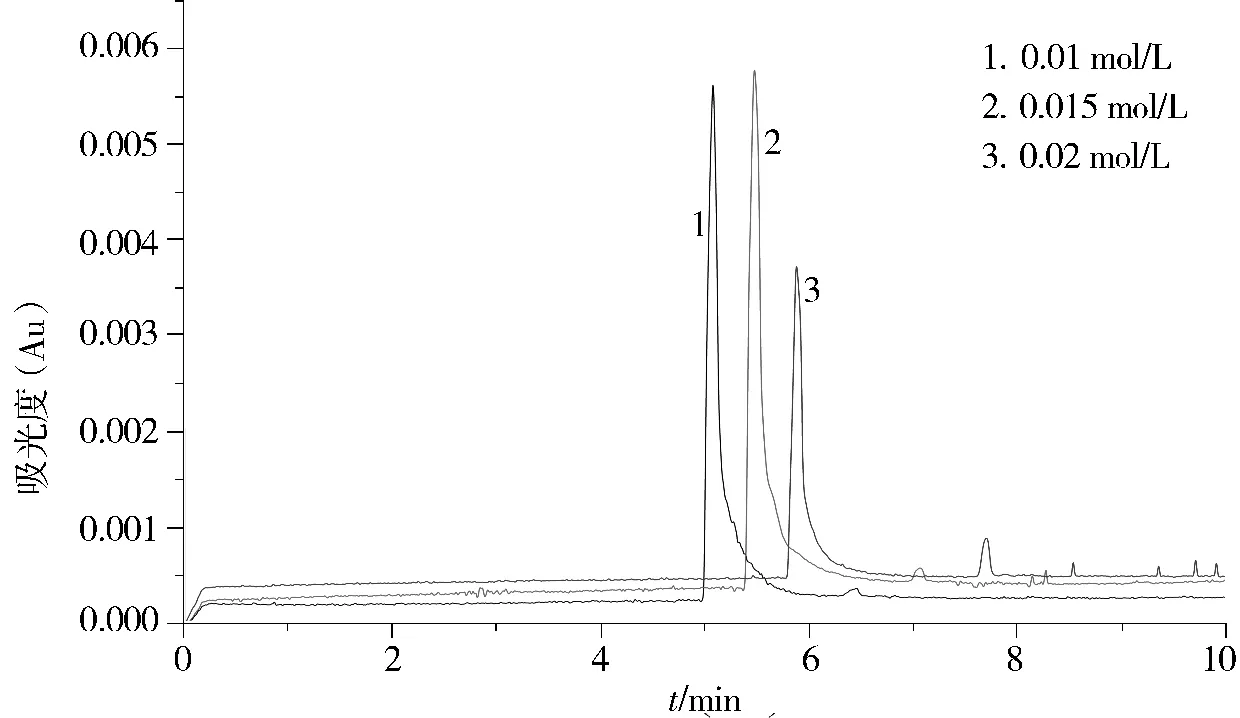
图2 不同浓度缓冲液电泳图谱对比Figure 2 Electrophoretogram of different concentrations of buffer solutions
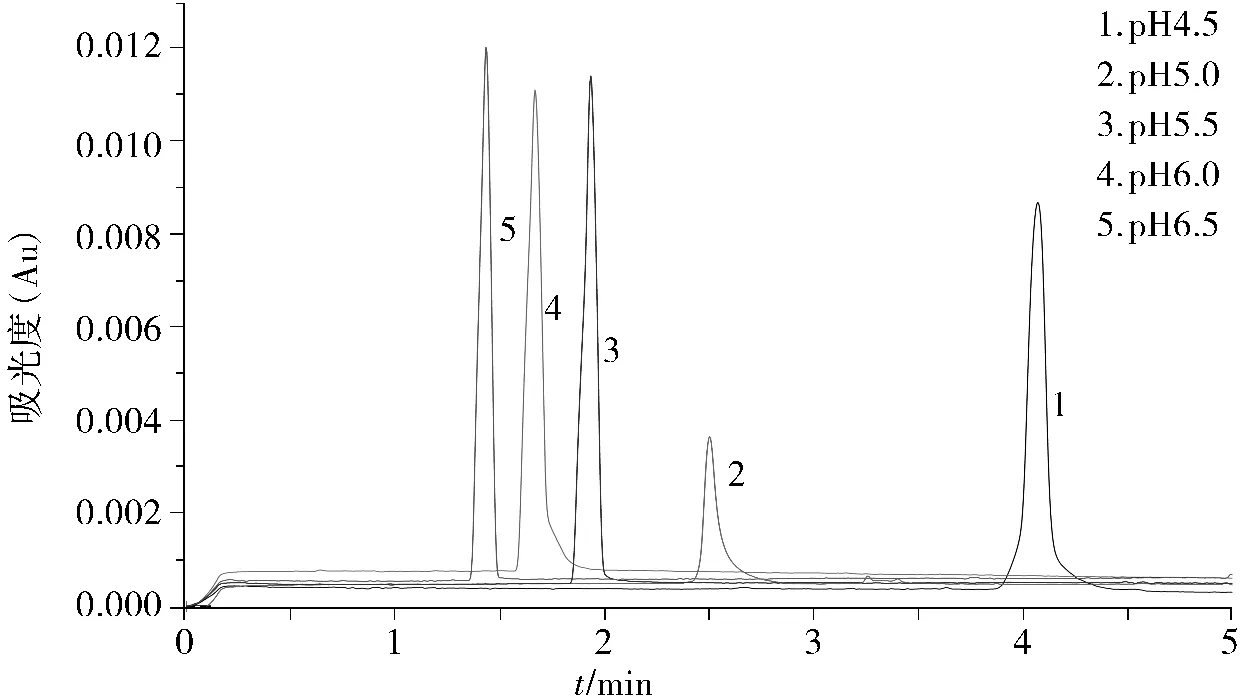
图3 不同pH缓冲液电泳图谱对比Figure 3 Electrophoretogram of different pH buffer solutions
2.3.4 波长的选择 应用二极管阵列检测器对螺内酯进行在线检测,在190-400 nm范围内进行扫描,发现在244 nm处吸收最大、峰形最好。故采用244 nm为检测波长。
2.3.5 电压的选择 电压的大小可以影响样品的迁移时间和峰形[10,11]。实验分别选择 15 kV、20 kV、25 kV作为分离电压,结果发现,电压为15 kV时样品的迁移时间过长;25 kV时迁移时间较短但电流增大峰形变差;20 kV时峰形较好且迁移时间不是很长。故实验选择20 kV作为分析电压。
2.4 毛细管电泳条件
采用贝克曼P/ACE MDQ毛细管电泳仪。未涂层毛细管柱(75 μm ×57 cm,有效长度10.2 cm);运行缓冲液为含有20%的乙腈和0.004 mmol/L的CTAB的,20 mmol/L的磷酸二氢钠溶液,pH为6.5;分析电压为20 kV,检测波长为244 nm。
2.5 线性关系的考察
精密量取对照品储备液适量,分别加pH 6.5缓冲液Ⅱ稀释至 2 ml,摇匀,得到 1.62,7.56,15.12,19.98,59.94,119.9 μg/ml的螺内酯溶液,对应编号1-6号,在上述毛细管电泳条件下进行测定。
以螺内酯浓度为横坐标,以峰面积为纵坐标将所得数据进行线性回归,得回归曲线,回归方程为Y=877.7X+4 238(r2=0.991 6)。结果表明在 1.62-119.9 μg/ml范围内线性关系良好(见图 4)。
2.6 精密度试验
精密吸取线性关系考察试验中的5号对照品溶液适量,在上述电泳条件下连续进样6次,测得峰面积的RSD为1.1%,表明仪器的精密度良好。
2.7 重复性试验
取同一批号螺内酯片(批号:046140702),按照2.2.3项下的方法平行配制6份供试品溶液,在上述电泳条件下进行测定,分别求出螺内酯的含量,计算得RSD为3.4%。表明本法的重复性较好。
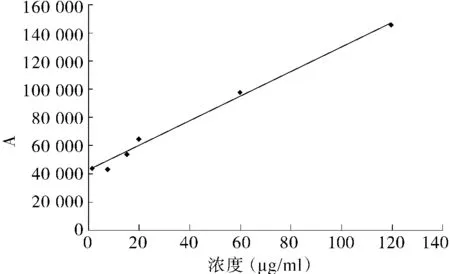
图4 螺内酯工作曲线Figure 4 Calibration curve of spironolactone
2.8 稳定性试验
取同一供试品溶液(批号:046140702),分别于配制后0,2,4,6,8 h在上述色谱条件下进样测定,螺内酯峰面积的RSD为2.3%,表明供试品溶液在8 h内稳定。
2.9 加样回收率试验
在已知含量的供试品溶液(批号:046140702)中,精密加入一定量的对照品溶液使成高、中、低三个不同浓度的供试品溶液,在上述电泳条件下进行测定,求得螺内酯的回收率为91.2%-106.6%。
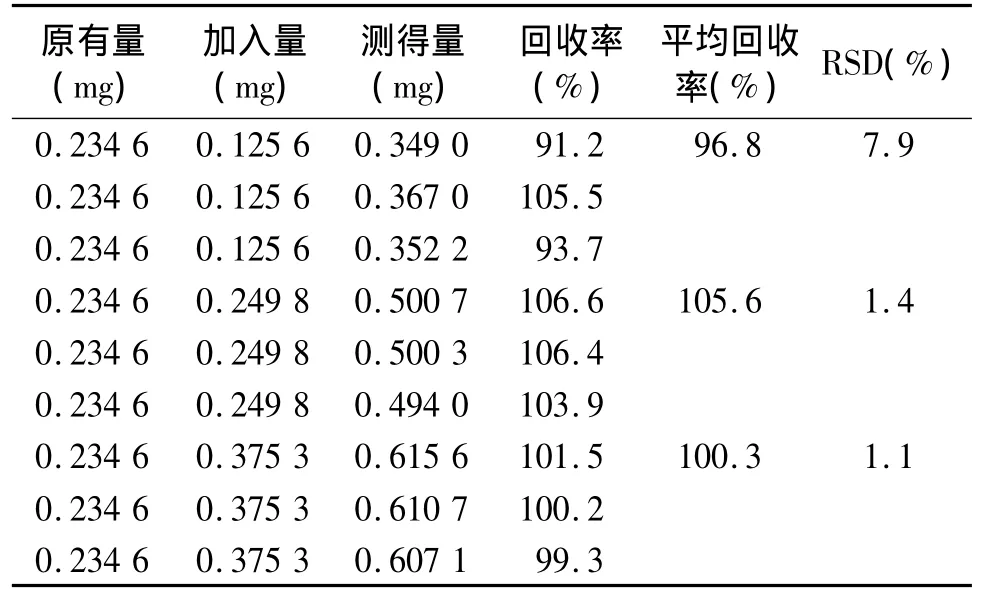
表1 螺内酯的加样回收率Table 1 Sample recovery rate of spironolactone
2.10 供试品中螺内酯的含量测定
按2.2.3项下的方法配制三种批号的供试品溶液,在上述电泳条件下进行测定,结果见表2。
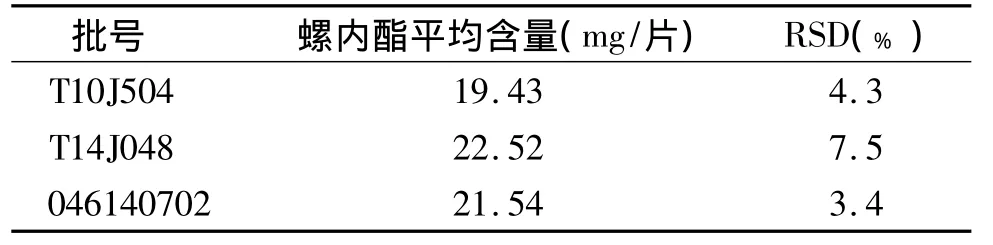
表2 螺内酯片中螺内酯的含量测定 (n=3)Table 2 Contents of spironolactone in spironolactone tablets(n=3)
上述测定结果显示,2个批号(T14J048和046140702)的螺内酯片中螺内酯的含量符合原卫生部质量标准(WS3-B-2411-97)的要求;批号T10J504由于已过保质期,从结果可以看出含量偏低,说明随着药品存放时间的延长,螺内酯的含量呈现一定的下降趋势。
3 讨论
本实验在优化的样品制备条件及电泳条件下对螺内酯片剂进行了含量测定,结果表明螺内酯片剂的含量可在此条件下获得。由系统验证性实验和样品含量测定的实验结果可看出该法精密度、稳定性良好,测定准确,并且毛细管电泳测定的方法较之高效液相的方法简便、快速、分析成本低且污染较小,可作为螺内酯制剂中螺内酯的质量控制方法。
[1] 张石革,孙定人.新药临床药理和选用手册[M].北京:化工出版社,2001:414.
[2] 国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2010:146.
[3]李超,张勉.HPLC法测定螺内酯片的含量[J].中国药房,2010,21(17):1610-1611.
[4] 李发美,赵怀清,柴逸峰,等.分析化学[M].北京:人民卫生出版社,2012:414-426.
[5]关福玉.表面活性剂在毛细管电泳中的作用[J].色谱,1995,13(1):30-32.
[6]袁东星,王小如,童秋云,等.表面活性剂作为电解液添加剂在毛细管电泳中的应用[J].分析测试学报,1994,13(2):87-97.
[7]王玺,冯钰安.高效毛细管电泳法测定工业用精对苯二甲酸中的主要杂质[J].化学世界,2001,6(6):296-298.
[8]伍文聪,阮琼,吕曾云,等.表面活性剂在分析化学中应用的研究进展[J].云南化工,2013,40(2):26-30.
[9] 赵国玺.表面活性剂物理化学[M].北京:北京大学出版社,1991:165-167.
[10]邵红,葛春丽.毛细管电泳法测定盐酸班布特罗片的含量[J].求医问药,2012,10(12):539.
[11]兰佳桐,王建会,刘中博,等.毛细管电泳法测定罗红霉素氨溴索片中2 组分的含量[J].中南药学,2014,12(6):581-584.

