机械损伤对冷蒿叶片次生代谢产物的影响
刘盟盟,贾 丽,张洪芹,臧晓琳,张汝民,高 岩
(浙江农林大学 林业与生物技术学院,浙江 临安311300)
机械损伤对冷蒿叶片次生代谢产物的影响
刘盟盟,贾 丽,张洪芹,臧晓琳,张汝民,高 岩
(浙江农林大学 林业与生物技术学院,浙江 临安311300)
为了探讨放牧过程中的采食和践踏损伤对草原植物冷蒿Artemisia frigida次生代谢产物的影响,对盆栽的内蒙古草原冷蒿进行不同程度的机械损伤处理(以剪刀损伤和揉捏),设置轻度(处理1/4枝条)、中度(处理1/3枝条)、重度损伤(处理1/2枝条)水平和对照,利用气相色谱-质谱(GC-MS)联用技术分析了不同处理后冷蒿叶片次生代谢产物的变化。结果表明:机械损伤处理后,冷蒿叶片次生代谢产物的总量在一定的时间范围内增加,轻度处理后次生代谢产物含量的增加较缓慢且峰值出现晚,而中度和重度处理后次生代谢产物的含量迅速增加,在6 h时达到峰值而后出现下降的现象;轻度和中度处理次生代谢产物种类增加,重度处理则减少。冷蒿的次生代谢产物主要是萜烯类化合物,占总量的80%以上;各处理萜烯类化合物含量与对照比分别增加了59%,54%,67%,其中,8-羟基里哪醇的增加趋势最为明显;酚类、醇类、芳香烃和酮类化合物的含量在处理后也有一定程度的增加。图5表1参23
植物化学;机械损伤;冷蒿;次生代谢产物;气相色谱-质谱联用技术
植物次生代谢产物(也称次生产物、次生物质)是指植物中一大类对于细胞生命活动或植物生长发育正常进行并非必需的小分子有机化合物,有自己独特的代谢途径,通常由初生代谢派生而来[1]。在植物对物理、化学环境的反应和适应,植物与植物之间的相互竞争和协同进化,植物对昆虫、草食动物甚至人类的化学防御以及植物与微生物的相互作用等过程中,次生代谢产物都起着重要作用[2]。面对动物和人类的采食或损伤,植物通过改变生理生化代谢途径增加体内的次生代谢产物,形成大量的萜烯类、酚类和生物碱等化合物,增加自身的化学防御能力[3]。早期研究已发现,损伤植物的叶片中总酚含量有显著增加[4];严善春等[5]和袁红娥等[6]研究表明:兴安落叶松Larix gmelinii针叶经剪叶和松毛虫Dendrolimus punctatus取食后,酚酸化合物与缩合单宁含量迅速增加。大多数植物在遭受植食性动物攻击或机械损伤时,其次生代谢产物会发生变化[7]。任琴等[8]指出,人工剪叶后马尾松Pinus massoniana挥发物各种成分相对含量都有所升高。一些低分子量的萜类物质是植物受食草动物取食后诱导释放的挥发性物质中的主要成分[9-11]。冷蒿Artemisia frigida为菊科Compositae蒿属Artemisia的多年生小半灌木,抗风蚀、耐践踏,广布于内蒙古草原带和荒漠草原带,是草原群落的主要建群植物之一,也是其他草原群落的伴生植物种或亚优势植物种。研究表明:冷蒿茎叶浸提液主要成分是樟脑、龙脑、蓍草苦素、桉树脑、喇叭烯醇和对-1-薄荷烯-4-醇等化合物[12-13];其释放挥发性有机化合物(VOCs)主要成分是桉树脑、莰烯、(E)-乙酸-3-己烯酯、α-萜品醇、对-伞花烃和樟脑[14],这些挥发物和茎叶浸提液能够影响植物种子萌发与幼苗生长发育,且损伤较未损伤冷蒿 VOCs的抑制作用增强[12-13,15]。张汝民等[16]研究指出:冷蒿释放的挥发性有机化合物如1,8-桉树脑、α-蒎烯、α-萜品醇等,具有抑制绵羊Ovis aries采食的作用。因此,本研究对盆栽的内蒙古草原野生冷蒿进行不同程度的机械损伤处理,利用气相色谱-质谱(GCMS)联用技术分析了不同的损伤强度下冷蒿叶片次生代谢产物的变化,为探讨放牧过程中的采食和践踏损伤对草原植物冷蒿次生代谢产物的影响,揭示草原植物冷蒿的耐牧性及其成为草原生态环境中重要保护者的原因提供新的资料和理论依据。
1 材料与方法
1.1 试验材料
供试材料冷蒿采自内蒙古自治区锡林浩特毛登牧场内蒙古大学草地生态学研究基地,地理位置为44°10′2′′N,116°28′56′′E,海拔1 160 m。全年平均气温为-0.4℃,最冷月(1月)平均温度-22.3℃,最热月(7月)平均气温18.8℃,≥0℃年积温为2 410℃,≥10℃积温为1 597.9℃,无霜期91 d,草原植物生长期为150 d左右。全年平均降水量为365.6 mm,集中于6-9月,约占全年降水量的80%。本研究区域主要草原植物为羊草Leymus chinensis,糙隐子草 Cleistogenes squarrosa,克氏针茅Stipa krylovii,大针茅S.grandis,防风Saposhnikovia divaricata,冷蒿Artemisia frigida,瓣蕊唐松草Thalictrum petaloideum,阿尔泰狗哇花Heteropappus altaicus等。土壤为栗钙土。
1.2 材料处理
2014年6月中旬在采样地挖取生长健壮的冷蒿植株,栽植于盛有采样地原土的花盆中(直径18 cm,高20 cm),1丛·盆-1,苗高20 cm,10~15小枝·丛-1。盆栽苗置于浙江农林大学植物生理生化实验室莱福PQX多段可编程人工气候箱中,白天光照12 h,光强为500 μmol·m-2·s-1,温度为25℃,夜间温度20℃,相对湿度为(30±2)%,缓苗生长20 d后进行实验处理。选取株高一致、生长良好、无病虫害冷蒿36盆,随机分为4组,以剪刀损伤和揉捏方式人工模拟牲畜对冷蒿叶片的采食和践踏,处理1/4枝条为轻度损伤、处理1/3枝条为中度损伤、处理1/2枝条为重度损伤、不作处理为对照。每个损伤强度和处理时间分别处理3盆,1盆为1个独立重复。分别在处理后0,6,12,24 h取样,对冷蒿叶片进行取样,液氮速冻后放置于-80℃低温冰箱内保存。
1.3 试验方法
1.3.1 冷蒿叶片次生代谢物的提取 采用浸提法,准确称取冷蒿叶片1.0 g(3~4个小枝),剪为0.5 cm小段,置于10.0 mL离心管中,加入7.0 mL蒸馏水,置于摇床上(100 r·min-1),在25℃条件下浸提48 h,经4 000 r·min-1离心15 min,取上清液,经微孔滤膜(0.45 μm)过滤,得到冷蒿叶片水浸提液。
1.3.2 化学成分分析 取5.0 mL冷蒿叶片水浸提液,加入1.0 mL乙酸乙酯萃取,取出酯相,重复3次,合并酯相,氮气吹干,然后加入200.0 μL乙酸乙酯充分溶解,取1.0 μL进样,作GC-MS分析。仪器及参数设置条件:GC(7890A型,Agilent,Wilmington,美国)条件:色谱柱HP-5MS(30 m×250 μm×0.25 μm);程序升温:初始温度50℃,以6℃·min-1的速率升至180℃,保持2 min,再以10℃·min-1升到250℃,保持10 min;载气为He,流速0.8 mL·min-1;进样口温度280℃。MS(5975C型,Agilent,Wilmington,美国)条件:电离方式EI;电子能量70 eV;离子源温度230℃;四级杆温度150℃;传输线温度250℃;扫描质量范围28~450。上样量为1.0 μL。采用NIST 2008谱图库兼顾色谱保留时间定性。
1.4 数据分析
采用气质联用仪计算机的NIST 2008谱库,结合计算机检索与手工检索,并根据已报道的植物次生代谢产物保留时间对其各组分的质谱数据进行定性分析,以色谱峰面积进行定量分析,并计算其各组分的相对含量。采用Origin进行数据处理、统计分析和作图。
2 结果与分析
2.1 机械损伤对冷蒿叶片次生代谢产物成分的影响
采用GC-MS方法对冷蒿叶片乙酸乙酯萃取物的成分进行检测分析,共检测出了43种化合物,包括萜烯类、醇类、酚类、芳香烃类和酮类(表1)。未损伤对照组检测出次生代谢产物27种,总峰面积为263.9。其中萜烯类化合物18种,相对含量占总量的86.6%;酚类化合物4种,占总量的10.0%;醇类化合物3种;芳香烃类化合物1种;酮类化合物1种。主要成分有雪松醇、8-羟基里哪醇、镰叶芹醇、脱氢芳樟醇和樟脑,占总量的66.8%。
以处理6 h为例,轻度损伤检测出27种次生代谢产物,其中萜烯类和酚类化合物为主要的次生产物种类,峰面积占总峰面积的91.1%;主要含有8-羟基里哪醇、布枯樟脑、脱氢芳樟醇、反-异丁香酚、香茅醛,占总量的59.5%;与对照相比,减少了菊油环酮、反-法尼醇、檀香脑、镰叶芹醇,增加了2,4-己二烯-1-醇、4-萜品醇、2,6-二甲基-1,7-辛二烯-3-醇、2,6-二甲基萘。中度损伤含有26种次生代谢产物,总峰面积(444.5)是对照的1.68倍,萜烯类和酚类化合物占总量的90.2%;主要成分有8-羟基里哪醇、脱氢芳樟醇、镰叶芹醇、芳樟醇、樟脑,占总量的67.9%;与对照相比,菊油环酮、反-法尼醇、雪松醇、喇叭茶醇、檀香脑为减少的物质,4-萜品醇、2,6-二甲基-1,7-辛二烯-3-醇、枯茗醇、2,6-二甲基萘为增加的物质。重度损伤检测到25种次生代谢产物,总峰面积(480.7)最大,是对照的1.82倍,其中萜烯类和酚类化合物占总量的89.0%;主要成分包括8-羟基里哪醇、环氧芳樟醇、反-法尼醇、脱氢芳樟醇、龙脑,占总量的60.4%;与对照相比,减少了樟脑、薰衣草醇、布枯樟脑、檀香脑4种物质,但增加了原冰片、顺-香芹醇、马鞭草烯醇等3种物质。
2.2 机械损伤后冷蒿叶片次生代谢产物各类化合物的含量变化
2.2.1 萜烯类的变化 从图1来看:对照萜烯类峰面积为228.6;轻度损伤随时间的增加基本保持逐渐增加的趋势,并在24 h时达到峰值,与对照相比增加了59%;中度和重度损伤均为先增加后减少的变化趋势,且在6 h时含量最高,与对照相比增加了54%和67%。雪松醇在对照中含量最高,损伤后急剧减少或消失,其在对照中的含量分别是轻度和重度损伤的7.8和10.5倍,中度损伤中一直未检测到。8-羟基里哪醇在损伤后均增加,变化趋势与萜烯类总含量的变化一致,在轻度、中度和重度损伤中的含量分别比对照增加了2.5,2.3和1.5倍。桉树脑、芳樟醇、环氧芳樟醇、松油烯-4-醇、脱氢芳樟醇、顺-萜品醇、8-羟基里哪醇等物质随着损伤强度的增加呈现出先增后减的趋势;樟脑、龙脑和镰叶芹醇则为先减后增的趋势。3-蒈烯、柠檬烯、藏红花醛、菊油环酮、顺-香芹醇、1,4-桉树脑、马鞭烯酮和橙花叔醇等物质仅在损伤处理中出现,为新增的萜烯类化合物。
2.2.2 酚类的变化 在不同损伤程度的处理中,酚类化合物的峰面积随时间的变化规律有很大差异(图2)。对照峰面积为26.48;轻度损伤随着时间的延长逐渐增加至24 h达到最高,比对照增加了60%;中度损伤在6 h时含量最高,峰面积比对照增加了近1.0倍,然后则随时间增加而逐渐降低,依次为45.61和18.11;重度损伤依次为46.35,62.10和36.60,呈现出先增加后减少的现象,最大值出现在处理后12 h,达到了对照的2.3倍。苯酚的峰面积表现出与酚类总峰面积一致的变化,随着处理强度的增加而增大,轻度、中度和重度损伤与对照相比分别增加了1.1,2.0和3.3倍;愈创木酚和反-异丁香酚的峰面积随损伤强度的增加呈显著先增加后减少的趋势,轻度损伤比对照增加了1.5和2.2倍,中度
损伤比对照增加了1.7和4.7倍,重度损伤比对照增加了0.8和3.3倍;杜烯酚则只在重度损伤中略有增加,24 h时比对照增加了69%,其他处理中略有减少。

表1 机械损伤后冷蒿叶片次生代谢产物的组分变化Table1 Changes of the main components of secondary metabolites from the leaves of Artemisia frigida under mechanical damage

表1 (续)Table1 Continued
2.2.3 醇类的变化 从图3可以看出,损伤处理后,醇类化合物的含量较对照都有增加。不同损伤强度处理的峰面积变化规律不尽相同,轻度损伤随时间变化呈一直增加的趋势,24 h时总峰面积达到对照的5.4倍;中度和重度损伤呈现先增加后减少的趋势,均在6 h最高,达到对照的5.9和5.7倍。2,3-丁二醇和苯甲醇的含量在损伤后明显增加,6 h时轻度损伤达到对照的3.0和1.6倍,24 h上升到5.8和11.6倍,中度损伤与对照相比最高增加了3.7和15.0倍,重度损伤最高增加了5.6和14.4倍。2,4-己二烯-1-醇、1-己醇、2,6-二甲基-1,7-辛二烯-3-醇在对照中未检测到,仅出现在损伤处理组中。
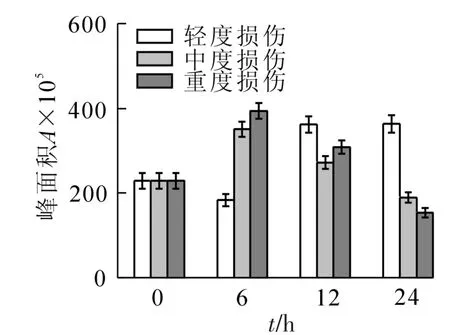
图1 机械损伤后冷蒿叶片萜烯类化合物的含量变化Figure 1 Changesofthe contentsof terpenoids from the leaves of Artemisia frigida under mechanical damage
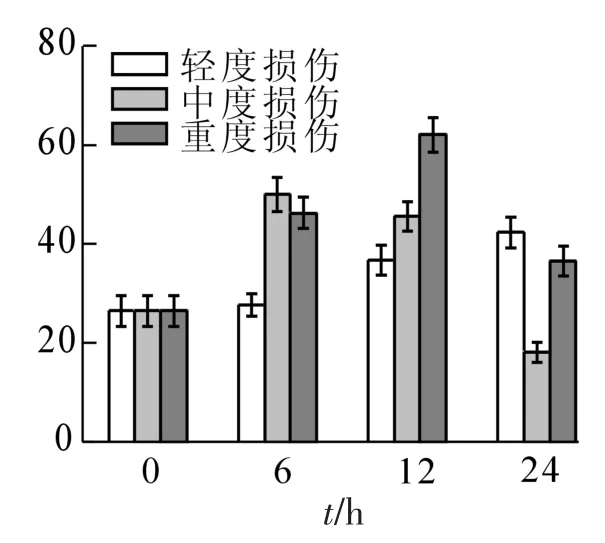
图2 机械损伤后冷蒿叶片酚类化合物的含量变化Figure 2 Changes of the contents of phenols from the leaves of Artemisia frigida under mechanical damage

图3 机械损伤后冷蒿叶片醇类化合物的含量变化Figure 3 Changes of the contents of alcohols from the leaves of Artemisia frigida under mechanical damage
2.2.4 其他化合物的变化 除萜烯类、酚类和醇类化合物外,本研究还检测出了芳香烃类和酮类化合物。芳香烃类化合物的含量在损伤后12 h内迅速增加(图4),与对照相比均增加1倍以上,轻度损伤在12 h后急剧下降,中度和重度损伤在12 h后变化不明显;2,6-二甲基萘仅在损伤处理后出现,在损伤强度水平上先增后减,在处理时间水平上则保持增加的趋势。酮类化合物仅有1种,其含量在损伤后明显增加,轻度损伤随处理时间一直呈增加的趋势,24 h时峰面积较对照增加了4.6倍;中度和重度损伤则先增加后减少,且均在6 h达到最大值,与对照相比分别增加了6.1和4.8倍(图5)。
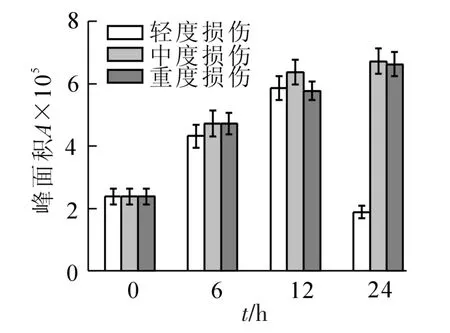
图4 机械损伤后冷蒿叶片芳香烃化合物含量变化Figure 4 Changes of the contents of aromatics from the leaves of Artemisia frigida under mechanical damage

图5 机械损伤后冷蒿叶片酮类化合物的含量变化Figure 5 Changes of the contents of ketones from the leaves of Artemisia frigida under mechanical damage
3 讨论
植物虽不能像动物一样通过改变位置主动躲避放牧家畜的采食和践踏损伤,但在长期的自然选择进化过程中也获得了一些避免或减弱伤害的化学武器,以主动适应生存环境。植物通过调控次生代谢途径,产生生物化学防御物质是一种有效的策略[3],能够增加植物的抗性。有研究表明:动物的活动能够影响植物组成性和诱导性释放的VOCs中物质的相对比例[17-18]。Kang等[19]提出,许多植物在受到损伤时释放单萜以抵御动物采食或者损伤,作为防御物质增加抵抗能力;张汝民等[16]研究表明:绵羊采食时,对牧草的种类、气味具有一定的选择,冷蒿叶片释放的挥发物中的1,8-桉树脑、α-蒎烯、α-萜品醇等萜类物质使绵羊对牧草的采食量显著下降;对伞花烃、樟脑和异丁烯醛[20]也被报道能够显著抑制羔羊的食物摄入。本研究结果中,冷蒿经机械损伤后,叶片中8-羟基里哪醇、桉树脑、芳樟醇、龙脑、松油烯-4-醇等萜类化合物的含量显著增加,可能是冷蒿损伤后调控了次生代谢途径,体内形成了防御性萜烯类物质,可以作为气味的驱拒剂,抵御动物采食,与前面的研究报道具有一致性。冷蒿遭受损伤后,次生代谢产物方面另一个明显的变化是酚类化合物含量的增加,苯酚、愈创木酚和反-异丁香酚等随损伤强度的增加呈显著增加趋势,这被认为是创伤诱导的氧化反应,即产生有毒的单元酚或双元酚和酮类化合物,抵御动物采食和损伤,或者参加木质素代谢,增加植物的硬度以减弱损伤。左照江等[14]的研究表明:冷蒿在损伤时释放出大量己醇类脂肪酸衍生物,如3-己烯醇,这些物质能抵御草食性昆虫的侵害。机械损伤后冷蒿叶片中含有的醇类化合物含量升高,且2,4-己二烯-1-醇、1-己醇是在损伤处理后新增的物质,可能是为释放醇类化合物以抵御伤害提供基础。
积极防御假说(active defense hypothesis,ADH)认为,植物只有在其产生的次生代谢产物所获得的防御收益大于其生长所获得的收益时才产生次生代谢产物。面临胁迫时,植物次生代谢产物的防御收益增加,因而产生的次生产物较多[21]。本研究中在中度和重度损伤处理后,冷蒿叶片受害严重,其次生代谢产物的含量迅速增加,萜类、酚类等各类化合物的含量增加反应也很明显。食草动物取食后,植物体内树脂管或腺毛等预先储存VOCs的结构破裂,导致挥发物释放的结果[22],也可以是受损器官或附近未受损器官从头合成的物质在几小时或几天后的释放。本研究中,轻度损伤后萜烯类、酚类、醇类和酮类化合物含量的增加较缓慢且峰值出现都最晚,而中度和重度损伤后次生代谢产物的含量迅速增加,在6 h或12 h达到峰值后出现下降的现象,这可能与茎叶挥发、根系分泌有一定的关系。
许多研究表明:对植物叶片的人为损伤也能导致VOCs释放水平的升高,对食草动物采食产生趋避作用[23]。当机械损伤的区域和时间跨度达到实际取食的水平,VOCs释放图谱与许多物种被取食后得到的图谱很相似。尽管如此,一些草食动物的代谢物,如脂肪酸-氨基酸结合物、硫酸化的脂肪酸衍生物、肽和β-葡糖苷酶,还是能够特异性影响VOCs的释放。与此类似,自然放牧条件下食草动物的活动也可能会导致冷蒿形成特异性的次生代谢产物。本研究探讨了人为机械损伤对冷蒿次生代谢产物的影响,而次生代谢产物在冷蒿耐牧性中的具体作用还需要进行更深一步的研究。
[1] 陈晓亚,叶和春.植物次生代谢及其调控[M]//李承森.植物科学进展:第1卷.北京:高等教育出版社,1998:293-304.
[2] 阎秀峰.植物次生代谢生态学[J].植物生态学报,2001,25(5):639-640.
YAN Xiufeng.Ecology of plant secondary metabolism[J].Acta Phytoecol Sin,2001,25(5):639-640.
[3] 汪诗平.草原植物的放牧抗性[J].应用生态学报,2004,15(3):517-522.
WANG Shiping.Grazing resistance of rangeland plants[J].Chin J Appl Ecol,2004,15(3):517-522.
[4] BALDWIN I T,SCHULTZ J C.Rapid changes in tree leaf chemistry induced by damage:Evidence for communication between plants[J].Science,1983,221(4607):277-279.
[5] 严善春,袁红娥,王琪,等.叶损伤诱导兴安落叶松针叶中10种酚酸的变化[J].应用生态学报,2010,21(4):1000-1006.
YAN Shanchun,YUAN Hong’e,WANG Qi,et al.Quantitative changes of 10 phenolic acids in Larix gmelinii needles induced by leaf damage[J].Chin J Appl Ecol,2010,21(4):1000-1006.
[6] 袁红娥,严善春,佟丽丽,等.剪叶损伤与昆虫取食对兴安落叶松(Larix gmelinii)针叶中缩合单宁诱导作用的差异[J].生态学报,2009,29(3):1415-1420.
YUAN Hong’e,YAN Shanchun,TONG Lili,et al.Content differences of condensed tannin in needles of Larix gmelinii by cutting needles and insect feeding[J].Acta Ecol Sin,2009,29(3):1415-1420.
[7] 许伟,严善春.茉莉酸在植物诱导防御中的作用[J].生态学报,2005,25(8):2074-2082.
XU Wei,YAN Shanchun.The function of jasmonic acid in induced plant defence[J].Acta Ecol Sin,2005,25(8): 2074-2082.
[8] 任琴,李镇宇,胡永建,等.受害马尾松、湿地松挥发性化学物质的释放[J].生态学报,2005,25(11):2928-2932.
REN Qin,LI Zhenyu,HU Yongjian,et al.Volatile compounds release from damaged Pinus massioniana and Pinus elliotii[J].Acta Ecol Sin,2005,25(11):2928-2932.
[9] ARIMURA G,OZAWA R,KUGIMIVA S,et al.Herbivore-induced defense response in a model legume.two spotted spider mites induce emission of (E)-β-ocimene and transcript accumulation of (E)-β-ocimene synthase in Lotus japonicus[J].Plant Physiol,2004,135(4):1976-1983.
[10] BOHLMANN J,MEYER-GAUEN G,CROTEAU R.Plant terpenoid synthases:molecular biology and phylogenetic analysis[J].Proc Natl Acad Sci,1998,95(8):4126-4133.
[11] DEGENHARDT J,GERSHENZON J.Demonstration and characterization of(E)-nerolidol synthase from maize:a herbivore-inducible terpene synthase participating in (3E)-4,8-dimethyl-1,3,7-nonatriene biosynthesis [J].Planta, 2000,210(5):815-822.
[12] 王玉芝,张汝民,高岩.冷蒿浸提液对几种饲用植物的化感作用[J].中国草地学报,2008,30(2):47-53.
WANG Yuzhi,ZHANG Rumin,GAO Yan.Allelopathy effect of extracts from Artemisia frigida Willd.on some feeding plants[J].Chin J Grassland,2008,30(2):47-53.
[13] 张汝民,王玉芝,侯平,等.几种牧草幼苗对冷蒿茎叶水浸提液化感作用的生理响应[J].生态学报,2010,30(8):2197-2204.
ZHANG Rumin,WANG Yuzhi,HOU Ping,et al.Physiological responses to allelopathy of aquatic stem and leaf extract of Artemisia frigida in seedling of several pasture plants[J].Acta Ecol Sin,2010,30(8):2197-2204.
[14] 左照江,张汝民,王勇,等.冷蒿挥发性有机化合物主要成分分析及其地上部分结构研究[J].植物生态学报,2010,34(4):462-468.
ZUO Zhaojiang,ZHANG Rumin,WANG Yong,et al.Analysis of main volatile organic compounds and study of aboveground structures in Artemisia frigida[J].Chin J Plant Ecol,2010,34(4):462-468.
[15] 左照江,张汝民,朱金胡,等.冷蒿VOCs对4种植物种子萌发和幼苗生长的影响[J].浙江林学院学报,2009,26(1):76-82.
ZUO Zhaojiang,ZHANG Rumin,ZHU Jinhu,et al.Effects of volatile organic compounds (VOCs)from Artemisia frigida on germination and growth of four plant types[J].J Zhejiang For Coll,2009,26(1):76-82.
[16] ZHANG Rumin,ZHANG Wenguang,ZUO Zhaojiang,et al.Inhibition effects of volatile organic compounds from Artemisia frigida Willd.on the pasture grass intake by lambs[J].Small Ruminant Res,2014,121(2):248-254.
[17] BLANDE J D,TIIVA P,OKSANEN E,et al.Emission of herbivore-induced volatile terpenoids from two hybrid aspen(Populus tremula×tremuloides)clones under ambient and elevated ozone concentrations in the fild[J].Glob Change Biol,2007,13(12):2538-2550.
[18] BRILLI F,CICCIOLI P,FRATTONI M,et al.Constitutive and herbivore-induced monoterpenes emitted by Populus×euroamericana leaves are key volatiles that orient Chrysomela populi beetles[J].Plant Cell Environ,2009,32(5): 542-552.
[19] KANG Jinho,LIU Guanghui,SHI Feng,et al.The tomato odorless-2 mutant is defective in trichome-based production of diverse specialized metabolites and broad-spectrum resistance to insect herbivores[J].Plant Physiol,2010,154(1):262-272.
[20] DZIBA L E,PROVENZA F D.Dietary monoterpene concentrations influence feeding patterns of lambs[J].Appl Anim Behav Sci,2008,109(1):49-57.
[21] BARTO E K,CIPOLLINI D.Testing the optimal defense theory and the growth-differentiation balance hypothesis in Arabidopsis thaliana[J].Oecologia,2005,126(2):169-178.
[22] TURLINGS T C J,TUMLINSON J H.Systemic release of chemical signals by herbivore-injured corn[J].Proc Natl Acad Sci,1992,89(17):8399-8402.
[23] FONTANA A,REICHELT M,HEMPEL S,et al.The effects of arbuscular mycorrhizal fungi on direct and indirect defense metabolites of Plantago lanceolata L.[J].J Chem Ecol,2009,35(7):833-843.
Mechanical damage on secondary metabolites from Artemisia frigida leaves
LIU Mengmeng,JIA Li,ZHANG Hongqin,ZANG Xiaolin,ZHANG Rumin,GAO Yan
(School of Forestry and Biotechnology,Zhejiang A&F University,Lin’an 311300,Zhejiang,China)
To determine the effects of feed intake and trample damage on secondary metabolites of Artemisia frigida,A.frigida from Inner Mongolia grassland was potted in the laboratory and treated with different degrees of mechanical damage (light,moderate,severe,and a control group without damage).Then chemical components of the leaves were analyzed by gas chromatography/mass spectrometry (GC-MS).Results showed that with mechanical damage treatment the total amount of secondary metabolites increased within a certain time range.Secondary metabolites with light damage increased gradually and peaked at 24 h;moderate and severe treatments increased rapidly,peaked at 6 h,and then declined.Increases in species of secondary metabolites were visible when treated with light and moderate damage,but a decrease appeared with severe damage.The main components of secondary metabolites were terpenoids which accounted for more than 80%of the total.The terpenoid content when compared with the control increased 59%with light damage,54%with moderate damage,and 67%with heavy damage.The increase of 8-hydroxylinalool was greatest;however,phenols,alcohols,aromatics,and ketones also increased.[Ch,5 fig.1 tab.23 ref.]
plant chemistry;mechanical damage;Artemisia frigida;secondary metabolites;gas chromatography/mass spectrometry(GC-MS)
S718.43;Q946.8
A
2095-0756(2015)06-0845-08
浙 江 农 林 大 学 学 报,2015,32(6):845-852
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2015.06.004
2015-01-07;
2015-03-21
国家自然科学基金资助项目(31270756,31470704)
刘盟盟,从事植物生理生化研究。E-mail:liumeng8880@163.com。通信作者:高岩,教授,博士,从事植物生理生态等研究。E-mail:gaoyan1960@sohu.com

