褐藻胶寡糖提高小麦抗旱能力的初步研究
刘 航
辽宁工业大学化学与环境工程学院,锦州 121001
干旱是严重的自然灾害,是农业生产的一个全球性问题也是制约我国农产品提高产量的一个重要因素之一。持续的干旱胁迫会引发植物一系列生化和生理响应,包括植株生长抑制、细胞氧化损伤及光合抑制,最终导致小麦生长发育受到影响[1-4]。叶绿素是高等植物光合作用主要组成成分,叶绿素合成受阻会严重影响植物生长发育。某种程度上来说,叶绿素含量的改变反映了植物的健康程度[5]。干旱胁迫会诱导植物脯氨酸积累。脯氨酸作为渗透胁迫保护剂参与植物抗旱,且缓解渗透胁迫对植物造成的损伤[6]。胁迫条件下,超氧化物歧化酶SOD 和过氧化物酶POD 可直接与活性氧ROS 反应。细胞膜对各种逆境胁迫非常敏感,通常伴随着MDA 含量的增加,这是一种细胞膜氧化损伤的典型特征。因此,MDA 含量可以作为干旱胁迫损伤的一个重要指标[7]。随着干旱胁迫相关基因的发现,越来越多的研究将目光集中在ABA 信号通路中。众所周知,ABA 依赖性信号通路参与干旱胁迫响应[8]。缺水条件下,一些由ABA 介导的胁迫响应基因被诱导,例如如编码渗透保护蛋白的基因、蛋白激酶等[9,10]。
褐藻胶寡糖(Alginate oligosaccharides,AOS)来源于降解的褐藻胶多糖,由β-D-甘露糖醛酸(ManA)和α-L-古洛糖醛酸(GulA)或二者杂合片段构成。褐藻胶寡糖AOS 具有多种植物活性[11]。据报道,AOS 可以促进植物根系生长[12-14],提高植物产量[15],缓解如高盐、重金属等非生物胁迫对植物造成的损伤[16,17],但AOS 对植物抗旱能力影响的研究鲜有报道。
本文考察了褐藻胶寡糖AOS 对小麦生物量、次级代谢产物以及抗氧化酶活性的影响,且研究AOS对ABA 依赖性信号通路中抗旱相关基因,如LEA1、SnRK2 和NCED 表达的影响。
1 材料与方法
1.1 小麦植株培养
选用干旱敏感型小麦Xinong979 为供试材料。用75%乙醇浸种10 min 消毒后,再用去离子水浸种8 h。昼/夜循环12 h/12 h,25 ℃/20 ℃,相对湿度65%,光照强度为800 μmol/(m2·s)。选取生长状态比较一致的1 周龄小麦,用聚乙二醇-6000(PEG-6000)模拟渗透,使PEG 终浓度达到20%。在各组处理24 h 后进行取样以及生理生化指标的检测。
1.2 试剂处理
设置4 个处理组:空白对照Control(叶面喷施去离子水),胁迫处理组PEG(PEG-6000 灌根+叶面喷施去离子水),寡糖处理组AOS(叶面喷施1,000 mg/L 褐藻胶寡糖溶液),寡糖+胁迫处理组AOS+P(PEG-6000 灌根+叶面喷施1,000 mg/L 褐藻胶寡糖溶液)。
1.3 相对水含量
新鲜小麦苗称取鲜重(FW)后,将叶片浸入到去离子水中饱和2 h,以获得饱和重量(SW),然后将这些叶片放入烘箱75oC 干燥24 h,以获得干重(DW)。相对水含量(RWC(%))按照以下公式计算:

1.4 叶绿素含量
称取新鲜的小麦叶片1 g,用10 mL 95%乙醇匀浆。匀浆后的上清液在665(A665)和649(A649)nm下分别检测吸光值。叶绿素含量可以按照以下公式进行计算:

1.5 脯氨酸含量
脯氨酸含量检测按照Bates[18]方法。
1.6 MDA 含量
MDA 含量检测按照Gao[19]方法。称取新鲜的小麦叶片1 g,在100 mg/L 三氯乙酸中匀浆,离心后的上清液加入2 mL 硫代巴比妥酸(TBA),沸水浴15 min 冷却后冰浴。上清液在分别在532 nm、600 nm 和450 nm 波长下测定吸光值。
1.7 抗氧化酶活性
超氧化物歧化酶SOD 活力按照Giannopolitis[20]的方法。SOD 活性单位以抑制NBT 光化还原的50%为一个酶活性单位表示,单位U/mg FW。
过氧化物酶POD 活性按照Zhang 和Kirham[21]的方法。POD 活性单位以每g 植物鲜重每分钟内A470变化0.01 为一个酶活力单位,单位U/(g FW·min)。
1.8 RT-PCR 抗旱相关基因转录水平检测
小麦总RNA 提取、cDNA 合成以及RT-PCR 分别按照RNAiso Plus extraction solution 试剂盒(宝生物,大连)、Takara RNA PCR Kit (AMV)Ver.3.0 试剂盒(宝生物,大连)和2 ×Taq PCR MasterMix 试剂盒(博迈德,北京)提供的方法进行。实验所用引物在表1 中。
1.9 褐藻胶寡糖制备与检测
褐藻胶寡糖为实验室自制。褐藻胶(购自青岛明月海藻有限公司)利用商品化褐藻胶裂解酶(购自上海Nagase 贸易有限公司)在45 ℃下降解10 h,利用80%乙醇进行沉淀,除去大分子未降解的多糖以及杂质,离心15 min 后得到的上清液冻干,制得寡糖。样本进行HPLC 检测,产物的聚合度为2~6,主要为2 糖和3 糖。
2 结果与讨论
2.1 褐藻胶寡糖对小麦生长发育的影响
由图1 实验结果可知,24 h 后与空白对照组相比,PEG 处理的小麦叶片出现萎蔫、生长受到严重抑制。与PEG 组相比,施加了1,000 mg/L 的褐藻胶寡糖的小麦苗长、根长以及鲜重分别增加了17.9%、26.2%和43.1%(图2 A~C),相对水含量RWC(%)则增加了32.7%(图2 D)。

图1 褐藻胶寡糖对小麦生长状态的影响Fig.1 Effects of AOS on phenotypes of wheat
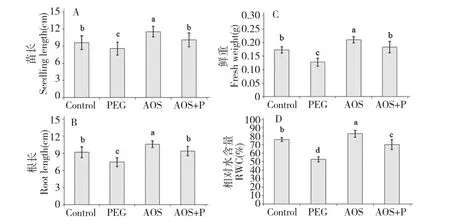
图2 褐藻胶寡糖对小麦生长指标的影响Fig.2 Effects of AOS on growth parameters of wheat

图3 褐藻胶寡糖对小麦叶绿素含量的影响Fig.3 Effects of AOS on chlorophyll content of wheat leaves
各组处理24 h 后,褐藻胶寡糖AOS 组中小麦叶片中叶绿素含量比其他处理组显著增高(P>0.05)(图3),而PEG 处理组小麦叶绿素含量明显下降;PEG 处理下外源施加1,000 mg/L 褐藻胶寡糖的小麦叶绿素含量是仅用PEG 处理的2 倍。这些现象表明,小麦在正常或干旱胁迫条件下,外源施加褐藻胶寡糖对小麦叶绿素合成具有促进作用。植物生长是由碳固定引起的,这反映在叶绿素含量的增加上。从实验结果中可以发现,褐藻胶寡糖能够使干旱下生长受到抑制的小麦恢复生长。这可能是由于褐藻胶寡糖通过增加叶绿素含量来缓解植物光合抑制。
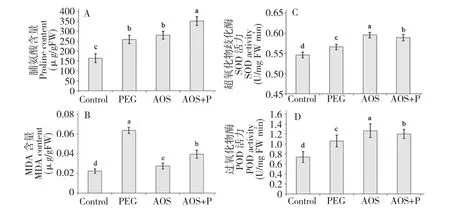
图4 褐藻胶寡糖对脯氨酸和MDA 含量以及抗氧化酶活力的影响Fig.4 Effects of AOS on proline and MDA contents and antioxidase activities of wheat leaves
2.2 褐藻胶寡糖对MDA 和脯氨酸含量以及抗氧化酶活力的影响
为了抵御外界非生物胁迫,许多植物通过合成和积累脯氨酸来调节渗透压。在某种程度上,脯氨酸含量的高低可以作为评价植物抗逆能力的指标之一[22]。与空白对照组相比,24 h 后PEG 处理组和褐藻胶寡糖处理组小麦中脯氨酸含量分别增加了36.3%和41.2%。干旱状态下,外源施加寡糖的小麦处理组其脯氨酸含量增加了53%(图4 A)。结果表明,干旱条件下褐藻胶寡糖能够通过增加脯氨酸积累,增加小麦叶肉细胞中的渗透调节能力,提高小麦抗旱性。
MDA 含量增加是细胞膜损伤的典型特征,因此MDA 含量多少能够反映出细胞膜氧化损伤的程度。PEG 处理组MDA 含量显著增加(P<0.05),与之相比施加了1,000 mg/L 褐藻胶寡糖的处理组MDA 含量降低37.9%(图4 B)。结果表明,干旱条件下施加褐藻胶寡糖可以缓解小麦细胞膜损伤,降低脂质过氧化物产生。
水分缺失和渗透胁迫会造成植物细胞氧化胁迫。植物细胞进化出一种防御机制来抵御活性氧对其造成的损伤。其中一个重要的机制就是抗氧化酶系统,包括SOD 和POD[23]。与空白对照组相比,24 h 后PEG 处理的小麦叶片中超氧化物歧化酶SOD的活性增加了7%,施加寡糖后的小麦中超氧化物歧化酶活性也升高(图4 C)。过氧化物酶POD 的活性也呈现同样的趋势(图4 D)。说明褐藻胶寡糖可以作为外源激发子,激活抗氧化酶活性。干旱条件下,外源施加褐藻胶寡糖,小麦中超氧化物歧化酶SOD 和过氧化物酶POD 活性分别提高了4% 和13.2%。由实验结果可知,褐藻胶寡糖能够降低脂质过氧化物丙二醛(MDA)的含量,并且可以通过提高抗氧化酶(SOD 和POD)活性缓解叶片细胞氧化损伤。
2.3 褐藻胶寡糖对抗旱相关基因表达的影响

图5 褐藻胶寡糖对LEA1 转录水平的影响Fig.5 Expression patterns and relative expression level of LEA1
LEA 蛋白对胚乳发育和植物生长器官的渗透胁迫有保护的作用[24]。图5 显示,在非干旱胁迫下,LEA 蛋白基因在植物营养器官中低表达,干旱和AOS 处理均能够诱导该基因。PEG 处理24 h 后小麦植株严重脱水,为了保护植物生长器官,其自身必须大量诱导LEA1 表达,因此出现强烈诱导现象。褐藻胶寡糖诱导小麦LEA1 基因结果表明:寡糖激发了LEA1 的转录,叶片中LEA1 在3 h 就能被褐藻胶寡糖诱导,且为较缓和,24 h 达到峰值,之后下降。AOS+P 处理组中,在处理的早期小麦LEA1 就被诱导,随着时间的推移,植株适应了这种外源激发作用,因此该处理组中LEA1 的诱导表现不是那么强烈。

图6 褐藻胶寡糖对SnRK2 转录水平的影响Fig.6 Expression patterns and relative expression level of SnRK2
SnRK2 编码蛋白激酶,调控干旱响应基因(转录因子TFs),TFs 与下游抗旱相关的基因启动子中顺式作用元件结合,启动基因表达。从图6 中可知,除了空白对照组,所有的处理组中SnRK2 的表达都是先升后降的趋势。PEG 处理组小麦中SnRK2 基因12 h 时达到最大。褐藻胶寡糖可以在早期快速诱导SnRK2:在叶片中该基因3 h 开始上调。在植物胁迫信号转导途径间存在联系和交叉作用。SnRK2 编码的蛋白激酶参与了逆境胁迫下的很多信号通路:例如,ABA-依赖性信号通路、ABA-非依赖型信号通路以及水杨酸信号通路等,可以说SnRK2 蛋白激酶是信号通路中众多枢纽之一[25]。当激发子AOS 和PEG 同时作用时,很有可能是几条通路同时响应,对于SnRK2 需求必然要比单独使用PEG 和AOS 处理要大,因此在实验结果中可以发现,PEG和AOS 同时诱导该基因具有叠加效果,可使SnRK2转录水平比单独用PEG 或AOS 处理提高2 倍左右。以上结果表明,褐藻胶寡糖不仅能在早期快速调控功能基因(LEA1)而且能够刺激调控基因(SnRK2)表达,增强小麦抗旱能力。

图7 褐藻胶寡糖对NCED 转录水平的影响Fig.7 Expression patterns and relative expression level of NCED
9-顺式环氧类胡萝卜素双加氧酶(9-cis-epoxy carotenoid dioxygenase,NCED)催化的氧化裂解反应是ABA 生物合成途径中的关键步骤。NCED 基因参与了麦类作物的非生物胁迫应答反应,并调控内源ABA 的合成。由图7 可知,干旱和AOS 均可诱导NCED 基因,用于合成脱落酸。干旱条件下使用褐藻胶寡糖,叶片中该基因表达出现“波动”,3 h 时表达出现一个小高峰,而后下降,72 h 时又出现一个更高的表达,出现这种现象的原因可能是因为一开始外界环境对植物造成刺激,为了应对这种急剧的变化,植物对刺激迅速作出反应,基因表达量骤然升高;当植物逐步适应该变化后,表达又下降;到了干旱胁迫后期,植株受到的损伤更加严重,为了抵抗外界环境对其造成的侵害,使胁迫响应基因的表达又达到一个更高的水平。
3 结论
研究结果表明,褐藻胶寡糖AOS 能够提高小麦生物量、促进植物叶绿素合成。可诱导小麦胁迫保护剂-脯氨酸积累,产生抗逆酶类,清除由于渗透胁迫产生的氧自由基,保护叶绿素和细胞膜结构,减少胞内物质渗漏,降低丙二醛MDA 含量,稳定细胞内外环境。此外,褐藻胶寡糖可以快速有效上调ABA依赖性信号通路中的蛋白激酶编码基因SnRK2、晚期丰度蛋白编码基因LEA1 和ABA 从头合成酶基因NCED 的表达,表明AOS 可能参与了ABA 依赖性信号通路来缓解干旱对小麦的胁迫作用,增强小麦抗旱能力。
1 He JX,Wang J,Liang HG.Effects of water-stress on photochemical function and protein-metabolism of photosystem-Ii in wheat leaves.Physiol Plantarum,1995,93:771-777.
2 Krugman T,Peleg Z,Quansah L,et al.Alteration in expression of hormone-related genes in wild emmer wheat roots associated with drought adaptation mechanisms.Funct Integr Genomic,2011,11:565-583.
3 Menconi M,Sgherri CLM,Pinzino C,et al.Activated oxygen production and detoxification in wheat plants subjected to a water-deficit program.J Exp Bot,1995,46:1123-1130.
4 Smirnoff N,Tansley.The role of active oxygen in the response of plants to water-deficit and desiccation.New Phytol,1993,125:27-58.
5 Yamori W,Suzuki K,Noguchi K,et al.Effects of rubisco kinetics and rubisco activation state on the temperature dependence of the photosynthetic rate in spinach leaves from contrasting growth temperatures.Plant Cell Environ,2006,29:1659-1670.
6 Silva-Ortega CO,Ochoa-Alfaro AE,Reyes-Aguero JA,et al.Salt stress increases the expression of p5cs gene and induces proline accumulation in cactus pear.Plant Physiol Bioch,2008,46:82-92.
7 Chaoui A,Mazhoudi S,Ghorbal MH,et al.Cadmium and zinc induction of lipid peroxidation and effects on antioxidant enzyme activities in bean (Phaseolus vulgaris L).Plant Science,1997,127:139-147.
8 Shinozaki K,Yamaguchi-Shinozaki K,Seki M.Regulatory network of gene expression in the drought and cold stress responses.Curr Opin Plant Biol,2003,6:410-417.
9 Fujita Y,Fujita M,Shinozaki K,et al.ABA-mediated transcriptional regulation in response to osmotic stress in plants.J Plant Res,2011,124:509-525.
10 Yamaguchi-Shinozaki K,Shinozaki K.Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses.Annu Rev Plant Biol,2006,57:781-803.
11 Akimoto C,Aoyagi H,Tanaka H.Endogenous elicitor-like effects of alginate on physiological activities of plant cells.Appl Microbiol Biot,1999,52:429-436.
12 Hien NQ,Nagasawa N,Tham LX,et al.Growth-promotion of plants with depolymerized alginates by irradiation.Radiat Phys Chem,2000,59:97-101.
13 Iwasaki K,Matsubara Y.Purification of alginate oligosaccharides with root growth-promoting activity toward lettuce.Biosci Biotech Bioch,2000,64:1067-1070.
14 Natsume M,Kamo Y,Hirayama M,et al.Isolation and characterization of alginate-derived oligosaccharides with root growth-promoting activities.Carbohydr Res,1994,258:187-197.
15 Hu XK,Jiang XL,Hwang HM,et al.Promotive effects of alginate-derived oligosaccharide on maize seed germination.J Appl Phycol,2004,16:73-76.
16 Tang JC,Zhou QX,Chu HR,et al.Characterization of alginase and elicitor-active oligosaccharides from Gracilibacillus A7 in alleviating salt stress for Brassica campestris L.J Agric Food Chem,2011,59:7896-7901.
17 Ma LJ,Li XM,Bu N,et al.An alginate-derived oligosaccharide enhanced wheat tolerance to cadmium stress.Plant Growth Regul,2010,62:71-76.
18 Bates LS,Waldren RP,Teare ID.Rapid determination of free proline for water-stress studies.Plant Soil,1973,39:205-207.
19 Gao JF(高俊凤).Experimental Technology in Plant Physiology.Beijing:Higher Education Press,2006.210.
20 Giannopolitis CN,Ries SK.Superoxide dismutases.1.occurrence in higher-plants.Plant Physiol,1977,59:309-314.
21 Zhang JX,Kirkham MB.Drought-Stress-Induced changes in activities of superoxide-dismutase,catalase,and peroxidase in wheat species.Plant Cell Physiol,1994,35:785-791.
22 Khedr AHA,Abbas MA,Wahid A,et al.Proline induces the expression of salt-stress-responsive proteins and may improve the adaptation of Pancratium maritimum L.to salt-stress.J Exp Bot,2003,54:2553-2562.
23 Foyer CH,Noctor G.Oxidant and antioxidant signalling in plants:a re-evaluation of the concept of oxidative stress in a physiological context.Plant Cell Environ,2005,28:1056-1071.
24 Swire-Clark GA,Marcotte WR.The wheat LEA protein Em functions as an osmoprotective molecule in Saccharomyces cerevisiae.Plant Mol Biol,1999,39:117-128.
25 Xu ZS,Liu L,Ni ZY,et al.W55a encodes a novel protein kinase that is involved in multiple stress responses.J Integr Plant Biol,2009,51:58-66.

