响应面法优化超声辅助提取贯众多酚工艺
陆 洋,彭 飞,黄丽霞,习伟佳,马吉福,马 骥
陕西师范大学生命科学学院 教育部药用植物资源及天然药物化学重点实验室,西安 710119
贯众(Cyrtomium fortunei J.Sm)为鳞毛蕨科(Dryopteridaceae)贯众属(Cytomium)多年生蕨类植物,其根状茎富含多酚、多糖、黄酮、甾萜类、氨基酸等多种化合物,药用价值极高,为我国主要中药贯众的原植物之一[1]。贯众可全草入药,具有清热解毒、驱虫、抗菌、抗肿瘤、止血、降脂等作用[2]。多酚是指分子结构中有若干个酚性羟基的酚类化合物,又称植物单宁,主要有游离态和结合态,后者更能完好到达肠道产生生理活性。多酚主要存在于植物的皮、根、叶、果中,被喻为“第七大营养物质”,具有较强的抗氧化、抗衰老、抗辐射、抗肿瘤、杀菌等生物活性[3-7],目前多用于保健品、化妆品、中药类产品,具有广阔的市场前景。目前关于贯众的研究包括化学成分和药理作用[8]等方面,但整体的研究力度还相对较少,不够完善。超声波可通过机械破碎和空化作用使细胞破碎,利于细胞内容物的溶出,且具有相对微波法提取效率高、成本低、便于实现大规模生产等优点[9],本实验首次研究响应面法优化超声辅助提取贯众中多酚的工艺,经验证,该工艺稳定可靠,提取率高,这为进一步开发利用贯众,发挥其作用,如制成天然保健品、化妆品等,提供很好的理论依据。
1 材料与方法
1.1 材料与仪器
贯众采收于陕西省宁陕县旬阳坝地区,经陕西师范大学马骥副教授鉴定为鳞毛蕨科植物贯众Cyrtomium fortunei J.Sm 的干燥根状茎;没食子酸标准品,中国药品生物制品检定所;福林酚试剂,上海荔达生物科技有限公司;无水碳酸钠,天津市风船化学试剂科技有限公司;无水乙醇,天津市红岩化学试剂厂;所用化学试剂为分析纯;实验用水为超纯水。
HH-6B 数显恒温水浴锅,江苏常州国华电器有限公司;KQ-300DE 型数控超声波清洗器,昆山超声仪器有限公司;SL202N 型药物电子天平,上海明桥精密科学仪器有限公司;SHB-Ⅲ循环水式多用真空泵、RE-52AA 旋转蒸发器,上海亚荣生化仪器厂;TG16-WS 型台式高速离心机,长沙湘仪离心机仪器有限公司;Epoch 超微量微孔板分光光度计,美国BioTek;FZ102 微型植物粉碎机,黄骅市中兴有限责任公司。
1.2 实验方法
1.2.1 工艺流程
贯众→洗净→分离根状茎→阴干→粉碎→过60 目筛→石油醚脱脂→晾干→超声提取→离心→抽滤→旋蒸→定容→测量吸光度→计算多酚含量。
1.2.2 多酚标准曲线的绘制
精确称取一定量的干燥没食子酸标准品置于容量瓶中,加入无水乙醇定容,得0.1 mg/mL 的标准品溶液。依次吸取0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL 的标品溶液置于10 mL 的具塞试管中,加入福林酚试剂2.5 mL,加蒸馏水3 mL,摇匀,30 s 后加入1 mL 15%的碳酸钠溶液,摇匀后,蒸馏水补至5 mL,25 ℃避光保存1 h 后,在750 nm 处测定吸光值[10-12],以没食子酸质量为横坐标,吸光值为纵坐标,绘制标准曲线,得y=13.113x +0.0615,R2=0.9996,结果表明两变量有很强的线性相关性。
1.2.3 贯众中多酚得率的测定
准确吸取1 mL 贯众多酚提取液于具塞试管中,用蒸馏水稀释5 倍至5 mL,取稀释液0.1 mL,与1.2.2 中同样的方法显色,在750 nm 下测吸光值,根据标准曲线计算多酚得率。
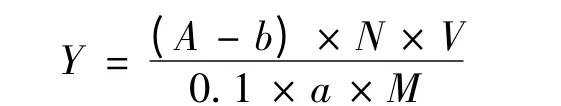
式中:Y-多酚得率(%),A-吸光值,b-标准曲线截距,N-样液稀释倍数,V-样液定容体积(mL),a-标准曲线斜率,M-贯众根状茎粉末质量(g)。
1.2.4 单因素试验
分别选取乙醇浓度、料液比、超声时间、超声温度四因素做单因素试验,取三次重复的平均值,考察各因素对贯众多酚得率的影响。
1.2.4.1 乙醇浓度对多酚得率的影响
选取乙醇浓度分别为20%、30%、40%、50%、60%、70%,在料液比1∶30,温度50 ℃下超声提取40 min,探究乙醇浓度对贯众多酚得率的影响。
1.2.4.2 超声时间对多酚得率的影响
选取超声时间分别为10、20、30、40、50 min,在乙醇浓度50%,料液比1∶30,温度50 ℃下超声提取不同时间,探究超声时间对贯众多酚得率的影响。
1.2.4.3 超声温度对多酚得率的影响
选取超声温度分别为30、40、50、60、70 ℃,在乙醇浓度50%,料液比1∶30 下超声提取40 min,探究超声温度对贯众多酚得率的影响。
1.2.4.4 料液比对多酚得率的影响
选取料液比分别为1 ∶10、1 ∶20、1 ∶30、1 ∶40、1∶50 mL/g,在乙醇浓度50%,温度50 ℃下超声提取40 min,探究料液比对贯众多酚得率的影响。
1.2.5 响应面设计
在单因素试验的基础上,以乙醇浓度(A)、料液比(B)、超声时间(C)、超声温度(D)四个因素为自变量,以多酚得率为响应值,采用Design-Expert.8.05b 软件中的Box-Behnken Design,即BBD 试验设计方法进行设计。各因素水平及编码见表1。
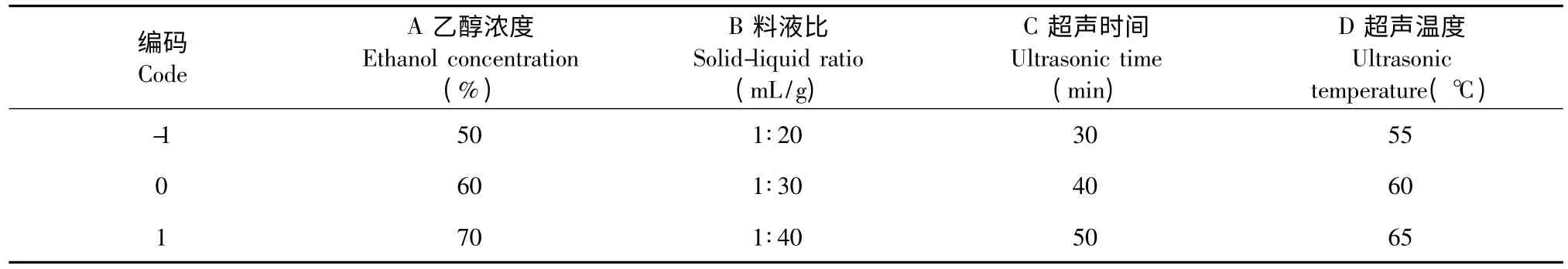
表1 响应面分析因子及水平表Table 1 Factors and levers of RSM analysis
1.2.6 数据分析处理
用Design-Expert.8.05b 软件对实验数据进行分析处理并对各因素间的交互作用做回归分析。
2 结果与讨论
2.1 单因素试验结果
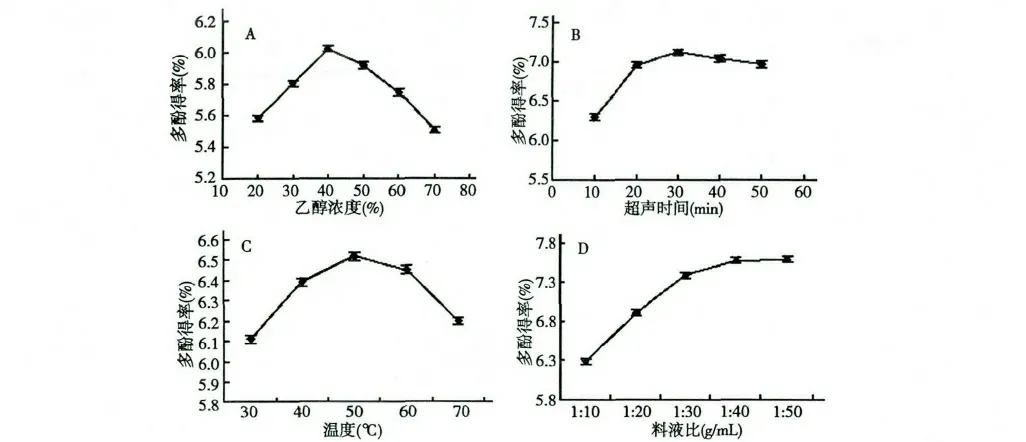
图3 乙醇浓度(A)、超声时间(B)、超声温度(C)及料液比(D)对贯众多酚得率的影响Fig.3 Effects of ethanol concentration (A),ultrasonic time (B),ultrasonic temperature (C)and solid-liquid ratio (D)on the yield of polyphenols
乙醇浓度对多酚得率的影响如图3(A),随着乙醇浓度的增加,多酚得率先增加后降低,其中提取溶剂为40%的乙醇时,多酚得率最大。原因可能为多酚含有酚性羟基,贯众中多酚与40%乙醇极性较接近,所以在其中溶解度大。选择乙醇浓度为40%为最佳浓度。
超声时间对多酚得率的影响如图3(B),随着超声时间的增加,多酚得率先迅速增加后缓慢降低,超声时间为30 min 时,多酚得率最大。原因可能为多酚的提取需要一定的时间,在一定范围内,随着时间的延长,多酚得率升高。而时间超过一定限度时,可能会增加杂质的溶出,破坏多酚的结构,因此选择30 min 为最优超声时间。
超声温度对多酚得率的影响如图3(C),在温度小于50 ℃时,多酚得率随着超声温度的升高而升高,大于50 ℃时,随着温度的升高而降低。原因为随着温度的升高,分子运动加快,提高多酚的溶出率,但是达到一定限度后,由于多酚的酚羟基化学性质较活泼,热稳定性不够强,结构被破坏,所以多酚得率降低。选择超声温度50 ℃最优。
料液比对多酚得率的影响如图3(D),可以看出,贯众多酚随料液比的增加而逐渐增大,当料液比大于1∶30 时,曲线虽有少量提升但逐渐趋于平缓,考虑到操作实际和节约能源方面,选择料液比1∶30为最优。
2.2 响应面分析及其对提取工艺的最优化
根据Box-Benhnken 中心组合试验设计原理[13],设计响应曲面试验,如表2。
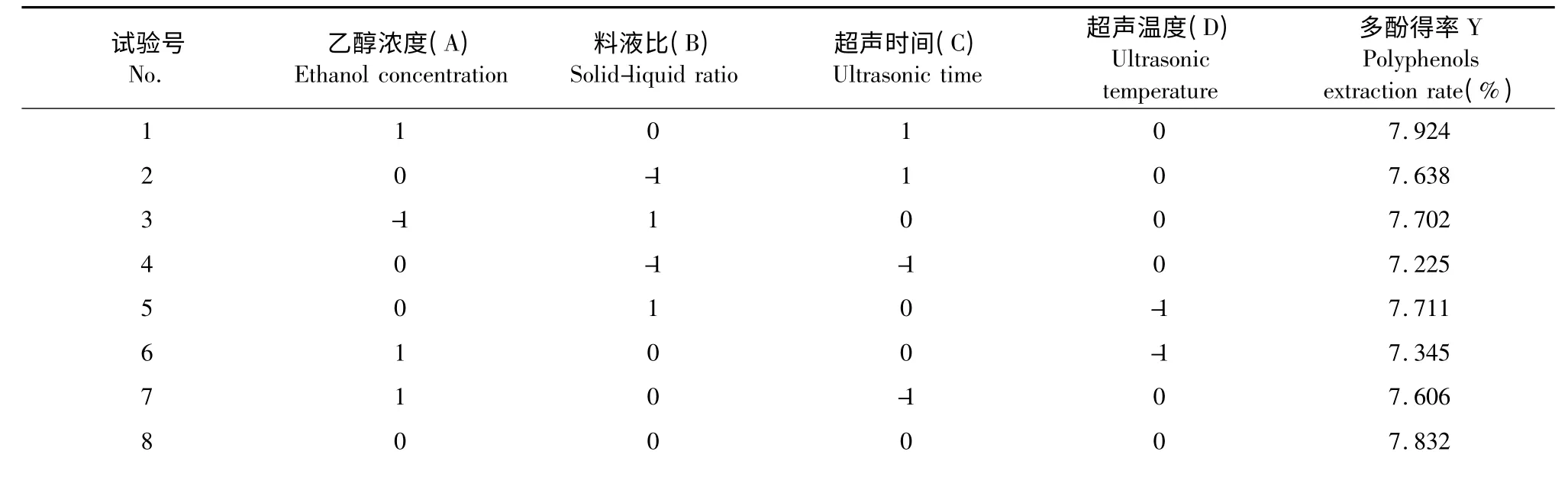
表2 中心组合试验设计及结果Table 2 The result of central composite design
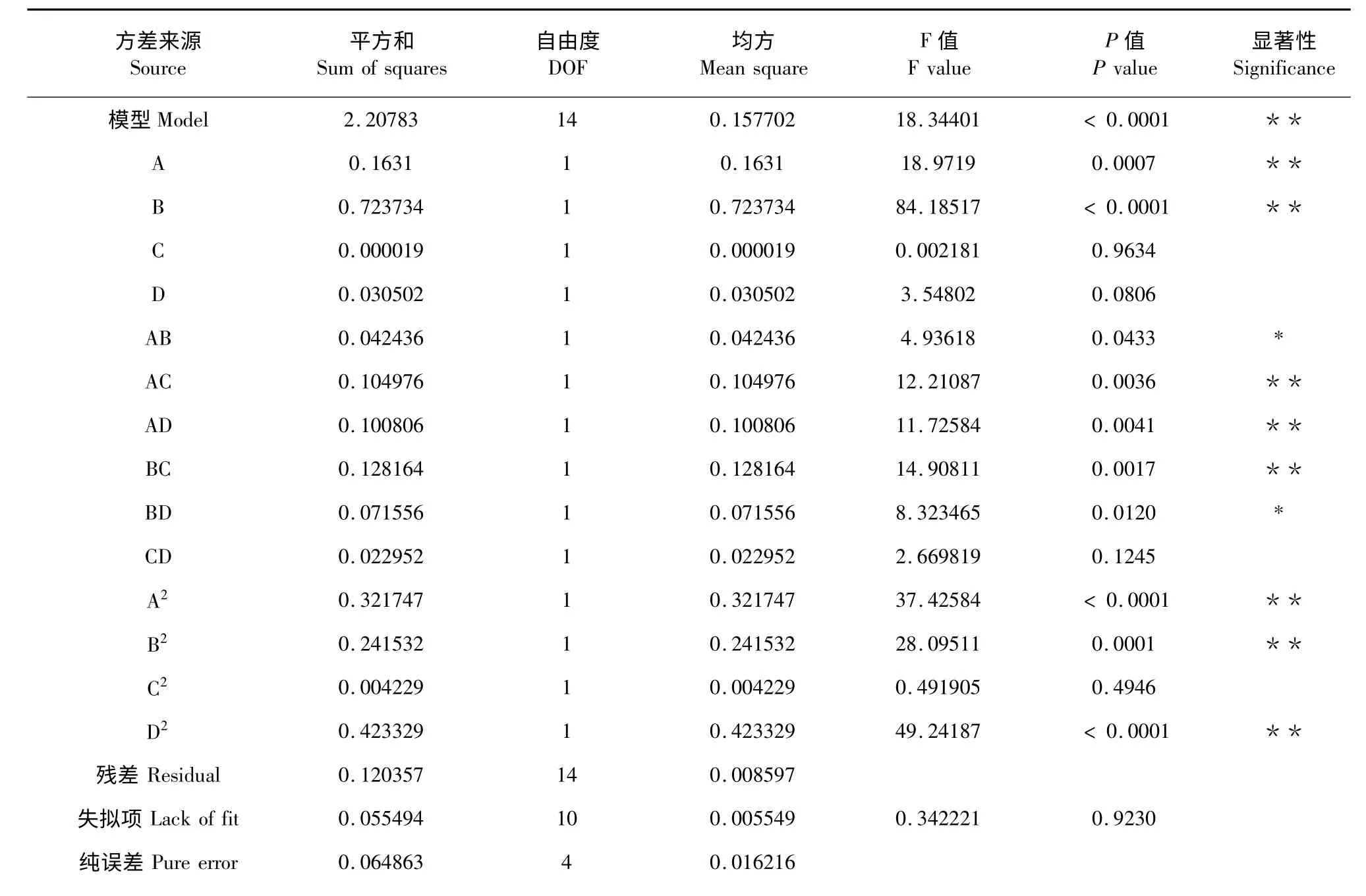
表3 回归模型方差分析Table 3 Analysis of variance for the developed polynomial model

注:* 表示显著(0.05<P<0.01),**表示极显著(P<0.01)。Note:* significant difference (0.05<P<0.01),**very significant difference (P<0.01).
利用Design-Expert.8.05b 软件,对表2 数据分析,得到多酚得率随乙醇浓度、料液比、超声时间、超声温度的回归方程为:
贯众多酚得率Y=7.82+0.12A+0.25B +0.00125C-0.05D-0.10AB+0.16AC+0.16AD-0.18BC-0.13BD-0.076CD-0.22A2-0.19B2+0.026C2-0.26D2
回归模型方差分析见表3,总模型极显著(P<0.01),说明二次多项模型具有极高的显著性,不同因素差异显著,失拟项不显著(P=0.9230>0.05),模型选择合适。校正决定系数=0.8966,表明贯众多酚得率可较准确(89.66%)地由该模型进行试验预测。R2=0.9483,表明回归方程拟合度良好。由P 值可看出各因子对贯众多酚得率的影响顺序为:料液比(P<0.0001)>乙醇浓度(P=0.0007)>超声时间(P=0.0806)>超声温度(P=0.9634)。交互项除CD 外均显著(P<0.05),其中AC、AD、BC 对多酚得率的影响为极显著(P<0.01)。说明乙醇浓度、料液比、超声温度、超声时间对贯众多酚得率的交互影响较单独影响更为显著,实验因素对响应值的影响不成简单的线性关系。
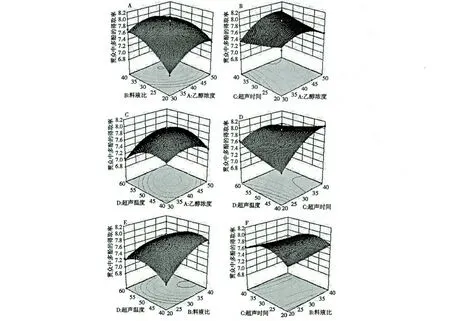
图4 各交互作用对贯众多酚得率影响的响应曲面Fig.4 Response surface plots showing the interactive effects of different factors on the yield of polyphenols
同时,根据表2 实验所得的响应面图为图4(A~F),反映了乙醇浓度、液料比、超声时间和超声温度四因素之间交互作用对贯众中多酚提取率的影响。每幅图为四因素中,任意两个因素处于零水平,即最优条件时,另外两个因素的交互作用对贯众多酚得率的影响。
在图4 中,若响应曲面图的坡度较平缓,说明随着处理条件的变化,响应值变化较小,如图4(B、F);反之,曲面陡峭,则响应值变化大,如图4(A、C~E)。在图4(A)中,多酚得率随料液比的增加而增加,随乙醇浓度的增加先升高后降低,这与单因素实验结果基本吻合,但是,在料液比增加的情况下,随着乙醇浓度的增加,多酚得率的上升趋势表现明显,后降低趋势较弱,与单因素的影响不完全一致,可见,乙醇浓度和液料比有交互作用。这是因为多酚得率受料液比影响较大,料液比增加所提升的多酚得率削弱了乙醇浓度变化时所引起的多酚得率的降低。对比于超声时间和料液比(图4D),超声温度和料液比(图4E),在图4(A)中,料液比和乙醇浓度对多酚得率均有较明显的影响,在图4(D、E)中,料液比的影响分别大于超声时间和超声温度,同时,料液比与超声时间、超声温度有交互作用。观察图4(B)和图4(F),可以看出超声时间对多酚得率的影响很小,超声温度的影响大于超声时间,乙醇浓度的影响大于超声时间。从图4(C)中看出,多酚得率随超声温度和乙醇浓度的变化均为先增加后降低,这与回归方程中AD 项的系数是正号相一致。
通过响应面等一系列分析,得出最优工艺为:乙醇浓度35.38%,料液比1∶40,超声时间20 min,超声温度46.44 ℃,考虑到实际操作,修正为:乙醇浓度35%,料液比1∶40,超声时间20 min,超声温度46℃。总多酚得率的理论值为8.12986%。此工艺耗时较短、所用乙醇浓度低、高效节能,所以有较好的实际价值。
在此最优条件下,进行三次验证试验,所得结果分别为:8.11632%、8.10443%、8.12906%,平均值8.11660%,RSD 为0.15%,可见响应面法建立的回归模型具有可靠性,最优工艺可行。
3 结论
本文以贯众为原料,乙醇为溶剂,采用超声提取法,通过单因素试验和响应面法实验设计,得出贯众多酚得率的最优提取工艺为:乙醇浓度35%,料液比1∶40,超声时间20 min,超声温度46 ℃,总多酚得率可达8.12986%,经平行试验验证,相对误差很小。说明模型模拟较好,该提取工艺稳定可行。本实验中,多酚得率较高,提取工艺简单、快速,这为后续进一步开发研究贯众有很大的实际意义。
1 Wang M (汪敏),Zhao K (赵凯),Wang R (汪瑞).Textual research on botanical origin of Chinese herbal medicine,Guanzhong.China J Chin Mat Med (中国中药杂志),2012,37:1337-1340.
2 Chen HY (陈红云),Liu GM (刘光明),Shi WX(石武祥),et al.Advances in the research of traditional medicine,Guanzhong.J Dali Univ (大理学院学报),2006,5(6):75-77.
3 Chiva-Blanch G,Urpi-Sarda M,Llorach R,et al.Differential effects of polyphenols and alcohol of red wine on the expression of adhesion molecules and inflammatory cytokines related to atherosclerosis:a randomized clinical trial.Am J Clin Nutr,2012,95:326-334.
4 Weng CJ,Yen GC.Chemo-preventive effects of dietary phytochemicals against cancer invasion and metastasis:Phenolic acids,monophenol,polyphenol,and their derivatives.Cancer Treat Rev,2012,38:76-87.
5 Lu YR,Foo LY.Identification and quantification of major polyphenol in apple pomace.Food Chem,1997,59:187-194.
6 Mendel F.Overview of antibacterial,antitoxin,antiviral,and antifungal activities of tea flavonoids and teas.Mol Nutri Food Res,2007,51:116-134.
7 Sun J,Chu YF,Wu XZ,et al.Antioxidant and antiproliferative activities of common fruits.J Agric Food Chem,2002,50:7449-7454.
8 Jung MY,Jeon BS,Bock JY.Free,esterified,and insolublebound phenolic acids in white and red Korean ginseng (Panax ginseng C.A.Meyer).Food Chem,2002,79:105-111.
9 Wei LY,Wang JH,Zheng XD,et al.Studies on the extracting technical conditions of inulin from Jerusalem Artichoke Tubers.J Food Eng,2007,79:1087-1093.
10 Ranic M,Nikolic M,Pavlovic M,et al.Optimization of microwave-assisted extraction of natural antioxidants from spent espresso coffee grounds by response surface methodology.J Clean Prod,2014,1(11):1-10.
11 Martinez-Periñan E,Hernández-Artiga MP,Palacios-Santander JM,et al.Estimation of beer stability by sulphur dioxide and polyphenol determination.Evaluation of a Laccase-Sonogel-Carbon biosensor.Food Chem,2011,127:234-239.
12 Tajoddin M,Manohar S,Lalitha J.Effect of soaking and germination on polyphenol content and polyphenol oxidase activity of mung bean (Phaseolus aureus L.)cultivars differing in seed color.Int J Food Prop,2014,17:782-790.
13 Li QH,Fu CL.Application of response surface methodology for extraction optimization of germinant pumpkinseeds protein.Food Chem,2005,92:701-706.

