HPLC 法测定青海栽培与野生桃儿七中2 种木脂素类的含量
李艳玲,徐文华,周国英,刘何春,陈 晨,宋文珠
1中国科学院西北高原生物研究所,西宁 810001;2 中国科学院大学,北京 100049
桃儿七[Sinopodophyllum hexandrum (Royle)Ying]是小檗科(Berberidacea)桃儿七属(Sinopodophyllum Ying)多年生草本植物。主要分布于我国中部从陕西太白山区由北向南沿横断山脉两侧的中高山及青藏高原地带,海拔在1500~4500 m[1]。全株均可入药,具有活血化瘀、解毒、抗氧化等功效[2,3]。现在人们主要是利用其有效成分——木脂素类物质,包括鬼臼毒素、4'-去甲基鬼臼毒素等,主要存在于桃儿七的根及根茎中,具有抗肿瘤作用[4]。近年来由于其鬼臼毒素等活性成分药用价值的研究开发,市场需求量急剧增加,加之桃儿七生长周期长、繁殖率低等生物特性造成自然界桃儿七种群数量急剧减少,已面临濒危。引种栽培是缓解桃儿七濒危现状的重要方法之一。
目前鬼臼毒素和4'-去甲基鬼臼毒素的提取工艺主要有CO2超临界萃取法、甲醇回流-水-氯仿纯化法、柱层析法、超声提取等,由于超声技术的优点是可以大幅度的提高有效成分的提取率,提取时间短,节省溶剂,操作简便,且能在常温下进行,可以避免高温操作对有效成分的破坏[5],故本实验采用超声法提取青海栽培与野生桃儿七植株内鬼臼毒素和4'-去甲基鬼臼毒素,应用高效液相色谱法(HPLC)对其含量进行测定及对比分析,旨在能为其栽培植株的扩大生产及开发利用提供一定的理论基础。
1 实验部分
1.1 仪器和试剂
美国Agilent 1200 型高效液相色谱仪(美国安捷伦公司);KQ5200DE 型数控超声波清洗器(昆山市超声波仪器有限公司);AG204 电子分析天平(梅特勒公司)。
鬼臼毒素标准品(批号:111645)和4'-去甲基鬼臼毒素标准品(批号:111792)购自中国药品生物制品检定所,纯度均大于99.2%;甲醇(分析纯,山东禹王实业有限公司化工分公司);乙腈(色谱纯,山东禹王实业有限公司化工分公司);无水乙醇(分析纯,山东禹王实业有限公司化工分公司);自制超纯水。
1.2 HPLC 分析条件
Agilent Eslipse XDB C18(4.6 ×250 nm,5 μm)色谱柱,以V(乙腈)∶V(水)=27∶73 为流动相,流速:1.0 mL ∕min;进样量:10.0 μL,柱温:25 ℃,检测波长:290 nm,采集时间25 min。
1.3 样品来源
实验样品栽培植株采自青海省海东地区乐都县马营乡桃儿七人工种植基地,野生植株采自乐都县下北山林场林区,经中国科学院西北高原生物研究所徐文华副研究员鉴定为小檗科桃儿七属植物桃儿七[Sinopodophyllum hexandrum (Royle)Ying]。于2012年7 月中旬植物生长旺季进行采样,在种植基地和下北山林场林区分别采集30 株完整的桃儿七植株,随机选取20 株,将样品植株洗净后用去离子水冲洗两遍,植株自然阴干后,野生植株分为根状茎、侧根、叶柄、叶和果实5 部分;栽培植株由于植株生长年限短,未达到性成熟,不能形成果实,故仅分为根、叶柄和叶3 部分。样品分别粉碎,过60 目筛后备用。
1.4 测定方法
1.4.1 对照品溶液制备
精密称取鬼臼毒素标准品1.3 mg、4'-去甲基鬼臼毒素标准品2.0 mg,分别置于10 mL 容量瓶中,用分析甲醇溶解并稀释至刻度线,摇匀,配制成浓度分别为0.13 mg/mL 和0.20 mg/mL 的单一标准品溶液。
1.4.2 供试品溶液制备
各样品粉末各取约0.5 g,精确称取,置于具塞锥形瓶中,准确加入10 mL 甲醇,在45 ℃、120 W 条件下进行超声处理40 min,过滤后,残渣加入10 mL甲醇重复提取,共3 次,将3 次滤液合并于25 mL 容量瓶中,冷却后定容,摇匀经0.45 nm 微孔滤膜过滤后即为供试样品溶液,3 次重复。
1.4.3 线性关系分析
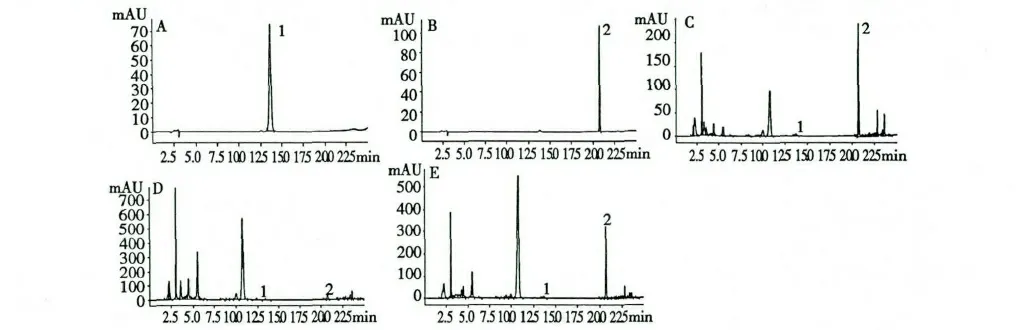
图1 对照品及样品HPLC 图Fig.1 HPLC chromatograms of reference substances and samples
将“1.4.1”项下制备所得单一标准品溶液经0.45 nm 的微孔滤膜过滤后,吸取2.0、4.0、6.0、8.0、10.0、12.0、14.0 μL,分别注入高效液相色谱仪,按照“1.2”项所述色谱条件分别测定鬼臼毒素、4'-甲基鬼臼毒素的峰面积,对2 种对照品溶液以色谱峰面积A 和进样量C(μL)进行线性回归,得到鬼臼毒素回归方程为:A=50.870C-2.4,相关系数r=1;4'-去甲基鬼臼毒素回归方程为:A=122.65C-14.357,相关系数r=0.9999。结果表明鬼臼毒素在0.26~1.82 μg 间具有良好的线性关系,4'-去甲基鬼臼毒素在0.40~2.80 μg 间具有良好的线性关系。鬼臼毒素和4'-去甲基鬼臼毒素标准品高效液相色谱图分别见图1(A)、(B)。
1.4.4 精密度试验
分别精密吸取2 种对照品溶液10 μL,重复5次,进行精密度试验测定。得鬼臼毒素峰面积的RSD 为1.63%,4'-去甲基鬼臼毒素峰面积的RSD为0.82%,表明该方法精密度良好。
1.4.5 重现性试验
精密称取同一批样品,按照上述样品溶液制备方法进行重复性试验,得到5 份供试样品溶液,分别对其进行含量测定,得到鬼臼毒素峰面积的RSD 为1.13%,4'-去甲基鬼臼毒素峰面积的RSD 为0.96%,表明该方法重现性良好。
1.4.6 稳定性试验
取供试样品溶液在0、3、6、9、12 h 后分别进行测定,得鬼臼毒素峰面积的RSD 为0.74%,4'-去甲基鬼臼毒素的RSD 为0.53%,表明该方法稳定性良好。
1.4.7 加样回收试验
精密称取0.2 g 已知鬼臼毒素含量的样品(含量0.14%),分别准确加入1.0、2.0、3.0 mL 的鬼臼毒素对照品溶液,按“1.4.2”项下方法制备成供试品溶液,测定含量,重复5 次,计算平均回收率;精密称取2.0 g 已知4'-去甲基鬼臼毒素含量的样品(含量0.02%),分别准确加入1.0、2.0、3.0 mL 的4'-去甲基鬼臼毒素对照品溶液,按“1.4.2”项下方法制备成供试品溶液,测定含量,重复5 次,计算平均回收率。结果鬼臼毒素的平均回收率为99.46%,RSD=1.12%,4'-去甲基鬼臼毒素的平均回收率为99.08%,RSD=2.24%。
2 结果与分析
2.1 样品中鬼臼毒素、4'-去甲基鬼臼毒素含量测定
按“1.2”项所述色谱条件进行供试样品溶液的测定,在290 nm 条件下记录鬼臼毒素和4'-去甲基鬼臼毒素的HPLC 色谱图,其中栽培桃儿七根及野生桃儿七的根状茎和侧根的色谱图见图1(C、D、E)。计算活性成分含量,并运用SPSS 20.0 对同种类型植株不同部位2 种木脂素类成分的含量进行多重比较,两种类型植株不同部位鬼臼毒素和4'-去甲基鬼臼毒素含量测定结果分别见表1 和表2。每个样品做3 个平行样。
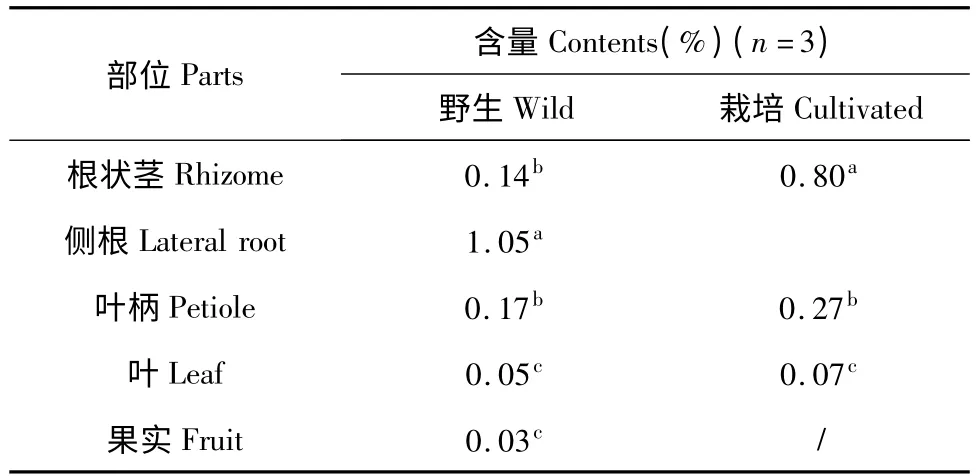
表1 样品中鬼臼毒素含量的测定结果Table 1 Quantification results of podophyllotoxin in different parts of samples
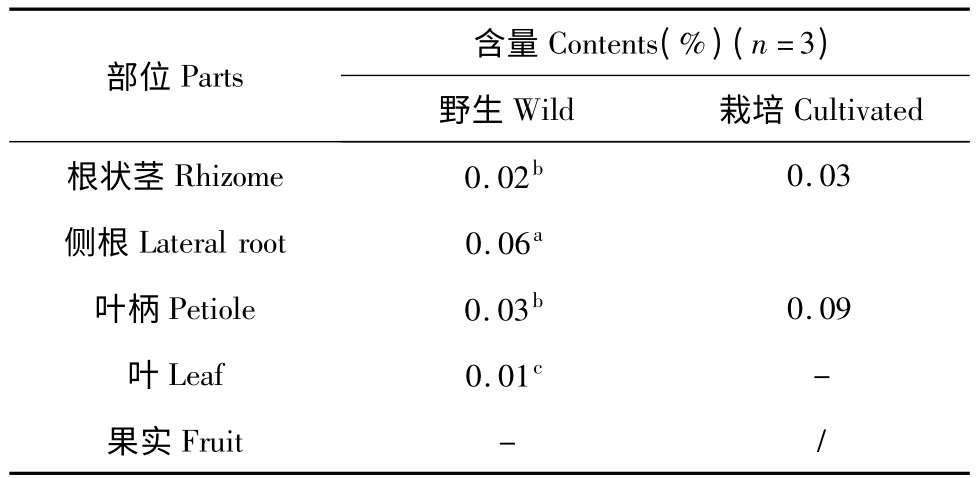
表2 样品中4'-去甲基鬼臼毒素含量的测定结果Table 2 Quantification results of 4'-demethylpodophyllotoxin in different parts of samples
2.2 不同部位鬼臼毒素含量比较
野生植株和栽培植株各个部位均含有鬼臼毒素,且各部位之间的鬼臼毒素含量差异较大,鬼臼毒素主要集中分布于根中。野生植株各部位鬼臼毒素的含量由高到低依次为:侧根>叶柄>根状茎>叶>果实。其中依据鬼臼毒素的含量,这5 个部位可以分为三组,即侧根、根状茎与叶柄、叶与果实,这三组之间的鬼臼毒素含量呈显著性差异,组内之间的鬼臼毒素含量差异不显著。侧根的鬼臼毒素含量最高,高达1.05%,是其它部位的6.2~35.0 倍。栽培植株各部位鬼臼毒素的含量由高到低依次为:根>叶柄>叶,各部位之间的鬼臼毒素含量均成显著性差异。根中的鬼臼毒素含量最高,达0.80%,是其它部位的3.0~11.4 倍。
可以看出鬼臼毒素在青海栽培和野生桃儿七植株内不同部位的分布均符合根>叶柄>叶,这与马绍宾(1997年)和白亚民(1988年)研究的关于野生桃儿七各器官鬼臼毒素含量的测定结果基本吻合[6,7]。由以上结果可以看出鬼臼毒素在桃儿七植株体内的分布由根到果实,鬼臼毒素的含量逐渐减少,这与生产上常于8~10 月份挖取其根及根状茎进行有效成分的提取和药品加工相符合[8]。
2.3 不同类型植株不同部位鬼臼毒素含量比较
栽培植株的叶柄和叶中鬼臼毒素的含量均比野生植株的含量高,其中栽培植株叶柄中鬼臼毒素的含量比野生植株高0.10%,是野生植株鬼臼毒素含量的1.6 倍;叶中鬼臼毒素的含量比野生植株高0.02%,是野生植株鬼臼毒素含量的1.4 倍。野生植株和栽培植株根中的鬼臼毒素含量在此实验中无法直接比较,但可以看出,栽培植株根中鬼臼毒素的含量也很高,结合叶和叶柄(茎)的含量,栽培植株在一定程度上可以替代野生植株进行鬼臼毒素方面的药品加工与制作从而满足医药市场的需求,进而缓解野生桃儿七的濒危现状。
2.4 不同部位4'-去甲基鬼臼毒素含量比较
桃儿七植株中4'-去甲基鬼臼毒素的含量在各个部位之间的含量差异较大。野生植株各部位4'-去甲基鬼臼毒素的含量由高到低依次为:侧根>叶柄>根状茎>叶,果实中未检测到4'-去甲基鬼臼毒素。侧根、叶柄与根状茎、叶三组之间4'-去甲基鬼臼毒素的含量呈显著性差异,叶柄和根状茎之间4'-去甲基鬼臼毒素的含量差异不显著。侧根中4'-去甲基鬼臼毒素含量最高,达0.06%,是其它部位的2.0~3.0 倍。除果实未检测到4'-去甲基鬼臼毒素外,4'-去甲基鬼臼毒素在野生植株各部位之间的分布与鬼臼毒素的分布特点基本相同,均为侧根>叶柄>根状茎>叶。栽培植株各部位4'-去甲基鬼臼毒素的含量表现为叶柄>根,叶中未检测到4'-去甲基鬼臼毒素,这与栽培植株各部位鬼臼毒素含量的分布特点有所不同。
2.5 不同类型植株不同部位4'-去甲基鬼臼毒素含量比较
栽培植株叶柄中4'-去甲基鬼臼毒素的含量比野生植株高0.06%,是野生植株叶柄中4'-去甲基鬼臼毒素含量的3 倍。二者根中4'-去甲基鬼臼毒素的含量在此无法直接比较,但可以看出栽培植株根中4'-去甲基鬼臼毒素的含量也比较高,介于野生植株侧根和根状茎中4'-去甲基鬼臼毒素的含量之间。野生植株叶中4'-去甲基鬼臼毒素的含量比较低,仅为0.01%,栽培植株叶中未检测到此物质。4'-去甲基鬼臼毒素在栽培植株和野生植株各部位的分布不甚相同,可能是由于受生长环境的不同和人工种植的影响而有所差异。
鬼臼毒素和4'-去甲基鬼臼毒素均属于木脂素类物质,是植物的次级代谢产物。鬼臼毒素具有高效抗癌活性,是合成抗癌药物VP-16、VM-26 等药物的前体物质。此实验中栽培植株叶柄中这2 种木脂素类成分的含量比野生植株的含量高,可能是受自然生长条件的影响。光照、温度、海拔、水等环境因素通过调节植物的生长发育影响有效成分的含量,使得同一时期不同地理条件下相同物种活性成分的含量也会出现较为明显的差异[9]。并且鬼臼毒素和4'-去甲基鬼臼毒素作为次级代谢产物,可能对植株主要起保护作用,在一定程度上与环境条件的优良成反比,即在环境越适宜植株生长的条件下含量可能越低,反之越高[10]。桃儿七适宜生长在山坡林下阴湿的地方,适宜在水分充足的条件下生存,此实验中可能是由于人工栽培地属于阳坡,蓄水能力较差,且光照比较强烈,对桃儿七的生长有一定的环境胁迫,从而使得栽培植株鬼臼毒素和4'-去甲基鬼臼毒素的含量相对较高。
3 结论
青海栽培与野生桃儿七植株鬼臼毒素在其不同部位的含量分布均表现为:根>叶柄>叶>果实,除了根的含量无法具体比较外,栽培植株叶柄和叶中鬼臼毒素的含量均大于野生植株。4'-去甲基鬼臼毒素在这2 种类型植株各部位的分布则有所不同,栽培植株叶柄中4'-去甲基鬼臼毒素的含量高于野生植株,是野生植株含量的3 倍,野生植株叶中虽检测到4'-去甲基鬼臼毒素,但其含量甚微,所以综合考虑鬼臼毒素和4'-去甲基鬼臼毒素,在这两种木脂素类成分的提取和药品加工上,栽培植株在一定程度上可以替代野生植株,从而缓解野生植株的濒危现状。
1 Zhao JF(赵继峰),Liu X(刘翔),Wang CH(王昌华),et al.Resources survey of rare and endangered medicinal plants Sinopodophyllum hexandrum (Royle)Ying.Chin J Chin Mater Med (中国中药杂志),2011,36:1255-1260.
2 Yuan JL(袁菊丽).Research progress in Sinopodophyllum emodi Wall.J Liaoning Univ TCM(辽宁中医药大学学报),2011,13(5):95-97.
3 Zhang ZT(张尊听),He Y(贺云),Liu QG(刘谦光),et al.Spectrophotometric determination of antioxidative activity of 20 kinds of Chinese traditional and herbal drugs in the Tai Bai mountain.Chin J Anal Lab(分析试验室),2002,21(2):50-52.
4 Lv LF(吕丽芬),Yuan LC(袁理春),Yang LY(杨丽云),et al.The important and endangered plant Sinopodophyllum hexandrum (Royle)Ying.Yunnan Agric Sci Technol (云南农业科技),2006,03:29-30.
5 Guo XW(郭孝武).A method to extract chemical components from Chinese herbs-ultrasonic method.Nat Prod Res Dev(天然产物研究与开发),1999,03:37-40.
6 Ma SB(马绍宾),Hu ZH(胡志浩),Li J(李俊).A priliminary study of the biochemical ecological adaptation of Sinopo-dophyllum hexandrum (RoyIe)Ying (Berberidaceae).Chin J Ecol (生态学杂志),1997,16(3):67-70.
7 Bai YM(白亚民),Xu JZ(徐建中).Determination of podophyllotoxin content in the root and rhizoma of Podophyllum emodi Wall.by HPLC.Bull Chin Mater Med(中药通报),1988,13(5):39-41.
8 Chinese Herbalism Editorial Board,State Administration of Traditional Chinese Medicine of the People's Republic of China(国家中医药管理局《中华本草》编委会).Chinese herbal medicine (Tibetan volumes)(中华本草藏药卷).Shanghai:Shanghai Science and Technology House,2002.265-267.
9 Gao WW(高薇薇),Tong JM(佟建明),Guo SX(郭顺星).Advances in ecological function of plant secondary metabolites.Chin Pharm J (中国药学杂志),2006,13:961-964.
10 Su WH(苏文华),Zhang GF(张光飞),Li XH(李秀华),et al.Relationship between accumulation of secondary metabolism in medicinal plant and environmental condition.Chin Tradit Herb Drug(中草药),2005,36:1415-1418.

