壳聚糖缓释体系研究进展*
金 政,刘美华,刘振梅,赵东宇,白续铎,赵 凯
(1.黑龙江大学,黑龙江 哈尔滨150080;2.浙江大学,浙江 杭州310058)
壳聚糖缓释体系研究进展*
金 政1,刘美华1,刘振梅2,赵东宇1,白续铎1,赵 凯1
(1.黑龙江大学,黑龙江 哈尔滨150080;2.浙江大学,浙江 杭州310058)
综述了壳聚糖在缓释系统方面的最新研究进展。包括壳聚糖衍生物缓释体系的研究、壳聚糖缓释体系在医药系统的应用和吸附-控释复合体系的研究,重点介绍了壳聚糖衍生物缓释体系的研究,壳聚糖衍生物缓释体系分为壳聚糖衍生物缓释微球、壳聚糖纳米粒、壳聚糖缓释片、壳聚糖缓释微囊、壳聚糖缓释膜和壳聚糖水凝胶缓释体的研究等六个部分。壳聚糖缓释体系作为一项新技术在医药体系具有广泛的应用前景。
壳聚糖;缓释;制备;应用
前言
壳聚糖因其优良的生物相容性、环境友好、可降解性和成分可控性在医药、工程和建筑等行业得到广泛的应用。通过衍生物制备和可控系统的优化等方法,改善了壳聚糖的吸附性能、可降解性能和缓释性能,拓宽了其应用领域和范围。壳聚糖缓释体系的研究提高了被承载试剂的释放时间,尤其是在医药领域,通过壳聚糖缓释膜可以控制药物的释放和靶向传输,以达到增强药效、降低毒性、延长给药时间甚至改变药物的体内过程等目的。
1 壳聚糖衍生物缓释体系的研究
1.1 壳聚糖衍生物缓释微球的研究
壳聚糖缓释微球外观呈圆形、表面光滑、分散良好,具有较好的缓释效果,是缓释体系的研究热点之一。
易兵鸿等[1]采用乳化-化学交联法,制备5-氟脲嘧啶壳聚糖缓释微球,并观察该微球的形态、粒径、药物包封率和在体外药物缓释作用。结果表明5-氟脲嘧啶壳聚糖缓释微球的平均粒径为(185.5±15.0)nm,包封率为(49.3±2.1)%,在pH 7.4 PBS缓冲溶液中对5-氟脲嘧啶的累计释放率第1天为(61.6±1.8)%,第3天为(78.2±1.6)%,第7天为(90.5±1.4)%,所制备的5-氟脲嘧啶壳聚糖缓释微球具有良好的药物包封率和体外释放作用,符合缓释药物的制备要求。
周莉等[2]采用乳化交联法制备阿司匹林-壳聚糖缓释凝胶微球,通过透析实验检测微球的体外释放特性。应用正交实验设计,考察了壳聚糖浓度,搅拌速度,阿司匹林/壳聚糖质量比,交联时间对微球制备的影响。体外释放实验表明,壳聚糖微球前5 h的释放符合SRP的释药行为。以5 h的体外释放总量为指标进行直观分析,交联时间对体外释放总量影响最大。
杨亚冬等[3]将壳聚糖溶解在2%乙酸中,利用吐温-80作为乳化剂,多聚磷酸钠作为交联剂,以乳化交联法制备载有转化生长因子β1的壳聚糖微球;同时制作空壳聚糖微球以及包裹牛血清白蛋白的壳聚糖微球作为空白对照和实验对照,对获得的3种冻干微球的形态,直径大小进行观察,对转化生长因子β1壳聚糖微球的分散情况及所载药物的体外释放情况进行检测,并测定空壳聚糖微球及包裹牛血清白蛋白壳聚糖微球的吸水膨胀率后发现空壳聚糖微球直径约15μm,表面光滑,有较多微小孔隙,而包裹了牛血清白蛋白及转化生长因子β1的壳聚糖缓释微球直径约为1μm,大小较均一,表面光滑;包裹了转化生长因子β1的壳聚糖微球在释放实验中前12h内释放速度较快,随后趋于平缓。6天内微球的转化生长因子β1释放率为53.5%。
赵书言等[4]以壳聚糖、戊二醛、尿素为主要原料,采用乳化—化学交联法制备尿素—壳聚糖缓释微球,通过红外光谱测试分析缓释微球的结构特征;通过扫描电镜测试,观察微球的微观形貌;通过交联度测试确定戊二醛的最佳用量;通过缓释测试,测定壳聚糖微球的缓释效果;结果表明采用乳化—化学交联法制备尿素—壳聚糖缓释微球的交联剂最佳用量为1mL,缓释微球中尿素在48h后基本缓释完全,表明制备的缓释微球有良好的缓释效果。
钱俊青等[5]以壳聚糖为基质,对左氧氟沙星缓释微球的制备方法进行了探索。确定了左氧氟沙星-壳聚糖缓释微球的制备工艺条件。通过考察微球的载药量及累积释放度,对上述制备方法工艺中的壳聚糖与盐酸左氧氟沙星的质量比、乳化剂Span用量、溶剂与壳聚糖溶液的体积比、交联剂戊二醛用量等因素进行了优化,制备出了具较好缓释效果的盐酸左氧氟沙星-壳聚糖缓释微球,该方法制备的左氧氟沙星-壳聚糖缓释微球载药量为43.88%,体外累积释放度的线形关系良好。
高春凤等[6]以壳聚糖和海藻酸钠为载体制备雷公藤多苷提取物缓释微球,考察载体材料对雷公藤多苷提取物的载药量、包封率及释放行为的影响,发现了海藻酸钠的浓度、壳聚糖的浓度、氯化钙的浓度及海藻酸钠和壳聚糖的比例对包封率、载药量和体外释放均有一定的影响,而交联固化时间对包封率和载药量有影响,对体外释放影响不明显,并得到缓释效果最佳的缓释微球的制备工艺为壳聚糖、海藻酸钠、氯化钙的质量浓度依次为10、10、30 g·L-1;海藻酸钠与药物的质量比为1∶1,预交联时间为30 min,继续交联2 h。
罗华丽[7]以壳聚糖为载体主材,分别采用反相悬浮交联法,应用胺醛缩合、醇醛缩合原理和化学聚合技术,分别制备了壳聚糖载药缓释微球,壳聚糖和聚乙烯醇物理共混载药缓释微球、壳聚糖交联聚乙烯醇载药缓释微球、壳聚糖一聚丙烯酸一聚乙二醇三元复合缓释微球,探讨了醋酸浓度、壳聚糖浓度、壳聚糖脱乙酞度、乳化剂用量、油水比、交联密度、反应时间、搅拌、药物/基材比等因素对微球平均粒径和粒径分散度、载药浓度、缓释性能的影响。
叶漫文等[8]以丝素蛋白、壳聚糖和京尼平作为合成微球的生物材料,研制新颖的缓释微球,并以牛血清白蛋白作为模型药物包载,对其表观、理化性能和缓释效能进行评价,发现丝素蛋白-壳聚糖微球比单纯的壳聚糖微球的包封率和载药率要低一些,但是微球初期包载物的爆释量比单纯壳聚糖微球要低,丝素蛋白/壳聚糖微球的缓释性能比单纯的壳聚糖微球要更加平稳。
Ye Wang等[9]开发了新型的PLGA-海藻酸-壳聚糖复合微球缓释体系,通过体外释放试验表明,该体系不仅可以延长药物的释放也能降低爆释量。
Neha Arya等[10]研究了高电压喷雾法制备壳聚糖的相关参数,通过该方法可制备微米到纳米级的壳聚糖球,而Shwu Jen Chang等[11]也采用该方法制备了壳聚糖微球,并研究了微球制备条件对其缓释效果的可控性。
张宏其等[12]用喷雾干燥法制备异烟肼-壳聚糖微球,进行体外45天的药物释放实验。将单独装载异烟肼的异体骨块(对照组)和装载异烟肼-壳聚糖微球的异体骨块(实验组)分别植入家兔两侧髂骨,采用高效液相色谱法检测药物体内释放情况。结果表明,异烟肼-壳聚糖微球外观呈圆形、表面光滑、分散良好;平均粒径(3.33±0.9)μm,载药率(16.25±1.24)%,体外药物释放实验显示无突释现象,24 h释放20%左右,45天释放76%,释放曲线较平缓,释放稳定;数学模型拟合符合Ritger-Peppas模型。
Radhakumary Changerath等[13]采用壳聚糖和PMMA接枝壳聚糖混合物制备载药微球,研究结果表明壳聚糖/PMMA接枝壳聚糖氨苄西林载药微球比单纯壳聚糖微球具有更好的缓释效果和生物活性。
1.2 壳聚糖纳米粒的研究
在生物医药领域,纳米颗粒的研究主要集中于药物的控制释放和靶向,以达到增强药效、降低毒性和改变药物的体内过程等目的。纳米颗粒药物传递系统作为抗肿瘤药物载体用于化疗,以及在蛋白、多肽类药物和疫苗传递等方面具有广泛的应用前景[14]。YapingHou等[15]通过离子交联法制备了壳聚糖-三聚磷酸盐-硫酸软骨素纳米粒,研究其对蛋白质的控制释放。研究结果表明,该复合纳米粒具有良好的缓释效果,并可通过交联组分的增加提高其缓释效果。
Dharmendra Jain等[16]研究了壳聚糖纳米粒等五种不同的缓释体系对抗生素的缓释性能研究。结果表明,药物释放规律复合Higuchi模型,CS纳米颗粒可以作为有前途的环丙沙星缓释剂用于治疗传染性疾病。
肖作兵等[17]以壳聚糖和三聚磷酸钠为载体用离子凝聚法制备了一系列的纳米香精,其形成主要靠正负电荷间的吸引作用,利用无毒副作用的三聚磷酸钠对壳聚糖进行离子诱导凝胶化而制备纳米粒。壳聚糖是一种天然的阳离子聚合物,其中含有亲水性的羟基和在一定条件下质子化的氨基。在适宜的条件下,它与带有阴离子的三聚磷酸钠作用可形成纳米级聚电解质复合物,并把香精包裹在其中。以薄荷纳米香精为例,将壳聚糖溶解在冰醋酸水溶液中,得到透明均匀的溶液;将三聚磷酸钠、乳化剂和薄荷香精按一定比例混合乳化,在搅拌的条件下,将乳化液滴加到壳聚糖醋酸溶液中,两相经聚离子凝聚反应后制得壳聚糖—三聚磷酸钠纳米薄荷香精溶液,其最优条件下的粒径约为92nm。
Emmanuel Robles等[18]采用壳聚糖制备壳聚糖胰岛素纳米粒,研究了其在不同pH值下的缓释效果。研究结果表明,壳聚糖对胰岛素具有良好的缓释效果,且疏水化壳聚糖比未改性的壳聚糖具有更好的缓释效果。
VUK USKOKOVIC等[19]采用超声辅助法将羟基磷灰石和壳聚糖制备成复合纳米粒,并对纳米粒原子尺度微观结构、表面电荷、药物释放特性和抑菌性等方面进行了研究,结果表明,因为复合纳米粒更低的抑菌效果和细胞反应,使其相对壳聚糖对成骨细胞的影响有更好的补偿效果。
1.3 壳聚糖缓释片的研究
杨红梅等[20]以壳聚糖作为骨架材料制备阿司匹林缓释片并进行体外释放度实验。自制的阿司匹林壳聚糖缓释片在1h、2h、4h、6h、8h、10h的体外释放度为(18.60±0.88)%、(35.58±2.15)%、(60.22± 1.07)%、(80.66±1.64)%、(98.53±1.15)%、(98. 55±1.76)%,药物的体外释放模型符合Higuchi方程。
陈丽等[21]以壳聚糖、阿拉伯胶和淀粉为辅料制备芦丁壳聚糖缓释片,以正交设计法进行处方筛选,用释放度实验考察芦丁壳聚糖缓释片不同释放时间的溶出参数,发现壳聚糖缓释效果良好,可作为芦丁缓释片的缓释辅料,该片剂处方设计合理,制备工艺简单易行。
M.EFENTAKIS等[22]研究了可溶性树脂或乙基纤维素对壳聚糖乳酸混合缓释片尺寸变化、凝胶进化、胀大和溶剂浸蚀性的影响。研究结果表明,可溶性树脂比乙基纤维素更有利于提高壳聚糖乳酸混合缓释片的尺寸变化、凝胶进化、胀大和溶剂浸蚀性,该研究有利于制备具有持续释放效果的缓冲聚合物复合体系。
1.4 壳聚糖缓释微囊的研究
壳聚糖缓释微囊方面的研究也同样令人瞩目,如钱颖[23]采用壳聚糖-海藻酸钠包埋体系和自主研发的离心筛制粒机制备茶色素一壳聚糖缓释微囊,并测定了缓释微囊的载药量、包封率和累积释放度,制备的茶色素一壳聚糖缓释微囊的球形度及光洁度良好,载药量和包封率分别为20.2%~27.1%和39.7%~54.4%,在pH6.8模拟肠液的条件下经24h达到99.7%释放;而在pH 1.0模拟胃液的的条件下释放度小于10%,具有非常优越的定位释放特性,缓释微囊在实验动物体内具有一定的调脂作用,符合临床要求。
顾杰波等[24]采用凝聚法以自制离心筛制粒机制备了谷维素-壳聚糖缓释微囊,并考察了产品的载药量和包封率,实验制备的谷维素-壳聚糖缓释微囊载药量为47.68%,包封率为76.45%,微囊大小均匀、光洁度与成形度好,谷维素-壳聚糖缓释微囊具有进一步开发和应用价值。
研究已经证实,纳米胶囊具有一些独特的性质,例如在最早应用的医药领域,纳米胶囊就具有良好的靶向性和缓释作用、提高药物生物利用率、降低毒副作用等,为寻找和开发新药物剂型提供了强大,有力的技术支持[25]。目前纳米胶囊的各种研究成果层出不穷,逐渐成为了一项引人注目的高新技术,其应用也已迅速扩大到医药、食品、化妆品、农药、石油产品等众多领域。
吕翠翠[26]等人利用羟丙基-β-环糊精内疏水外亲水的空腔结构对东方琥珀玫瑰香精进行包合,得到了平均粒径为72.8nm的不规则圆形纳米胶囊。但该方法的应用对象存在一定的局限性,受到包埋物质的分子大小和极性影响,并非所有物质都能与之络合,分子空腔的大小也限制了香精的载量。
陈岩等[27]在乳液体系下采用两步原位聚合法,以尿素和甲醛为壁材,檀香香精为芯材,制备了纳米香精胶囊,并研究了固含量、壁芯比、乳化香精粒径对纳米胶囊粒径的影响。实验表明,当体系固体质量分数小于1%,壁芯比为(2~5)∶1,乳化香精粒径为50~200nm时可制得粒径分布均匀的纳米粒径微胶囊。
Lu J等[28]以正硅酸乙酯和壳聚糖作为纳米包囊壁材,采用溶胶凝胶法制备了二氧化硅-壳聚糖溶胶,将香精包囊在纳米硅基氧化物和壳聚糖形成的三维结构载体内。其操作步骤是:将一定配比的香精、表面活性剂、乙醇混合均匀并乳化10~30min,向该乳化香精中加入适当配比的正硅酸乙酯和盐酸溶液,快速搅拌反应1.5~3h,得到硅溶胶体系,最后加入相应配比的壳聚糖水溶液,快速搅拌反应0.5~2h,得到纳米香精,平均粒径约50~200nm,缓释性、热稳定性良好。该方法工艺简单,设备条件要求不高,但由于所用原料的关系,制得的纳米香精应用范围也有一定局限性,一般用于日化领域而不能用于食品中。
1.5 壳聚糖缓释膜的研究
季娟娟[29]以24h溶胀度为评价指标,设计单因素试验和正交试验,确定出制备壳聚糖缓释膜的最佳参数组合,用其制备壳聚糖缓释膜,并将牛血清白蛋白(BSA)作为蛋白质药物模型包入其中,用考马斯亮蓝法检测膜在第1、2、4、6、8天的释放率,发现壳聚糖缓释膜具有良好的缓释能力。采用溶菌酶对壳聚糖缓释膜进行体外降解实验证明,该膜具有良好的可降解性;通过对成骨细胞的细胞毒性试验,确定该材料具有良好的生物相容性。
陈红叶[30]通过调变各种反应条件及加入甘油、正庚烷、柠檬酸三正丁酯、聚乙烯醇和戊二醛等共混改性辅料来改善壳聚糖缓释膜的性能,发现戊二醛加入量为0.22%时SDS每次溶出量大小适中,且基本保持一致,膜的缓释效果最明显;加入正庚烷或柠檬酸三正丁酯能有效地提高交联膜的SDS单次溶出量;加入甘油能有效地提高膜的抗酸稳定性;加入聚乙烯醇能有效改善膜的表面平滑性,壳聚糖缓释膜包覆的洗衣球,综合缓释性能均比商业洗衣球的更好。
刘利萍等[31]在碱性介质中,卤代烷与壳聚糖分子中的氨基反应得到烷基化壳聚糖,并测定其对模型药物5-Fu的渗透性能,发现,取代反应主要发生在壳聚糖分子的氨基上,在pH≤7.4的缓冲溶液中,烷基化壳聚糖膜对5-Fu的渗透系数的影响随着烷基链长的增长而减小,烷基化壳聚糖对5-Fu的缓释作用优于壳聚糖。
Barbara Blanco-Fernandez等[32]采用乳化铸造溶解过程制备壳聚糖膜,通过对5种维生素E的缓释和保护作用进行研究,结果表明,壳聚糖制备维生素E的缓释膜具有良好的抗氧化和缓释效果。
1.6 壳聚糖水凝胶缓释体的研究
凝胶缓释体,指药物等被承载体与适宜基质制成的具有凝胶特性的半固体或稠厚液体制剂[33]。水凝胶具有良好的亲水性,充分膨胀后具有与机体组织相似的物理性质,如柔软、有弹性、与生物液之间的界面张力低等。另外,水凝胶还具有孔径、机械强度和尺寸可调性等优点,适于作为药物控制释放的载体形式。壳聚糖是一种天然高分子材料,具有生物活性、良好的生物相容性、可完全降解性及无毒性等优点,是良好的药物控制释放载体材料。以壳聚糖为基材,通过物理方法或化学方法,可制备出pH敏感型、温敏型、光敏型等多种形式不同性能的水凝胶[34]。因此壳聚糖水凝胶缓释体系得到了广泛的研究。
陈建澍,等[35]为了得到水溶性佳、毒性低的N-琥珀酰壳聚糖,改进了其合成工艺,并将其共混海藻酸钠制备出性能优良的水凝胶。研究结果表明,在不使用吡啶的条件下,用丁二酸酐酰化壳聚糖,可制得水溶性较高的N-琥珀酰壳聚糖。在底物质量比为1∶2,50℃条件下反应4h,产物水溶性最佳,达到9.70g/L,用合成的N-琥珀酰壳聚糖与海藻酸钠共混,在相对分子质量比为1∶3时,制得结构优良的水凝胶,其溶胀率和水蒸气透过率分别达到557.9%和2954.6 g/(m2·d),且无皮肤刺激性,该水凝胶具有进一步开发成一种优良敷料的研究价值。
FWU-LONG MI等[36]采用聚电解质络合方法以酶水解壳聚糖为原材料制备壳聚糖-三聚磷酸盐凝胶珠和壳聚糖多磷酸凝胶珠,并研究其对抗癌剂6-MP的缓释效果,壳聚糖凝胶珠的胀大pH响应性、药物释放特性和壳聚糖凝胶珠的形态取决于聚电解质络合机制和酶水解壳聚糖的相对分子质量,壳聚糖凝胶珠的聚电解质络合机理是离子交联,壳聚糖凝胶珠在pH值6.8时的似乎基于扩散,可能按照Higuchi模型,而聚磷酸凝胶珠在pH值1.2时的药物释放模式,似乎是由于溶胀或基体浸蚀而产生的non-Fickian扩散控制。研究结果表明,壳聚糖多磷酸凝胶珠在模拟肠道和胃液中是一种比壳聚糖-三聚磷酸盐凝胶珠更好的聚合物载体持续释放抗癌药物。
Sungwoo Kim等[37]研究了壳聚糖凝胶对骨形成蛋白的缓释性能。研究结果表明,壳聚糖凝胶可以控制骨形成蛋白的释放和钙矿沉积效果,而且对不同类型的细胞影响的效果不同。
2 壳聚糖缓释体系在医药系统的应用
易兵鸿[38]采用乳化化学交联法制备5-氟脲嘧啶壳聚糖缓释微球,用于胃癌治疗研究。研究结果表明,5-氟脲嘧啶壳聚糖缓释微球粒径分布均匀,具有较好的药物包封率及药物缓释性,用于胃癌腹腔化疗可明显抑制祼鼠腹腔种植胃癌细胞的生长,改善胃癌细胞腹腔种植祼鼠的预后。
刘朝阳等[39]探讨生物可降解氟尿嘧啶壳聚糖注射胶用于肿瘤内局部给药的抗肿瘤活性,为临床应用提供实验依据。结果表明,瘤内注射氟尿嘧啶壳聚糖缓释液组小鼠肿瘤生长缓慢,瘤体明显小于氟尿嘧啶腹腔注射给药组,并呈现良好的量效关系。瘤内应用氟尿嘧啶壳聚糖缓释剂的抗肿瘤效果明显优于局部和全身单纯氟尿嘧啶给药,具有重要研发价值。
杨红梅,等[40]采用随机分组自身对照实验,分别给予家兔口服阿司匹林壳聚糖缓释片和阿司匹林肠溶片,研究阿司匹林壳聚糖缓释片的体内药物动力学,结果表明,阿司匹林壳聚糖缓释片在家兔体内有缓释特征,可望为预防和治疗血栓形成提供一个新的剂型。
秦帅[41]探索GICS-TA植入脉络膜上腔防治外伤性aPVR的有效性,比较壳聚糖缓释给药系统植入脉络膜上腔与玻璃体腔注射曲安奈德防治外伤性眼部增生性玻璃体视网膜病变的疗效,结果显示壳聚糖缓释给药系统(载药曲安奈德)和玻璃体注射曲安奈德均能够有效的预防aPVR的发生,并且壳聚糖缓释给药系统防治前部PVR的效果优于玻璃体注射曲安奈德。
孟丽娜[42]以壳聚糖作为药物载体,环丙沙星作为研究药物,以羟乙基纤维素作为缓释微球的辅料,应用乳化交联法制备环丙沙星壳聚糖缓释微球,并对其粒径、粒径分布、载药量、包封率、通针性、降解度、肺部滞留性、缓释性、安全性等方面进行评价,进而评估其经支气管镜介入给药的可行性,以期达到环丙沙星肺部缓慢持续释放,减少给药次数,提高患者的依从性。
Hong-Ru Lin等[43]采用具有核壳结构的普兰尼克-壳聚糖纳米胶束缓冲体系对美替卜拉格的承载和缓冲效果进行研究。研究结果表明,该胶束体系载药率可达到83%,并具有良好的缓释效果,可以显著延长药物释放时间,降低用药次数。
3 吸附-控释复合体系的研究
李世成等[44]采用乳化交联法成功地制备出形貌好、去除Cu2+能力强的壳聚糖/羟基磷灰石复合材料,用SEM对其形貌进行了表征,并研究了其对水体中Cu2+的吸附行为,研究结果表明,复合材料为表面粗糙、粒径为微米级的规则球形颗粒,并有类网球的结构,复合材料在Cu2+溶液中180 min时达到吸附平衡,吸附能力明显强于改性前的壳聚糖单体的吸附能力,吸附符合准二级动力学方程和Freundlich等温吸附模型。
何为媛等[45]采用批处理等温吸附-解吸试验,研究了初始Cu2+浓度、壳聚糖用量、吸附时间、pH值和温度等单因子对壳聚糖吸附Cu2+的影响,在此基础上采用正交试验获得最优吸附条件为壳聚糖用量0.025g/L,温度35℃,吸附时间60min初始Cu2+浓度为1000mg/L,得出最大吸附量为256mg/L;因子影响排序由大到小为:壳聚糖用量,温度,初始Cu2+浓度,吸附时间,吸附铜后的壳聚糖,制作壳聚糖载铜灭藻剂(CCA),其Cu2+释放动力学特征可用Elovich方程、Langmuir方程和二级动力学方程加以描述。
张正红,等[46]针对鸟粪石结晶法回收沼液中氨氮和磷酸盐时生成的晶体细小、不易与水分离等问题,采用鸟粪石结晶法和改性壳聚糖絮凝剂相结合的工艺处理沼液,同步富集回收沼液中氮、磷及各种有机质,研究了pH值、反应物的物质的量比、搅拌速度、反应时间等因素对沼液中氨氮、总磷和COD去除效果的影响,考察了改性壳聚糖絮凝剂的优化反应条件,并对富集物的成分做了较全面分析。
4 结 语
壳聚糖衍生物缓释体系的研究是当前相关领域的研究热点之一,壳聚糖衍生物缓释体系可分为壳聚糖衍生物缓释微球、壳聚糖纳米粒、壳聚糖缓释片、壳聚糖缓释微囊、壳聚糖缓释膜和壳聚糖水凝胶缓释体的研究等六部分。随着新型壳聚糖衍生物缓释体系制备及改性方法的研究开发,壳聚糖衍生物缓释体系的应用也将会越来越广泛。
[1] 易兵鸿,谢小平,李正荣,等.5-氟脲嘧啶壳聚糖缓释微球的制备及其体外药物缓释性观察[J].实用临床医学,2010,11(3):4~7.
[2] 周莉,吴奕光,罗仲宽,等.阿司匹林-壳聚糖缓释微球的制备和释药性能研究[J].广东化工,2010,37(2):197~199.
[3] 杨亚冬,张文元,房国坚.包裹转化生长因子β1壳聚糖缓释微球的研制[J].中国组织工程研究与临床康复,2009,13(38): 7481~7484.
[4] 赵书言,周浩然,赵蕊.壳聚糖缓释微球的制备与表征[J].化学与黏合,2011,33(2):35~38.
[5] 钱俊青,马月珍.壳聚糖为基质的左氧氟沙星缓释微球制备[J].浙江工业大学学报,2004,32(1):20~24.
[6] 高春凤,赵秀丽,李新刚,等.雷公藤多苷提取物壳聚糖-海藻酸钠缓释微球的制备及体外释放研究[J].中国药剂学杂志, 2009,7(5):382~390.
[7] 罗华丽.医用壳聚糖缓释材料研究[D].山东大学,硕士论文, 2007.
[8] 叶漫文.丝素蛋白-壳聚糖缓释微球的制备与表征[D].南方医科大学,硕士论文,2011.
[9] WANGYE,GAOJIAN-QING,ZHENGCAI-HONG,etal.Biodegradable and Complexed Microspheres Used for Sustained Delivery and Activity Protection of SOD[J].Journal of Biomedical Materials Research Part B:Applied Biomaterials,2006,9(1):74~8.
[10] NEHA ARYA,SYANDAN CHAKRABORTY,NIKHIL DUBE,et al.Electrospraying:A Facile Technique for Synthesis of Chitosan-Based Micro/Nanospheres for Drug Delivery Applications[J].J.Biomed Mater Res.Part B:Appl.Biomater,2009,88: 17~31.
[11] SHWU JEN CHANG,GREGORY CHENG-CHIE NIU,SHYH MING KUO,et al.Preparation and preliminary characterization of concentric multi-walled chitosan microspheres[J].J.Biomed Mater Res.,2007,81:554~566.
[12] 张宏其,高琪乐,郭虎兵,等.人同种异体骨载异烟肼-壳聚糖缓释微球的制备和体内外释药特性[J].中国组织工程研究, 2012,16(3):479~483.
[13] RADHAKUMARY CHANGERATH,PRABHA D NAIR,SURESH MATHEW,et al.Poly(methyl methacrylate)-Grafted Chitosan Microspheres for Controlled Release of Ampicillin[J].J.Biomed Mater Res.PartB:Appl Biomater,2009,89:65~76.
[14] 高萍,张向荣,徐辉,等.纳米颗粒的修饰及其在医药领域的应用[J].中国药剂学杂志,2004,2(6):147~155.
[15] HOU YAPING,HU JUNLI,PARK HYEJIN,et al.Chitosan-based nanoparticles as a sustained protein release carrier for tissue engineering applications[J].J.Biomed Mater Res.Part A,2014,100: 939~947.
[16] JAINDHARMENDRA,BANERJEER.ComparisonofCiprofloxacin Hydrochloride-Loaded Protein,Lipid,and Chitosan NanoparticlesforDrugDelivery[J].J.BiomedMaterRes.PartB:Appl.Biomater 2008,86:105~112.
[17] 肖作兵,邵莹莹.薄荷纳米香精的制备技术研究[J].香精香料化妆品,2008,6(3):44~48.
[18] EMMANUEL ROBLES,EVA VILLAR,MANUEL ALATORREMEDA,et al.Effects of the Hydrophobization on Chitosan-Insulin Nanoparticles Obtained by an Alkylation Reaction on Chitosan[J].J.Appl.Polym.Sci.,2013,129:822~834.
[19] VUK USKOKOVIC',TEJAL A DESAI.In Vitro Analysis of Nanoparticulate Hydroxyapatite/Chitosan Composites as Potential Drug Delivery Platforms for the Sustained Release of Antibiotics in the Treatment of Osteomyelitis[J].J.Pharm Sci.,2014, 103:567~579.
[20] 杨红梅,陈旭,赵坤杰.阿司匹林壳聚糖缓释片的体外释放度研究[J].河南大学学报,2005,24(1):37~38.
[21] 陈丽,葛为公,裴世成,等.芦丁壳聚糖缓释片处方设计及体外释放度测定[J].解放军药学学报,2011,27(2):135~137.
[22] EFENTAKIS M,STAMOYLIS K.A study of dimensional,swelling, and gel changes in hydrophilic and hydrophobic polymer mixtures of chitosan and their possible use as carriers for sustained release drug delivery[J].Advances in Polymer Technology,2011, 30(2):110~121.
[23] 钱颖.茶色素-壳聚糖缓释微嚢的制备及其药效学研究[D].硕士论文,浙江工商大学,2012.
[24] 顾杰波,范春雷,胡林峰,等.谷维素-壳聚糖缓释微囊的制备[J].中国组织工程研究与临床康复,2011,15(8):1402~1404.
[25] 邓晶晶,彭姣凤.纳米香精的制备和应用研究进展[J].中国食品添加剂开发应用,2014,03:188~193.
[26] 吕翠翠,肖作兵,冯涛.2羟丙基-β-环糊精/玫瑰香精纳米胶囊制备工艺的优化[J].食品与生物技术学报,2011,30(6): 843~851.
[27] 陈岩,易封萍,肖作兵.响应面法优化纳米UF香精微胶囊工艺[J].精细化工,2013,30(1):51~55.
[28] LU J,VIWAT S,LU S M.Nano-flavor and preparation method thereof:WO,2013004003 A1[P].2013-1-10.
[29] 季娟娟.壳聚糖缓释膜的制备及其对成骨细胞的毒性研究[D].昆明医学院,硕士论文,2007.
[30] 陈红叶.壳聚糖缓释膜共混改性的研究及其在洗涤用品中的应用.[D].广东工业大学,硕士论文,2014.
[31] 刘利萍,鲁越青.药物缓释载体烷基化壳聚糖的性能研究[J].中国药剂学杂志,2005,3(2):67~70.
[32] BARBARA BLANCO-FERNANDEZ,MARIA ISABEL RIALHERMIDA,CARMEN ALVAREZ-LORENZO,et al.Edible Chitosan/Acetylated Monoglyceride Films for Prolonged Release of Vitamin E and Antioxidant Activity[J].J.Appl.Polym.Sci., 2013,129:626~635.
[33] 黄莹.天然药物凝胶剂研究进展[J].中国民族民间医药, 2014,15(3):35~40.
[34] 曾敬,康艳红,田鹏,等.壳聚糖基水凝胶药物控制释放体系[J].沈阳师范大学学报,2014,32(3):349~353.
[35] 陈建澍,章琪良,李志旗,等.水溶性N-琥珀酰壳聚糖合成及其共混海藻酸钠水凝胶特性评价[J].浙江工业大学学报,2014,42(1):58~62.
[36] MI FWU-LONG,SHYU SHIN-SHING,KUAN CHIH-YANG,et al.Chitosan-Polyelectrolyte complexation for the preparation of gel beads and controlled release of anticancer drug.I.Effect of phosphorous polyelectrolyte complex and enzymatic hydrolysis of polymer[J].Journal of Applied Polymer Science,1999,74:1868~1879.
[37] KIM SUNGWOO,TSAO HELEN,KANG YUNQING,et al.In vitro evaluation of an injectable chitosan gel for sustained local delivery of BMP-2 for osteoblastic differentiation[J].J.Biomed Mater Res.Part B:Appl.Biomater,2011,99:380~390.
[38] 易兵鸿.5-氟脲嘧啶壳聚糖缓释微球抑制裸鼠腹腔种植胃癌细胞生长的实验研究[D].硕士论文,南昌大学医学院,2010.
[39] 刘朝阳,傅军,田海梅,等.氟尿嘧啶壳聚糖缓释剂瘤内注射治疗小鼠肝癌的实验研究[J].癌症进展杂志,2005,3(2):173~180.
[40] 杨红梅,陈旭,赵坤杰.阿司匹林壳聚糖缓释片兔体内药物动力学研究[J].西北药学杂志,2004,19(5):214~215.
[41] 秦帅.壳聚糖缓释给药系统植入脉络膜上腔防治外伤性aPVR[D].南方医科大学,硕士论文,2012.
[42] 孟丽娜.环丙沙星壳聚糖缓释微球肺部靶向给药系统的研究[D].博士论文,北京市结核病胸部肿瘤研究所,2013.
[43] LIN HONG-RU,CHANG PEI-CSANG.Novel pluronic-chitosan micelle as an ocular delivery system[J].J.Biomed Mater Res.Part B:Appl Biomater,2013,101:689~699.
[44] 李世成,薛文平,董晓丽,等.壳聚糖/羟基磷灰石复合材料对Cu2+的吸附性能[J].环境科学与技术,2014,37(7):88~91.
[45] 何为媛,杨志敏,陈玉成,等.壳聚糖对Cu2+的吸附-解吸及其载铜灭藻剂的研制[J].西南师范大学学报,2014,39(8):31~35.
[46] 张正红,向天勇,单胜道.鸟粪石结晶-絮凝同步处理沼液实验研究[J].中国沼气,2014,32(4):29~33.
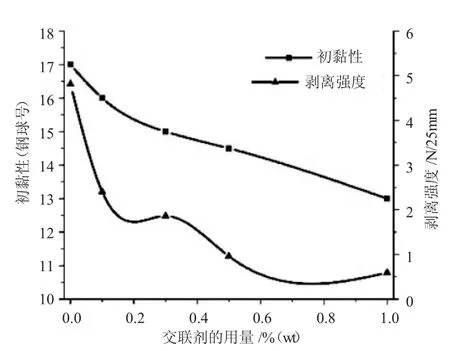
图5 交联剂的用量对丙烯酸乳液压敏胶性能的影响Fig.5 The effect of crosslinking agent content on properties of acrylic emulsion pressure sensitive adhesive
3 结论
综上所述,实验采用预乳化聚合工艺获得乳液型丙烯酸压敏胶适宜的反应条件为:单体BA/EHA的质量比为45∶45,引发剂的用量为0.15%(wt)~0. 2%(wt),乳化剂的用量为0.8%(wt)~1.0%(wt),交联剂的用量为 0.1%(wt)~0.3%(wt),反应温度为82~85℃。
参考文献:
[1] 陈昌杰.功能性薄膜之三—表面保护膜[J].塑料包装,2007(4): 8~14.
[2] 马红霞,李耀仓,雷木生.保护膜用丙烯酸酯乳液压敏胶的制备木[J].广州化工,2013,41(13):86~88.
[3] 李耀仓,马红霞,罗凡.悬浮聚合法制备微球状压敏胶的研究[J].中国胶黏剂,2011,20(12):38~41.
[4] 张露露,刘其城.水溶性压敏胶的合成[J].湖北化工,2000(2): 20~22.
[5] 吴汝林,亓帅.丙烯酸酯系水溶性压敏胶的制备及性能研究[J].中国胶黏剂,2009,18(1):35~39.
[6] 毛胜华,姚小龙,冯小平,等.保护膜用高剥离力丙烯酸酯乳液压敏胶的研制[J].化学与黏合,2009,31(4):47~49.
[7] 曹同玉,刘庆普,胡金生.聚合物乳液合成原理及应用[M].北京:化学工业出版社,1997:361.
[8] 唐中华,唐敏锋,范晓东.聚丙烯酸酯乳液粒度及其压敏胶粘性的研究[J].中国胶粘剂,2005.14(8):13~17.
[9] 历蕾,颜悦.丙烯酸树脂及其应用[M].北京:化学工业出版社, 2012:41~44.
[10] H瓦尔森,C A芬奇.聚合物乳液基础及其在胶黏剂中的应用[M].北京:化学工业出版社,2004:95~99.
[11] 潘祖仁.高分子化学[M].北京:化学工业出版社,2009:143~152.
[12] 杨明成,朱军,党从军,等.丙烯酸酯乳液型压敏胶的制备及性能研究[J].河南科学,2001,19(4):366~368.
[13] 柳彬彬,向如亭,吕红,等.FPC保护膜用耐高温PSA胶带的研制[J].中国胶粘剂,2012,21(2):44~49.
[14] 冯小平,李胜华,何伟,等.交联剂对保护膜用丙烯酸酯乳液压敏胶性能的影响[J].粘接,2010(5):59~62.
Research Progress in Chitosan Sustained Release System
JIN Zheng1,LIU Mei-hua1,LIU Zhen-mei2,ZHAO Dong-yu1,BAI Xu-duo1and ZHAO Kai1
(1.College of Chemistry and Materials Science,Heilongjiang University,Harbin 150080,China;2.Zhejiang University,Hangzhou 310058,China)
The latest research progress in chitosan sustained release system is introduced,including chitosan derivatives sustained release system, application of chitosan sustained release system in medicine system and adsorption-controlled release compound system.The research on chitosan derivatives sustained release system is introduced in detail,chitosan derivatives sustained release system is divided into six parts,such as chitosan derivatives sustained release microspheres,chitosan nanoparticles,chitosan sustained release tablet,chitosan sustained release microcapsules,chitosan sustained release membrane and chitosan sustained release hydrogel.The chitosan sustained release system has a extensive application prospect in the medicine system as a new technology.
Chitosan;sustained release;preparation;application
TQ325.4
A
1001-0017(2015)01-0065-07
2014-11-10 *基金项目:黑龙江省教育厅科学技术研究面上项目(编号:12521408)。
金政(1971-),男,黑龙江哈尔滨人,教授,博士,主要研究方向为高分子功能材料。E-mail:jinzhengdvd@163.com

