芹菜素通过升高ROS 促进不同细胞凋亡的实验研究
廖月霞,孔桂美,陶文华,卜 平
扬州大学医学院中西医结合肿瘤防治实验室,扬州 225001
芹菜素(4',5,7-三羟基黄酮,Apigenin)是一种天然植物黄酮,广泛存在于蔬菜、水果、豆类、中草药、红酒和啤酒中,具有抗氧化、抗肿瘤、抗炎等黄酮类生物活性[1,2]。流行病学研究结果显示饮食中富含芹菜素可以降低肠癌、卵巢癌、肺癌等肿瘤发生的风险[3]。一些研究结果提示芹菜素能通过诱导肿瘤细胞凋亡而抑制肿瘤细胞生长[4,5]。Munyendo等[6]应用磷脂混合胶技术研究芹菜素抗肿瘤活性,结果显示口服芹菜素混合胶可明显提高芹菜素对S180移植瘤抑瘤活性。此外,芹菜素具有抑制免疫细胞生长,诱导细胞周期阻滞,促进细胞凋亡作用,具有潜在的调控肥大细胞介导的炎症反应活性和抑制脐静脉内皮细胞表达IL-6、IL-8、ICAM-1 等炎症因子活性[7-9]。对其机制研究结果显示芹菜素可以通过对相应基因和蛋白的抑制或激活,调节信号分子,干预酶作用等途径调节细胞周期与凋亡、抑制侵袭与迁移、抑制血管新生、调节免疫等机制发挥生物性活性[10]。本实验应用不同浓度芹菜素作用于正常小鼠脾细胞和小鼠S180肉瘤细胞,观察其对不同细胞增殖的调节作用,以期为合理开发利用芹菜素提供依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂
MTT、硫酸亚铁、水杨酸,DPPH[2,2-di(4-tertoctylphenyl)-1-picrylhydrazyl]、碘化丙啶(PI)为Sigma 公司产品,芹菜素(apigenin,HPLC >98%)为南京替斯艾么中药技术研究所产品,活性氧检测试剂盒购自碧云天生物技术研究所,胎牛血清(FBS)购自杭州四季青公司,RPMI 1640 购自Gibco 公司,其他实际均为国产分析纯试剂。
1.1.2 主要仪器
多功能酶标仪(Biotek,USA),SUV-2120 分光光度仪(SCINCO,韩国),分析型流式细胞仪(BD FACSCalibur,USA),倒置荧光显微镜(Nikon,日本)。
1.1.3 细胞及动物
小鼠S180肉瘤细胞购自中国科学院上海细胞库;4~6 周龄SPF 级ICR 小鼠购自江苏省比较医学中心(合格证No:2023469)。
1.2 实验方法
1.2.1 细胞培养
1.2.1.1 小鼠S180肉瘤细胞
S180细胞培养于完全RPMI 1640 培养基(含10% FBS,100 IU/mL 青霉素和链霉素100 (g/mL),取对数生长期S180细胞,调整细胞浓度为5 ×104/mL。
1.2.1.2 小鼠脾细胞
4~6 周SPF 级ICR 小鼠脱颈处死,75%乙醇浸泡10 min,无菌操作取鼠脾脏,放在装有预冷PBS的平皿中漂洗去血渍剔除外膜。用PBS 溶液冲洗两遍,轻柔碾碎,200 目金属细胞滤网过滤,收集细胞悬液,加入红细胞裂解液,静置5 min 后,用PBS溶液洗涤3 次,调整细胞浓度5 ×105/mL。
1.2.2 MTT 检测细胞增殖情况
将与不同浓度芹菜素孵育细胞培养48 h 后,每孔加入10 μL MTT(5 mg/mL)工作液,37 °C,5%CO2孵育箱中培养4 h,离心去上清,每孔加入100 μL DMSO,于振荡器上震荡10 min,检测吸光度,并计算细胞增殖率。细胞增殖抑制率=1-(实验孔A均值-空白孔A 均值)/(溶媒空均值-空白孔A 均值)×100%。每组实验设平行6 复孔,重复3 次。
1.2.3 PI 单染测细胞凋亡
同上细胞浓度种板,以5%血清培养基重悬细胞,24 h 后收集细胞。以PBS 重悬细胞,加入-20 °C预冷的75%乙醇中固定。4 °C 过夜后PBS 重悬细胞5 min。200 目筛网收集细胞。加入1mL PI 染色液(50 μg/mL),4 °C、避光孵育45 min。流式细胞仪分析PI 荧光Sub-G1细胞百分率,实验重复3 次。
1.2.4 细胞内活性氧浓度测定
应用不同浓度芹菜素(12.5、25、50、100 μmol/L)刺激S180细胞和脾细胞24 h,调整S180细胞浓度为2 ×106/mL,脾细胞浓度5 ×107/mL,参考文献[11]实验方法,应用碧云天活性氧检测试剂盒,步骤简述如下:按照1∶1000 用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L。细胞收集后悬浮于稀释好的37 °C DCFH-DA 中45 min。用无血清细胞培养液洗涤细胞3 次,ROS 阳性对照或不同浓度芹菜素(12.5、25、50、100 μmol/L)刺激细胞30 min。收集细胞后流失细胞仪检测,使用488 nm 激发波长,525 nm发射波长,检测刺激前后荧光的强弱,实验重复3次。
1.2.5 数据处理
2 实验结果
2.1 芹菜素素对细胞活力的影响
MTT 实验结果显示,芹菜素素对正常ICR 小鼠来源的脾细胞具有明显抑制细胞增殖作用,与溶媒对照组比较,25 μmol/L 芹菜素可抑制60%左右的细胞增殖,IC50约为20 μmol/L。对小鼠S180肉瘤细胞也具有明显抑制细胞增殖作用,IC50约为50 μmol/L。结果提示芹菜素素对不同细胞增殖作用可能没有特异性(图1)。
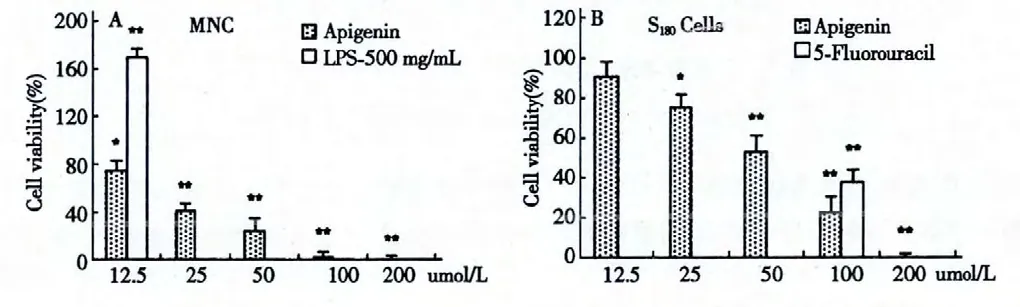
图1 芹菜素抑制小鼠来源脾细胞(A)及S180细胞(B)增殖(*,P<0.05;**,P<0.01)Fig.1 Apigenin inhibited the proliferation of mice spleen cells (A)and S180cells (B)(*,P<0.05;**,P<0.01)
2.2 芹菜素对细胞凋亡的影响
为进一步研究芹菜素对不同细胞的作用,对芹菜素作用24 h 后的细胞进行单染分析,结果显示>25 μmol/L 芹菜素作用的小鼠来源的脾细胞组Sub-G1期细胞比例明显增加(P<0.05),提示芹菜素可能通过促进小鼠脾细胞凋亡抑制其细胞增殖(图2)。对S180细胞作用结果也显示>25 μmol/L 芹菜素作用的S180细胞组Sub-G1期细胞比例明显增加(P<0.05),提示芹菜素可能也是通过促进小鼠脾细胞凋亡抑制其细胞增殖(图3)。这些结果提示芹菜素可能非特异性地诱导不同细胞发生凋亡。
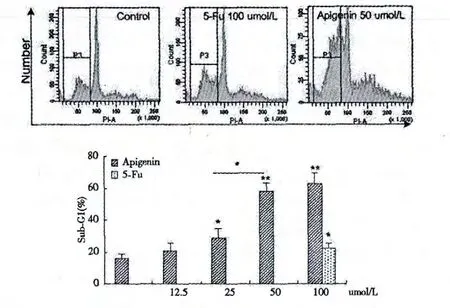
图2 芹菜素诱导小鼠来源脾细胞凋亡(*,P<0.05;**,P<0.01)Fig.2 Apigenin induced the mice spleen cell apoptosis (*,P<0.05;**,P<0.01)

图3 芹菜素诱导S180肉瘤细胞凋亡(*,P<0.05)Fig.3 Apigenin induced the S180cell apoptosis (*,P<0.05)
2.3 芹菜素素对不同细胞内活性氧作用
实验结果显示芹菜素在较低浓度时即明显升高ICR 小鼠来源脾细胞内活性氧产生,在量效关系上呈现低浓度上升,较高浓度下降的特点,且对脾细胞不同细胞群细胞内活性氧均有增加作用(图4)。图5 结果显示芹菜素显著促进S180小鼠肉瘤细胞内活性氧产生,在量效关系上也呈现低浓度上升,较高浓度下降的特点,这些结果提示芹菜素素对不同细胞内活性氧产生也存在非特异性调节作用,且较低浓度即明显促进细胞内活性氧生成,推测其在较高浓度的下降趋势可能与细胞凋亡增加有关。
3 讨论
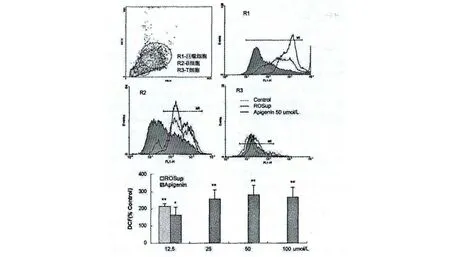
图4 芹菜素升高了脾细胞内活性氧水平(*,P<0.05;**,P<0.01)Fig.4 Apigenin increased the level of intercellular ROS of mice spleen cells (*,P<0.05;**,P<0.01)
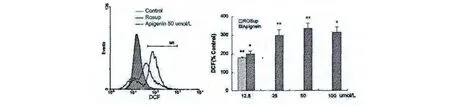
图5 芹菜素升高了S180细胞内活性氧水平(**,P<0.01)Fig.5 Apigenin increased the level of intercellular ROS of S180cells (**,P<0.01)
本节研究结果显示芹菜素显著抑制了小鼠脾细胞和S180细胞增殖并诱导其凋亡,同时,芹菜素显著升高细胞内活性氧水平。这些结果提示芹菜素可能是通过升高细胞内活性氧水平,诱导不同细胞发生凋亡。
药物或毒物抑制细胞增殖通常通过阻滞细胞周期、诱导细胞凋亡和促进细胞坏死等途径[12],本次实验中,采用流式细胞仪检测细胞凋亡变化,结果显示芹菜素、显著诱导S180细胞和脾细胞发生凋亡,随着浓度的增加,细胞凋亡率逐渐增加。这些结果提示芹菜素可能通过促进S180细胞和脾细胞凋亡从而抑制细胞增殖。
由超氧离子、过氧化氢和羟自由基组成的活性氧是细胞代谢的副产品,在细胞增殖、分化和凋亡中具有调控作用[13]。研究证实,细胞内氧化和抗氧化基本处于平衡状态,当低微水平的活性氧升高可促进细胞增殖,而较高水平的活性氧则引发细胞凋亡,更高水平的活性氧则直接导致细胞坏死[14]。本次实验结果显示芹菜素明显升高了S180细胞和脾细胞内活性氧水平,这与文献[14]报道结论基本一致,提示芹菜素可能是通过升高细胞内活性氧水平,进一步影响活性氧下游的细胞信号系统,促进了S180细胞和脾细胞的凋亡。
脾脏是体内最大的外周免疫器官,在机体免疫,尤其抗肿瘤免疫方面占有十分重要的地位,脾脏富含大量的免疫细胞和免疫因子参与肿瘤免疫,如淋巴细胞、巨噬细胞、DC 细胞和调理素、补体等,通过不同的机制参与免疫反应,发挥免疫功能[15]。脾脏功能在肿瘤的不同阶段扮演不同的角色,具有双向性、时向性特点,有实验证实,脾脏切除对大鼠肿瘤的发生、发展和扩散有显著的促进作用[16]。本实验结果显示芹菜素同时抑制脾细胞和S180肿瘤细胞增殖,提示其作用可能具有非特异性,这种非特异性作用在芹菜素抗肿瘤机制的意义和作用有待进一步研究。
1 Lordan S,O'Neill C,O'Brien NM.Effects of apigenin,lycopene and astaxanthin on 7 beta-hydroxycholesterol-induced apoptosis and Akt phosphorylation in U937 cells.Br J Nutr,2008,100:287-296.
2 Tong X,Pelling JC.Targeting the PI3K/Akt/mTOR axis by apigenin for cancer prevention.Anticancer Agents Med Chem,2013,13:971-978.
3 Shukla S,Gupta S.Apigenin:a promising molecule for cancer prevention.Pharm Res,2010,27:962-978.
4 Mafuvadze B,Liang Y,Besch-Williford C,et al.Apigenin induces apoptosis and blocks growth of medroxyprogesterone acetate-dependent BT-474 xenograft tumors.Horm Cancer,2012,3:160-171.
5 Cao X,Liu B,Cao W,et al.Autophagy inhibition enhances apigenin-induced apoptosis in human breast cancer cells.Chin J Cancer Res,2013,25:212-222.
6 Munyendo WL,Zhang Z,Abbad S,et al.Micelles of TPGS modified apigenin phospholipid complex for oral administration:preparation,in vitro and in vivo evaluation.J Biomed Nanotechnol,2013,9:2034-2047.
7 Kang OH,Lee JH,Kwon DY.Apigenin inhibits release of inflammatory mediators by blocking the NF-kappaB activationpathways in the HMC-1 cells.Immunopharmacol Immunotoxicol,2011,33:473-479.
8 Wang J,Liao Y,Fan J,et al.Apigenin inhibits the expression of IL-6,IL-8,and ICAM-1 in DEHP-stimulated human umbilical vein endothelial cells and in vivo.Inflammation,2012,35:1466-1476.
9 Li-Weber M.Targeting apoptosis pathways in cancer by Chinese medicine.Cancer Lett,2013,332:304-312.
10 Chen KK(陈况况),Zhang HH(章宏慧),Chen JC(陈健初).Research progress in mechanism of apigenin’s anticarcinogenic activity on cancer cells.Sci Technol Food Ind(食品工业科技),2013,3:392-395.
11 Ju W,Wang X,Shi H,et al.A critical role of luteolin-induced reactive oxygen species in blockage of tumor necrosis factor-activated nuclear factor-kappaB pathway and sensitization of apoptosis in lung cancer cells.Mol Pharmacol,2007,71:1381-1388.
12 Kohda T,Sakuma S,Abe M,et al.Monochloramine suppresses the proliferation of colorectal cancer cell line Caco-2 by both apoptosis and G2/M cell cycle arrest.Cell Biochem Funct,2013,32:188-193.
13 Yi J(易静).Study on the mechanisms underlying that reactive oxygen species regulate post-translational modification of the proteins and affect the behaviors of cancer cells.J Shanghai Jiaotong Univ,Med Sci(上海交通大学学报,医学版),2012,32:1122-1127.
14 Milisav I,Poljsak B,Suput D.Adaptive response,evidence of cross-resistance and its potential clinical use.Int J Mol Sci,2012,13:10771-10806.
15 Jiang CQ(姜从桥).How to think about the antitumor function of the spleen.Chin Arch General Surgery,Electroniv Version(中华普通外科学文献,电子版),2008,6:444-445.
16 Yi J(易坚),Zou ZS(邹志森).The spleen and tumor immunity.Prac J Cancer(实用癌症杂志),1999,3:80-81.

