赤芝醇提取物中三萜类的高效液相色谱特征图谱研究
蒋婷婷 ,卢端萍,王 勇,陈 硕,黄旭慧(.福建省立金山医院药学部,福建 福州35008;.福建省药品检验所,福建 福州 35000)
灵芝是我国传统的药用真菌,有“仙药、瑞草”之称,具有“久食轻身不老,延年神仙”之功效。《中国药典》(2010 年版)收载灵芝品种,作为我国法定中药材的是多孔菌科真菌赤芝或紫芝的干燥子实体[1-2]。研究结果证实,灵芝中含有多种的化学成分,其中灵芝多糖和灵芝三萜是灵芝主要的活性成分[3]。灵芝三萜具有抗肿瘤、保肝、抗病毒、抗雄性激素、抗氧化、抗菌、抗补体、抗人类免疫缺陷病毒、抑制血管紧张素转化酶等功效[3-15]。目前,已经从灵芝子实体,发酵菌丝体和灵芝孢子中分离出了130 多种的三萜化合物。赤芝醇提取物是指适时采收成熟的新鲜赤芝子实体,烘干后采用酒精提取、真空浓缩、喷雾干燥等工艺得到的灵芝浸膏粉,是灵芝粉高倍浓缩而成的灵芝精华,是众多灵芝类保健品的主要原料,其质量好坏直接影响到成品的质量。目前,国内外对灵芝的研究主要集中在灵芝子实体上,对灵芝提取物也只限于药理活性的研究,尚未有关于灵芝醇提取物质量控制的报道,本研究采用高效液相色谱法(high performance liquid chromatography,HPLC)对不同来源赤芝药材经过相同工艺制成的赤芝醇提取物中的三萜类进行特征图谱研究,为赤芝醇提取物的质量控制提供实验依据。
1 仪器与试药
岛津LC-2010A 型高效液相色谱仪(日本岛津公司);TDL超声波清洗器(昆山仪器有限公司),超纯水器(德国塞多利斯公司)。灵芝酸C2、灵芝酸B、灵芝酸A、灵芝酸H(中国医学科学院药物研究所)。水为超纯水,乙腈为色谱纯,其他试剂均为分析纯。赤芝醇提取物(福建仙芝楼生物科技有限公司采集不同产地赤芝子实体,经过相同工艺制成)其来源及编号见S1:福建福州;S2:福建宁德;S3:福建福州;S4:吉林蛟河市;S5、S6:山东;S7:山东冠县;S8:上海;S9:安徽霍山县;S10:沈阳。
2 方法与结果
2.1 色谱条件
色谱柱为Zorbax-SB-C18(150 mm ×4.6 mm,3.5 μm);流动相为乙腈(A)-0.1%醋酸水溶液(B)(V∶V =25∶75),梯度洗脱程序(0 ~32 min,25% ~26%A;32 ~50 min,26% ~27%A;50 ~60 min,27% ~26%A;60 ~61 min,26% ~30%A;61 ~70 min,30% ~32%A;70 ~80 min,32% ~35%A;80 ~90 min,35% A);检测波长为256 nm;柱温为25 ℃;流速为1.0 ml/min;进样量为20 μl,记录色谱图见图1 ~2。
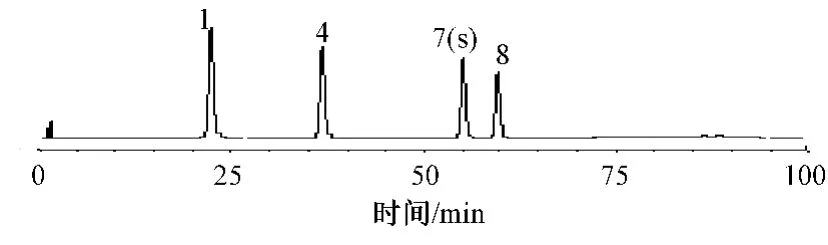
图1 对照品溶液色谱图Fig 1 HPLC chromatogram of reference substances
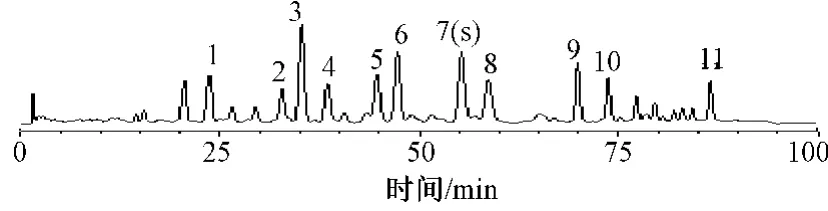
图2 供试品溶液色谱图Fig 2 HPLC chromatogram of test samples
2.2 溶液的制备
2.2.1 对照品溶液的制备:取灵芝酸C2、灵芝酸B、灵芝酸A、灵芝酸H对照品适量,精密称定,加流动相制成每1 ml 含0.1 mg 芝酸C2、灵芝酸B、灵芝酸A、灵芝酸H 的溶液,即得。2.2.2 供试品溶液的制备:取灵芝醇提取物样品约0.2 g,置25 ml 容量瓶中,加氯仿适量超声处理10 min,放冷,加氯仿定容至刻度线,滤过。取续滤液5 ml 蒸干,用流动相定容至5 ml容量瓶即得。
2.3 方法学考察
2.3.1 精密度试验:取同一供试品溶液,连续进样6 次。以灵芝酸A 为参照,计算各共有峰相对保留时间和相对峰面积,其RSD<1%,表明仪器的精密度良好。
2.3.2 重复性试验:取同一赤芝醇提取物样品(S10)6 份,按上述方法制备并进行检测。以灵芝酸A 为参照,计算各共有峰相对保留时间和相对峰面积的RSD<1%,表明该方法的重复性良好。
2.3.3 稳定性试验:取同一供试品溶液分别于0、2、4、8、12、18、24 h 进样,按上述色谱条件测定,记录各共有峰保留时间和峰面积。以灵芝酸A 为参照,计算各共有峰相对保留时间和相对峰面积的RSD<1%,表明灵芝醇提物的制备样品在一日内通过HPLC 分析结果稳定。
2.4 特征图谱的建立
2.4.1 样品的测定:称取各赤芝醇提取物样品,照“2.2.2”项方法制备供试品溶液,按上述方法进行测定,以灵芝酸A(7 号峰)为参照峰,测得各赤芝醇提取物样品的相对保留时间结果见表1,相对峰面积结果见表2。
2.4.2 样品特征图谱的相似度评价:将得到的各赤芝醇提取物的色谱图数据分别导入国家药典委员会指纹图谱评价系统,指定S10 为参照图谱,自动匹配,即可生成对照特征图谱R,并进行相似度评价。10 批赤芝醇提取物样品与对照特征图谱的相似度计算结果为0.86、0.922、0.915、0.910、918、0.986、0.968、0.947、0.983、0.972,见图3。
3 讨论
3.1 流动相的选择
本研究过程中选择了4 个流动相系统:(1)乙腈-水;(2)乙腈-0.1% 醋酸水溶液;(3)乙腈-0.5% 醋酸水溶液;(4)乙腈-2%醋酸水溶液。结果表明,各种流动相中以乙腈-0.1%醋酸水溶液系统为最佳,谱图上各个色谱峰(256 nm)的分离度较好,因此选择此流动相系统作为赤芝醇提物HPLC 特征图谱检测的流动相。
3.2 柱温的选择
本研究过程中选择了25、30、35、40 ℃4 个温度,结果发现,柱温对各色谱峰的保留时间和分离度影响较大,其原因可能是流动相中加有乙酸,柱温通过影响流动相中pH 值而影响色谱峰的保留时间。在上述流动相系统下,柱温为25 ℃时各个色谱峰分离的较好,因此柱温选择25 ℃。
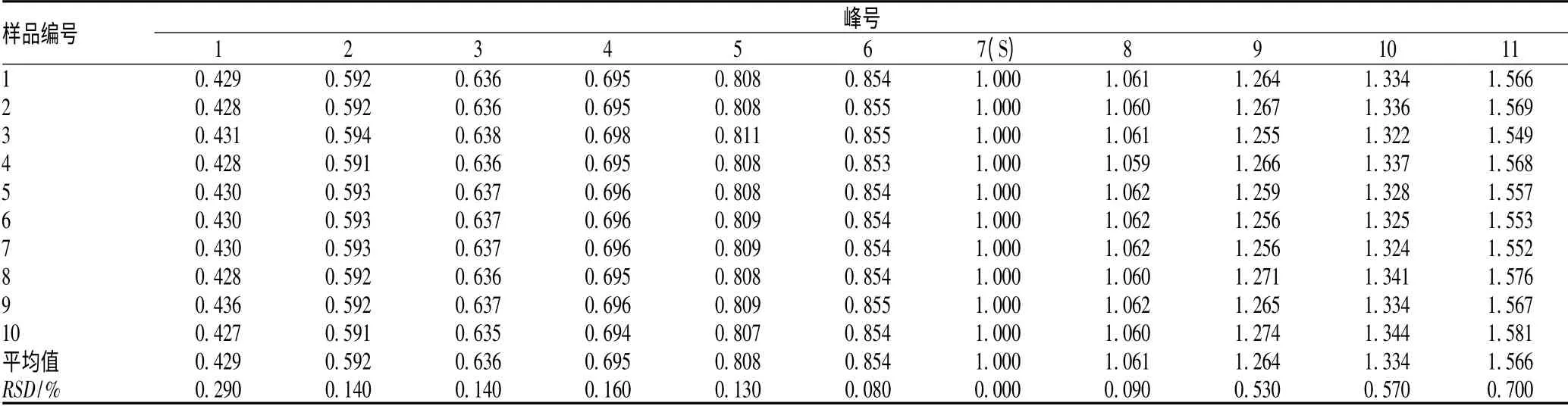
表1 赤芝醇提物样品特征图谱相对保留时间测定结果Tab 1 Test results of relative retention time in specific HPLC chromatogram of extraction of G. lucidum alcohol
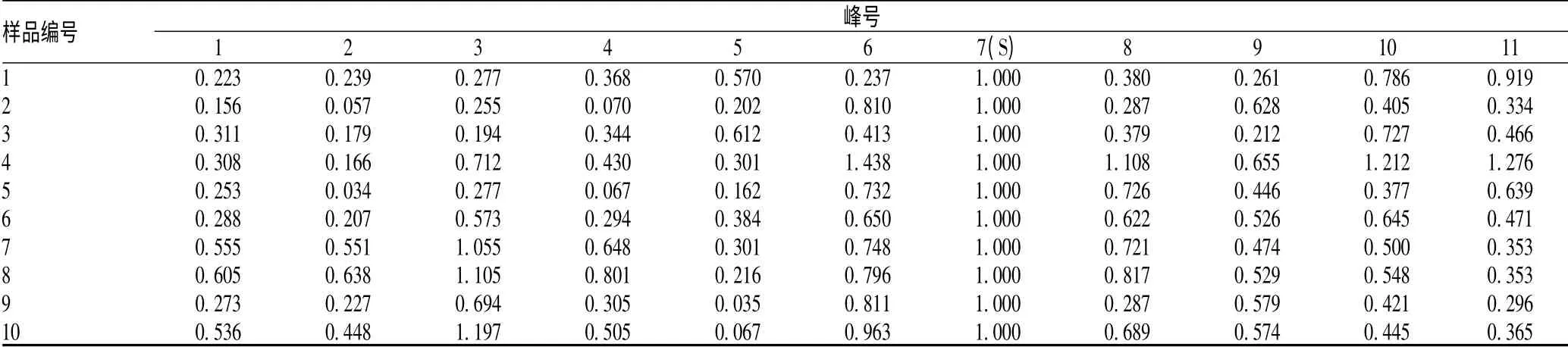
表2 赤芝醇提物样品特征图谱相对峰面积测定结果Tab 2 Test results of relative retention peaks in specific HPLC chromatogram of extraction of G. lucidum alcohol
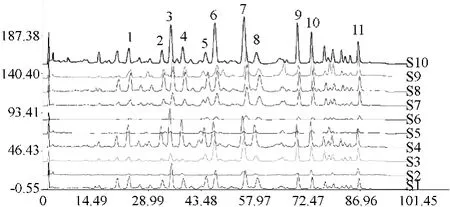
图3 10 批赤芝醇提取物的特征图Fig 3 Specific HPLC chromatogram of extractionof G. lucidum alcohol for ten batches of samples
3.3 提取溶剂的选择
本研究过程中采用甲醇和氯仿作为提取溶剂,结果显示,以氯仿作为提取溶剂其杂质峰较甲醇的少,基线更平稳。Wang Xiaoming 等[6]在研究中也比较了氯仿、甲醇、氯仿-甲醇3 种提取溶剂的效果,结果表明以氯仿作为提取溶剂能够将三萜化合物充分的提取出来,且三萜化合物能够充分的被溶解在氯仿中。因此,选用氯仿作为赤芝醇提取物特征图谱的提取溶剂。
3.4 结果分析
本研究建立的灵芝醇提取物特征图谱,确定了11 个特征峰,选择含量较高的灵芝酸A 为参照峰。结果显示,不同样品各共有峰的相对保留时间RSD<1%,说明10 批样品在化学成分上比较相似;而共有峰相对面积差异较大,由此可见,不同产地以及同一产地不同批次的赤芝醇提取物的含量有着一定的差异。赤芝醇提取物的对照指纹图谱相似度评价结果显示:S2 ~S10 样品各色谱之间的相似度在0.91 ~0.986 之间,均在0.900 之上,S1 样品的相似度为0.86,说明灵芝醇提取物样品组间存在一定的差异,可能系不同的种植环境、不同的培养基质及不同的采收时间等因素所致。
综上所述,本研究首次对灵芝醇提取物的特征图谱进行研究,建立的特征图谱能够考察灵芝醇提取物样品之间质量的稳定性及鉴别其真伪,为灵芝醇提取物质量控制提供了深层次评价质量的参考依据。
[1] 林志彬.灵芝的现代研究[M].3 版. 北京:北京医科大学出版社,2007:3.
[2] 国家药典委员会.中华人民共和国药典(一部)[S].2010 年版.北京:中国医药科技出版社,2010:174-175.
[3] Wei ZH,Duan YY,Qian YQ,et al. Screening of Ganoderma strains with high polysaccharides and ganoderic acid contents and optimization of the fermentation medium by statistical methods[J].Bioprocess Biosyst Eng,2014,37 (9):1789-1797.
[4] Que Z,Zou F,Zhang A,et al. Ganoderic acid Me induces the apoptosis of competent T cells and increases the proportion of Treg cells through enhancing the expression and activation of indoleamine 2,3-dioxygenase in mouse lewis lung cancer cells[J]. Int Immunopharmacol,2014,23(1):192-204.
[5] Oliveira M,Reis FS,Sousa D,et al. A methanolic extract of Ganodermalucidum fruiting body inhibits the growth of a gastric cancer cell line and affects cellular autophagy and cell cycle[J].Food Funct,2014,5 (7):1389-1394.
[6] Huang SM,Yang XL,Wang BW,et al. [Study on preparation process and analytical methods of ESAC from Ganoderma lucidum][J].Zhongguo Zhong Yao Za Zhi,2003,28(4):332-334.
[7] Ruan W,Lim AH,Huang LG,et al. Popovich DG. Extraction optimisation and isolation of triterpenoidsfrom Ganodermalucidum and their effect on human carcinoma cell growth[J].Nat Prod Res,2014,28 (24):2264-2272.
[8] 李鹏,魏晓霞,南婷婷,等. 灵芝三萜酸对小鼠急性肝损伤的保护作用[J].中国医院药学杂志,2013,33(23):1914-1918.
[9] Zhang W,Tao J,Yang X,et al. Antiviral effects of two Ganoderma lucidum triterpenoids against enterovirus 71 infection[J]. Biochem Biophys Res Commun,2014,449(3):307-312.
[10] Liu J,Shimizu K,Konishi F,et al. The anti-androgen effect of ganoderol B isolated from the fruiting body of Ganoderma lucidum[J].Bioorg Med Chem,2007,15(14):4966-4972.
[11] Zhu M,Chang Q,Wong LK,et al. Triterpene antioxidants from ganoderma lucidum[J].Phytother Res,1999,13(6):529-531.
[12] Li WJ,Nie SP,Liu XZ,et al. Antimicrobial properties,antioxidant activity and cytotoxicity of ethanol-soluble acidic components from Ganoderma atrum[J].Food Chem Toxicol,2012,50(3-4):689-694.
[13] Liu DZ,Zhu YQ,Li XF,et al. New triterpenoidsfrom the fruiting bodies of Ganodermalucidum and their bioactivities[J]. Chem Biodivers,2014,11 (6):982-986.
[14] Min BS,Gao JJ,Hattori M,et al. Anticomplement Activity of Terpenoids from the Spores of Ganoderma lucidum[J]. Planta.Med,2001,67(9):811-814.
[15] 叶鹏飞,张美萍,王康宇,等. 灵芝主要成分及其药理作用的研究进展综述[J].食药用菌,2013,21(3):158-161.

