舒乳凝胶的毒理学研究Δ
游 燕 ,潘 智,谭 方,黄丁英,易春霞,刘圆圆(桂林市中医医院药剂科,广西 桂林 541002)
舒乳凝胶是根据桂林市中医医院乳腺科协定处方舒乳散开发的新型外用剂型,功能软坚散结、活血止痛、清热解毒,用于治疗气滞血瘀、痰凝互结的乳癖[1-4]。处方由肉桂、丁香、生天南星、生半夏、山柰、威灵仙、芥子、猪牙皂、白胡椒、樟脑组成,因处方中含有毒性药材生天南星和生半夏,为了保证临床用药安全,故对舒乳凝胶进行毒理学研究,开展急性毒性、皮肤刺激性和长期毒性试验[5-6],现报告如下。
1.1 材料与方法
1.1 动物与药品
成年健康白色家兔,体质量为2 ~2.5 kg,雌雄各半,由桂林医学院实验动物中心提供。受试动物皮肤光滑、无损伤、无皮肤病。受试药品为舒乳凝胶(批准文号:20140610)。凝胶中药物浓度为0.25 g 生药/g(临床应用剂量,低剂量)和0.50 g生药/g(高剂量)。
1.2 仪器
JH2102 电子天平(上海精密科学仪器有限公司),ABX Pentra DF120 全自动血细胞分析仪(法国ABX),美国雅培Aeroset 全自动生化分析仪(美国雅培)。
1.3 方法
给药前24 h,将家兔的背部脊柱两侧去毛,去毛面积约为体表面积的10%。去毛后24 h 检查去毛皮肤是否因去毛而受伤,受伤的皮肤不宜作完好皮肤的毒性试验。破损皮肤的制作采用不同方法将去毛消毒皮肤划破,以渗血为度[7-9]。
1.3.1 急性毒性试验:将家兔分成5 组,一组空白对照组,应用空白凝胶;4 组试验组,分别为完整皮肤和破损皮肤组,每组4 只,应用高剂量和低剂量舒乳凝胶。低剂量组家兔应用舒乳凝胶(0.25 g 生药/g),高剂量组家兔应用的药物浓度为低剂量组的2 倍(0.50 g 生药/g),均匀涂于脱毛区,1 次2 g,1 日3 次,涂抹2 min 至其吸收完全,每只动物分笼饲养。给家兔受试物24 h 后,用温水除去残留的受试物后,正常饲养14 d,每日观察并记录家兔的体质量、皮肤毛发、眼和黏膜、呼吸、中枢神经系统、四肢活动等指标的变化及其他中毒表现,若出现死亡动物,应及时尸检,当有肉眼可见病变时,进行病理组织学检查。
1.3.2 皮肤刺激性试验:(1)单次给药的皮肤刺激性试验:家兔分成4 个试验组,完整皮肤和破损皮肤组,每组4 只,各高剂量和低剂量舒乳凝胶低剂量组家兔应用舒乳凝胶(0.25 g生药/g),高剂量组家兔应用的药物浓度为低剂量组的2 倍(0.50 g 生药/g),给药区涂抹受试药2 g,对照区涂抹空白凝胶2 g,涂抹2 min 至其吸收完全。涂抹24 h 后用温水洗去涂抹的残留物,分别在除去药物后1、24、48、72 h 观察和记录用药部位皮肤反应。(2)多次给药的皮肤刺激性试验:分成4 个试验组,完整皮肤和破损皮肤组,每组4 只,应用高剂量和低剂量舒乳凝胶。每日按单次给药的皮肤刺激性试验方法给药,连续7 d,去除药物后1 h 观察和记录皮肤是否有红斑、水肿、涂药部位是否有出血点、变薄或变粗糙等异常情况,对皮肤红斑及水肿按标准进行评分。最后一次贴敷,除去药物后1、24、48、72 h 观察和记录用药部位皮肤反应。
1.3.3 长期毒性试验:将家兔分为5 组,对照组家兔应用空白凝胶;4 组试验组家兔分为完整皮肤和破损皮肤组,每组6 只,各应用高剂量和低剂量舒乳凝胶。低剂量组家兔应用舒乳凝胶(0.25 g 生药/g),高剂量组家兔应用的药物浓度为低剂量组的2 倍(0.50 g 生药/g),均匀涂于脱毛区,1 次2 g,1 日3 次。给药区涂抹受试药2 g,对照区涂抹空白凝胶2 g,涂抹2 min 至其吸收完全。6 h 后用温水洗去残留物,连续应用4 周。每日观察记录家兔的一般情况,停药后每组随机抽取2/3 家兔心脏采血,用细胞分析仪做血液指标测定;分离血浆,用生化分析仪测定天门冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)等生化指标;随后处死动物,取心、肝、脾、肺、肾称质量,计算脏器系数,对上述脏器和给药部位皮肤置10%甲醛中固定,常规制作石蜡切片,HE 染色,进行病理学检查。剩余动物停药饲养观察14 d 后作同样检查,以便确定受试物毒性反应的恢复程度[10-12]。
1.4 观察指标与疗效评定标准
观察各组家兔的急性毒性试验结果、皮肤刺激性试验结果及长期毒性试验结果,长期毒性试验结果观察指标主要包括体质量、红细胞计数(RBC)、血红蛋白(HGB)、血小板计数(PLT)、白细胞计数(WBC)、淋巴细胞百分比(LY%)、ALT、AST、碱性磷酸酶(ALP)、血清总蛋白(TP)、血清白蛋白(ALB)、血糖(GLU)及心、肝、脾、肺、肾各脏器系数等指标。参照相关文献皮肤刺激性评分标准,对每只家兔皮肤刺激反应进行评分[13],见表1。评价标准:刺激指数:(红斑反应总分+水肿反应总分)/每组动物数。刺激分值为:0 ~0.5 分无刺激;0.5 ~3.0 分为轻度刺激;3.0 ~6.0 分为中度刺激;6.0 ~8.0 分为强度刺激。

表1 皮肤刺激性反应评分标准Tab 1 Scoring standards of reactions of skin irritation
1.5 统计学方法
本研究中数据采用SPSS 18.0 统计学软件进行分析,计量资料采用均数±标准差(±s)表示、采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 舒乳凝胶急性毒性试验对5 组家兔体质量影响的比较
用药14 d 后,空白对照组和给药组家兔体质量正常增加,各组之间的差异无统计学意义(P>0.05),见表2。研究结果表明,舒乳凝胶药物浓度为0.25 g 生药/g 和0.50 g 生药/g 外用在完整或破损家兔皮肤上,均未引起急性毒性反应。
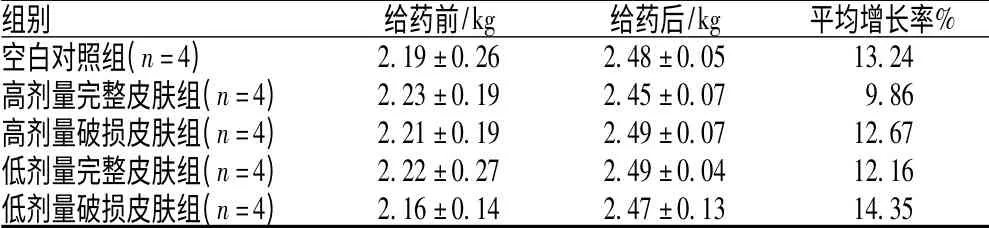
表2 舒乳凝胶急性毒性试验对5 组家兔体质量影响的比较(x¯±s)Tab 2 Effects of acute toxicity test of shuru gel on the body mass of rabbits(x¯±s )
2.2 舒乳凝胶多次给药对家兔皮肤刺激性试验结果比较
舒乳凝胶低、高剂量组家兔单次给药后,完整皮肤和破损皮肤均未形成局部红斑和水肿,未见刺激性,与空白对照组比较,差异无统计学意义(P>0.05)。多次给药结果表明,舒乳凝胶连续给药7 d,完整皮肤和破损皮肤均未形成局部红斑和水肿,均未见刺激性,与空白对照组的差异无统计学意义(P>0.05),见表3。研究结果表明,舒乳凝胶药物浓度为0.25 g 生药/g 和0.50 g生药/g 外用对家兔的完整或破损皮肤均无刺激作用。

表3 舒乳凝胶多次给药对家兔皮肤刺激性试验结果比较Tab 3 The skin irritation test results of shuru gel with many times of administration
2.3 长期毒性试验结果
给药期间,各剂量组动物外观正常,活泼,皮毛光泽,眼、鼻、耳、口、生殖器无异常分泌物,大小便颜色形状均正常,各给药组动物也未有毒性症状出现,给药期间无动物死亡。
2.3.1 长期毒性试验中各组家兔不同时间段体质量的比较:各组家兔体质量均逐周增长,给药期间各试验组家兔体质量与对照组比较,差异无统计学意义(P>0.05),见表4。
2.3.2 舒乳凝胶长期毒性试验中各组家兔血液学指标的比较:用药28 d 后,各试验组家兔RBC、HGB、PLT、WBC、LY%各项指标与对照组比较,差异无统计学意义(P>0.05),见表5。
2.3.3 舒乳凝胶长期毒性试验中各组家兔生化学指标的比较:用药28 d 后,各试验组家兔血液AST、ALT、ALP、TP、ALB、GLU与对照组比较,差异无统计学意义(P>0.05),见表6。
表4 舒乳凝胶长期毒性试验中各组家兔不同时间段体质量的比较(kg,±s)Tab 4 Effects of acute toxicity test of shuru gel on the body mass of rabbits in different periods(kg,±s)
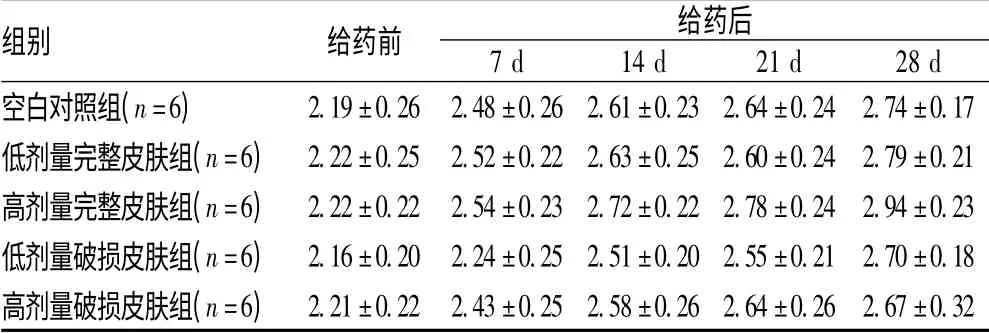
表4 舒乳凝胶长期毒性试验中各组家兔不同时间段体质量的比较(kg,±s)Tab 4 Effects of acute toxicity test of shuru gel on the body mass of rabbits in different periods(kg,±s)
组别 给药前 给药后7 d 14 d 21 d 28 d空白对照组(n=6) 2.19±0.26 2.48±0.26 2.61±0.23 2.64±0.24 2.74±0.17低剂量完整皮肤组(n=6) 2.22±0.25 2.52±0.22 2.63±0.25 2.60±0.24 2.79±0.21高剂量完整皮肤组(n=6) 2.22±0.22 2.54±0.23 2.72±0.22 2.78±0.24 2.94±0.23低剂量破损皮肤组(n=6) 2.16±0.20 2.24±0.25 2.51±0.20 2.55±0.21 2.70±0.18高剂量破损皮肤组(n=6) 2.21±0.22 2.43±0.25 2.58±0.26 2.64±0.26 2.6 7±0.32
2.3.4 舒乳凝胶长期毒性试验中各组家兔脏器系数的比较:用药28 d 后,各试验组家兔脏器系数与对照组比较,差异无统计学意义(P>0.05),见表7。
表5 舒乳凝胶长期毒性试验中各组家兔血液学指标的比较(±s)Tab 5 Effects of acute long-term toxicity test of shuru gel on haematological indexes of rabbits(±s)

表5 舒乳凝胶长期毒性试验中各组家兔血液学指标的比较(±s)Tab 5 Effects of acute long-term toxicity test of shuru gel on haematological indexes of rabbits(±s)
组别 RBC/(×1012/L) HGB/(g/L) PLT/(×109/L) WBC/(×109/L)LY/%空白对照组(n=6) 6.18±0.68 122.50±9.01 433.83±84.58 11.20±6.27 60.88±17.33低剂量完整组(n=6) 6.42±0.50 127.50±4.64 478.83±113.36 12.78±3.28 55.67±19.66高剂量完整组(n=6) 6.24±0.34 125.80±6.72 445.20±121.96 10.48±4.84 57.34±14.43低剂量破损组(n=6) 6.56±0.38 127.67±3.44 431.33±100.41 9.85±3.01 51.47±13.90高剂量破损组(n=6) 6.11±0.63 120.33±12.18 402.00±91.35 9.93±3.79 51.92±21.83
表6 舒乳凝胶长期毒性试验中各组家兔生化学指标的比较(±s)Tab 6 Effects of acute long-term toxicity test of shuru gel on blood biochemical indexes of rabbits(±s)

表6 舒乳凝胶长期毒性试验中各组家兔生化学指标的比较(±s)Tab 6 Effects of acute long-term toxicity test of shuru gel on blood biochemical indexes of rabbits(±s)
组别 AST/(U/L) ALT/(U/L) ALP/(U/L) TP/(g/L) ALB/(g/L) GLU/(mmol/L)空白对照组(n=6) 35.8±11.16 60.17±23.87 77.17±30.45 65.92±3.90 41.68±2.46 6.42±0.84低剂量完整组(n=6) 27.33±6.86 53.67±11.60 89.50±25.63 69.08±6.98 41.35±1.57 6.04±0.51高剂量完整组(n=6) 39.3±20.54 74.50±36.19 68.33±12.03 65.13±4.95 41.50±1.52 6.79±0.44低剂量破损组(n=6) 38.5±14.67 77.83±25.12 96.83±12.75 67.02±7.97 39.98±1.43 5.98±0.54高剂量破损组(n=6) 63.5±45.93 68.00±12.93 72.83±22.24 64.1±10.72 39.40±4.21 6.11±0.41
表7 舒乳凝胶长期毒性试验中各组家兔脏器系数的比较(g/kg,±s)Tab 7 Effects of acute long-term toxicity test of shuru gel on coefficient of organs of rabbits(g/kg,±s)

表7 舒乳凝胶长期毒性试验中各组家兔脏器系数的比较(g/kg,±s)Tab 7 Effects of acute long-term toxicity test of shuru gel on coefficient of organs of rabbits(g/kg,±s)
组别 心 肝 脾 肺 肾空白对照组(n=6) 2.76±0.30 28.04±4.35 0.44±0.05 4.92±0.73 4.97±0.35低剂量完整组(n=6) 2.24±0.15 30.24±2.11 0.45±0.07 3.79±0.40 4.68±0.29高剂量完整组(n=6) 2.43±0.50 26.41±4.47 0.49±0.10 3.94±0.51 5.10±0.12低剂量破损组(n=6) 2.41±0.20 29.71±3.55 0.52±0.15 4.32±0.41 5.14±0.49高剂量破损组(n=6) 2.35±0.18 31.68±1.81 0.46±0.05 4.11±0.30 5.24±0.39
2.3.5 舒乳凝胶长期毒性试验中各组家兔脏器组织形态学变化的比较:用药28 d 后,对各组家兔进行组织病理学检查,其心、肝、脾、肺、肾等脏器组织均未见病理改变,各组均未见水肿、表皮增生、角化等现象;对照组未见慢性炎细胞,各试验组家兔脏器组织形态学变化情况与对照组比较,差异无统计学意义(P>0.05)。
3 讨论
舒乳凝胶处方含有毒性成分生天南星、生半夏,其毒性成分是毒针晶,毒针晶中的凝集素蛋白均具有显著促炎作用,毒针晶的刺激性毒性是凝集素蛋白随毒针晶刺入组织后诱导炎症反应产生严重的炎症刺激性毒性[14]。药材的水及各有机溶剂提取物经镜检均无针晶,对皮肤黏膜没有刺激性[15]。本研究中,长期应用以提取液制成的舒乳凝胶长对家兔皮肤黏膜无明显刺激,对血液系统和主要脏器无显著不良影响,为比较安全的外用药物。
[1] 柴妤,卓睿,丘萍.消结汤内服合舒乳散外用治疗乳腺增生病临床分析[J].中国医药导刊,2013,15(12):2034-2036.
[2] 柴妤,卓睿,丘萍等.中药内服加金黄散合舒乳散外用治疗复杂难治性浆细胞性乳腺炎临床观察[J]. 中外健康文摘,2013,10(12):378-379.
[3] 柴妤,卓睿,丘萍.消结汤内服合舒乳散外用治疗乳腺增生病临床分析[J].中国医药导刊,2013,15(12):2034-2036.
[4] 丘平,申翔,柴妤. 舒乳散贴膏治疗肝郁痰凝型乳腺增生病80例疗效观察[J].长春中医药大学学报,2013,29(2):291-292.
[5] 国家药典委员会.中华人民共和国药典:一部[M].2010 年版.北京:中国医药科技出版社,2010:53,110.
[6] 中华人民共和国卫生部药政管理局.中药新药研究指南(药学,药理学,毒理学)[M].北京:人民卫生出版社,1994:199.
[7] 国家食品药品监督管理局.药物研究技术指导原则[M].北京:中国医药科技出版社,2005:73.
[8] 徐叔云,卞如廉,陈修.药理学实验方法学[M].3 版.北京:人民卫生出版社,2002:234-238.
[9] 陈奇.中药药理研究方法学[M].2 版.北京:人民卫生出版社,2006:106-113.
[10] 李建荣,黄芳华.中药新药长期毒性实验设计及常见问题分析[J].中国新药杂志,2004,13(9):769-772.
[11] 龚旭初,陈仁寿,蒋凤荣,等. 新芙黄膏皮肤用药安全性实验研究[J].中华中医药杂志,2010,25(12):2138-2140.
[12] 李庆虹,山丽梅,任永申,等. 中药毒性研究进展[J]. 中华中医药杂志,2007,22(5):300-302.
[13] 《中药天然药物刺激性和溶血性研究的技术指导原则》课题研究组.中药天然药物刺激性和溶血性研究的技术指导原则[M].北京:国家食品药品监督管理局药品审评中心,2005:11-20.
[14] 吴皓,葛秀允,郁红礼,等. 天南星科4 种有毒中药针晶的晶型结构和其毒性的比较[J]. 中国中药杂志,2010,35(9):1152-1155.
[15] 刘先琼,吴皓,郁红礼,等.半夏、掌叶半夏及禹白附凝集素蛋白的刺激性研究[J]. 中国实验方剂学杂志,2011,17(18):244-247.

