反相-高效液相色谱法同时测定消炎颗粒中绿原酸与秦皮乙素的含量
王俊杰 ,刘 弘,张玲昂,张松亮(解放军第152 中心医院药学部,河南 平顶山 467000)
消炎颗粒是由金银花、紫花地丁、鱼腥草、射干、大青叶、半枝莲等6 味中药组成的复方制剂(批准文号:济制字(2011)B11049),具有清肺热、解毒消炎之功效,常用于呼吸道感染等疾病[1]。多年来,消炎颗粒在解放军第152 中心医院的临床应用中显示出了确切的疗效,且无明显不良反应。为更好地有效控制制剂质量,本研究选择方中君药金银花、臣药紫花地丁中的有效成分绿原酸、秦皮乙素为质控指标,采用反相-高效液相色谱法(reversed-phase high performance liquid chromato-graphy,RP-HPLC)同时测定制剂中2 种成分的含量,现报告如下。
1 仪器与试药
岛津LC-20AT 高效液相色谱仪、LC solution 色谱工作站、SPD-M20A 二极管阵列检测器(日本岛津公司)。绿原酸对照品(中国药品生物制品检定所,批号:110753-200413,纯度≥98%);秦皮乙素对照品(中国药品生物制品检定所,批号:110741-200506,纯度≥98%);消炎颗粒(解放军第152 中心医院,规格:10 g/袋,批号:140501、140601、140701);甲醇、乙腈、磷酸均为色谱级,水为纯化水,其他均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:Inertsil ODS-3 色谱柱(4.6 mm×250 mm,5 μm),流动相:乙腈-0.1%磷酸溶液(V ∶V=10 ∶90),柱温:30 ℃;检测波长:327、353 nm;进样量:10 μl。
2.2 对照品溶液的制备
精密称取绿原酸对照品10.26 mg,置于100 ml 容量瓶中,加甲醇溶解并定容至刻度,摇匀,即得质量浓度为102.6 μg/ml 的绿原酸对照品储备液。精密称取秦皮乙素对照品10.67 mg,置于100 ml 容量瓶中,加甲醇溶解并定容至刻度,摇匀,即得质量浓度为106.7 μg/ml 的秦皮乙素对照品储备液。精密量取绿原酸对照品储备液、秦皮乙素对照品储备液各2 ml,置于同一10 ml 容量瓶中,加甲醇定容至刻度,摇匀,即得质量浓度分别为20.52、21.34 μg/ml 的绿原酸、秦皮乙素混合对照品溶液。
2.3 供试品溶液的制备
取消炎颗粒2 g,精密称定,置于具塞锥形瓶中,精密加入75%乙醇50 ml,称定质量,超声处理(功率320 W,频率40 KHz)30 min;放冷,再称定质量,补足减失的质量,摇匀,滤过;用0.45 μm 微孔滤膜滤过,即得。
2.4 阴性样品溶液的制备
按处方比例称取缺金银花、紫花地丁的其他药材,按制备工艺制备缺金银花、紫花地丁的阴性样品,按“2.3”项下方法制备阴性样品溶液。
2.5 阴性干扰试验
取上述对照品溶液、供试品及阴性对照溶液,按上述色谱条件采用RP-HPLC 法测定,记录色谱图。结果显示,供试品与对照品在相同保留时间处有目标峰,阴性样品无干扰,见图1。
2.6 线性关系考察
精密量取绿原酸、秦皮乙素对照品储备液各1、2、4、6、8 ml,分别置于10 ml 容量瓶中,加甲醇至刻度,按上述色谱条件进样10 μl 测定,记录其峰面积。以对照品进样量为横坐标(X),峰面积积分值为纵坐标(Y),以最小二乘法进行线性回归拟合标准曲线。绿原酸回归方程为Y=686 752X+36 739(r=0.999 9),表明绿原酸进样量在0.103 ~0.821 μg 范围内,其线性关系良好;秦皮乙素回归方程为Y=773 396X+75 261(r=0.999 8),表明秦皮乙素进样量在0.107 ~0.854 μg 范围内,其线性关系良好。
2.7 精密度试验
精密吸取同一混合对照品溶液10 μl,按上述色谱条件重复进样5 次,记录其峰面积。结果显示,绿原酸的RSD为1.38%,秦皮乙素的RSD为1.66%,表明仪器精密度良好。
2.8 稳定性试验
精密吸取同一供试品溶液10 μl,按上述色谱条件分别于0、1、2、4、8、12、24 h 进样测定,每次记录其峰面积。结果显示,绿原酸的RSD为1.52%,秦皮乙素的RSD为1.77%,表明供试品溶液24 h 稳定性良好。
2.9 重复性试验
取同一批样品,按“2.3”项下方法制备供试品溶液,按上述色谱条件进样测定5 次,每次10 μl,记录其峰面积。结果显示,绿原酸的平均含量为0.38 mg/g、RSD为1.52%,秦皮乙素的平均含量为0.18 mg/g、RSD为1.29%,表明本方法重复性好。
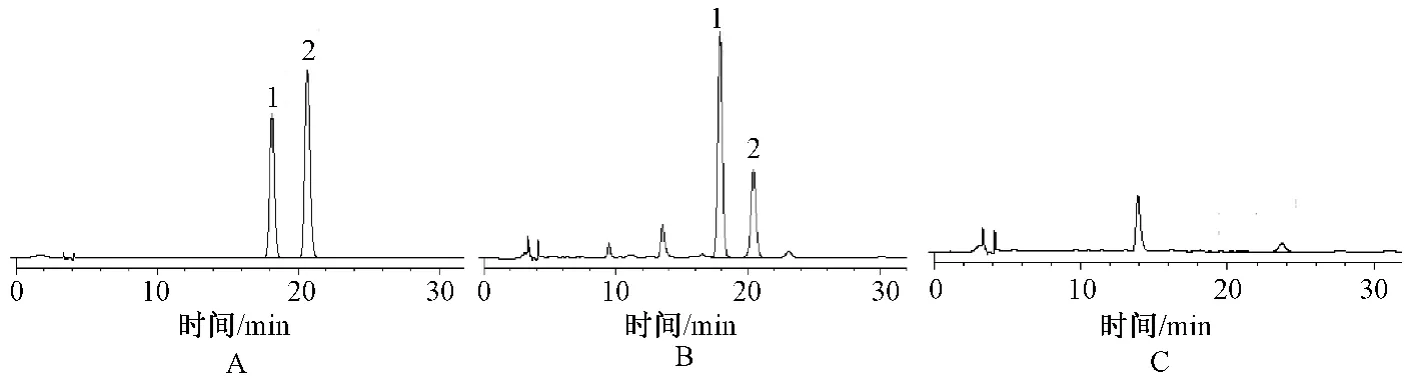
图1 HPLC 图Fig 1 HPLC chromatogram
2.10 加样回收率试验
取已知绿原酸、秦皮乙素含量的消炎颗粒样品1 g,精密称定,按80%、100%、120%分别精密加入绿原酸、秦皮乙素对照品适量,照“2.3”项下方法制备样品溶液,按上述色谱条件进样10 μl,测定峰面积,计算绿原酸、秦皮乙素平均回收率,见表1。
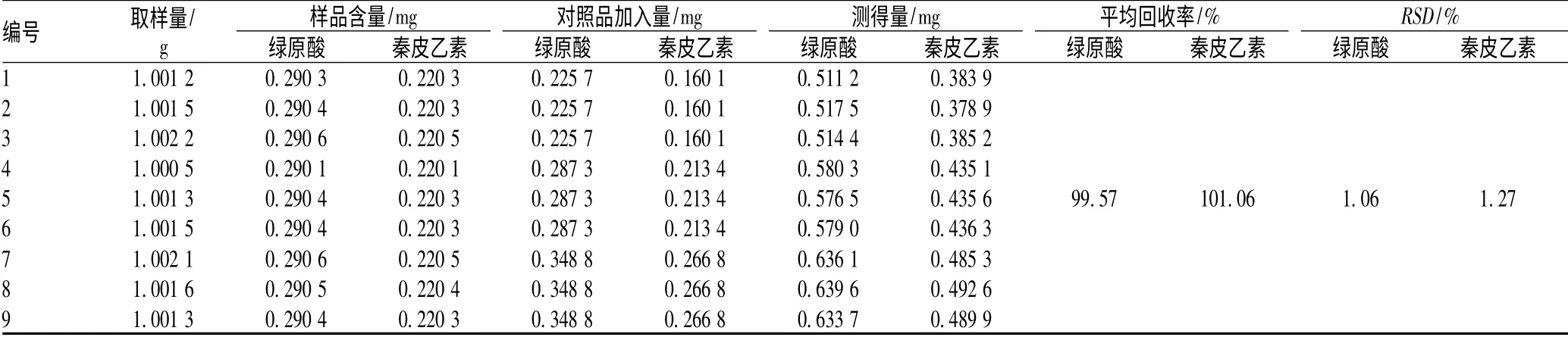
表1 加样回收率试验结果Tab 1 Test results of recovery rate
2.11 样品含量测定
制剂中有效成分含量的高低会影响疗效,控制指标成分含量可以保证产品质量稳定可靠,为制剂质量控制提供技术支持。取3 批样品,分别按“2.3”项下方法制备供试品溶液,按上述色谱条件对3 批样品进行含量测定,结果见表2。

表2 3 批样品中绿原酸、秦皮乙素含量测定结果(mg/g)Tab 2 Determination results of chlorogenic acid and esculetin in three batches samples(mg/g)
3 讨论
3.1 色谱条件的选择
在本研究预实验过程中曾考察以下流动相体系:甲醇-0.4%磷酸溶液梯度(V ∶V =20 ∶80)[2]、乙腈-0.1%磷酸溶液(V ∶V=12 ∶88)[3]、甲醇-冰醋酸(V ∶V =15 ∶85)[4]、乙腈-0.4%磷酸溶液(V ∶V=15 ∶85)[5]。结果显示,在乙腈-0.1%磷酸溶液(V ∶V =10 ∶90)流动相体系下,指标成分色谱峰峰形好,分离度好,柱效高,阴性无干扰,专属性强,可以为同类指标成分的测定提供参考。
3.2 指标成分的选择
选用消炎颗粒组方君臣药中的绿原酸、秦皮乙素成分为质控指标,与该制剂的功能主治相符,符合中医药配伍理论,可客观反映制剂的质量水平。
3.3 样品制备方法的选择
本研究分别选择甲醇[1]、50%甲醇[6]、75%乙醇[7-8]溶液作为溶剂超声30 min 处理样品。结果显示,在3 种溶剂中经超声后,指标成分均分离较好,考虑甲醇毒性较大,故本研究选择75%乙醇为溶剂超声30 min 后,取适量超声液定容后备用。
综上所述,本法分离度好、回收率高、阴性无干扰,且简便、灵敏、准确、重复性好,适用于该制剂的质量控制。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:205-206,317.
[2] 胥爱丽,江洁仪,罗文汇,等.HPLC 法测定紫花地丁配方颗粒中秦皮乙素的含量[J].江西中医药,2013,44(3):61-62.
[3] 阮嫔,方宝霞,时晓亚.高效液相色谱法测定清热消痤合剂中秦皮乙素的含量[J].现代中西医结合杂志,2012,21(6):638-639.
[4] 周燕园.HPLC 法测定墨旱莲配方颗粒中绿原酸和咖啡酸[J].中成药,2012,34(2):374-377.
[5] 孟建升.HPLC 法测定退热饮口服液中绿原酸的含量[J]. 中国药师,2012,15(5):725-726.
[6] 陈胡兰,汤沛然,张梅,等. 不同产地紫花地丁中秦皮乙素的含量比较[J].成都中医药大学学报,2010,33(1):72-73,96.
[7] 黄美娥,卓儒洞,唐莉. 紫花地丁乙醇提取物的抗氧化性研究[J].食品科技,2007,32(2):151-154.
[8] 朱金芳,韩海霞,林聪明,等. 大孔树脂分离纯化菊苣中香豆素的工艺研究[J].中国现代应用药学,2013,30(2):136-139.

