人体肠道菌群对大豆皂苷Ⅱ的体外代谢转化
桑尚源, 光翠娥, 江 波
(食品科学与技术国家重点实验室,江南大学,江苏 无锡214122)
人体肠道菌群对大豆皂苷Ⅱ的体外代谢转化
桑尚源, 光翠娥*, 江 波
(食品科学与技术国家重点实验室,江南大学,江苏 无锡214122)
为考察人体肠道菌群对大豆皂苷Ⅱ的体外代谢转化作用,在牛脑牛心培养液(BHI)和磷酸盐缓冲液(PBS)两种离体模型下,研究了大豆皂苷Ⅱ在48 h内被肠道菌群代谢转化过程,并用HPLC/MS系统对其转化产物进行分析鉴定。结果显示,大豆皂苷Ⅱ先被菌群酶转化为大豆皂苷Ⅳ,在48 h被最终转化为大豆皂苷元B,表明大豆皂苷在肠道微生物作用下,其糖基被逐步水解生成相对分子质量更小、疏水性更强的代谢物。
大豆皂苷Ⅱ;大豆皂苷元B;肠道菌群;高效液相;质谱
大豆皂苷是主要存在于豆科植物中的一类三萜烯葡萄糖苷,在大豆和豆制品中约为0.5~114 μmol/g[1]。根据其苷元及其连接的糖链结构特征,大豆皂苷分为A组、B组、E组和DDMP组。大豆皂苷具有降血脂[2]、降血压[3]、抗病毒、保肝、抗肿瘤、抗炎抗过敏等药理作用[4],有巨大的开发前景。这些大豆皂苷的药理活性功能可能是经肠道菌代谢后所得的活性代谢产物进入血液发挥其疗效[5]。Hu和Chang两人均已报道,在离体实验下大豆皂苷Ⅰ会被肠道微生物脱糖降解,代谢产物为大豆皂苷Ⅲ和大豆皂苷元B[6-7]。2010年,Chang等人报道了人肠道菌群在离体实验下对大豆皂苷Ab的代谢途径[8]。
作为一种具有代表性的皂苷,大豆皂苷Ⅱ是豆制品中皂苷的主要存在形式之一[1],其与大豆皂苷Ⅰ同属B组,见图1[3]。大豆皂苷Ⅱ具有多种生物活性,如抑制人体肾素活性[3]、抗疱疹病毒(HSV-1)[9]和作为免疫佐剂[10]。为探究大豆皂苷在体内的生物利用度和转化代谢产物以及代谢产物和生理活性之间的联系,作者研究了在体外模型中,人肠道菌群是否对大豆皂苷Ⅱ进行相似脱糖降解的代谢转化作用,并且使用HPLC/MS系统对代谢转化产物进行初步的分析鉴定。
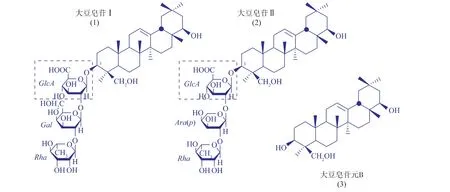
图1 大豆皂苷Ⅰ、Ⅱ和大豆皂苷元B的化学结构Fig.1 Structures of soyasaponinsⅠandⅡand soyasapogenol B
1.1 材料与仪器
大豆皂苷Ⅱ标准品 (AS,纯度 91.7%):ChromaDex公司;碳酸钠、乙醇、十二水合磷酸氢二钠、二水合磷酸二氢钠等:分析纯,国药集团化学试剂有限公司;乙腈、甲酸:色谱纯,Merck公司;BHI培养基(组分g/L):牛脑浸粉12.5,牛心浸粉5,葡萄糖2,蛋白胨10,氯化钠5,十二水合磷酸氢二钠6.3,碳酸钠4,半胱氨酸0.25;刃天青(0.1%)1 mL,pH 7.4,115℃灭菌30 min[11]。
5804R型号离心机:eppendorf公司;DG250厌氧工作站:英国Don Whiteley Science(DWS)公司;YM75压力蒸汽灭菌器:上海三申医疗器械有限公司;WATERS ACQUITY UPLC、WATERS MALDI SYNAPT Q-TOF MS、Masslynx 4.1工作站:美国Waters公司。
1.2 实验方法
1.2.1 在BHI模拟系统中人肠道菌群对大豆皂苷Ⅱ的降解代谢作用取青年健康志愿者新鲜粪便10 g,用100 mL灭菌后的BHI培养液稀释,(500 g离心10 min),得上层液体继续离心(10 000 g离心15 min)得菌体,重悬,离心(10 000 g离心15 min)得到菌体,加入10 mL BHI培养液(灭菌后加入质量浓度为1.5 mg/mL的大豆皂苷Ⅱ),密闭恒温37℃厌氧培养[7],分别于0、12、24、48 h取样2 mL,-20℃冷冻待测。
1.2.2 在PBS模拟系统中人肠道菌群对大豆皂苷Ⅱ的降解催化作用菌体的获得过程同1.2.1,所得菌体加入10 mL磷酸盐缓冲液(pH 7.4,灭菌后加入大豆皂苷Ⅱ,质量浓度1 mg/mL)[12],密闭恒温37℃转化反应,分别于0、4、8、12、24、48 h取样1 mL,-20℃冷冻待测。
1.2.3 代谢转化产物的分析与鉴定样品解冻,离心,取上清液加入三倍体积75%乙醇沉淀蛋白质,再次离心后过微孔滤膜,进行HPLC/MS系统检测。色谱条件:流动相A为乙腈,流动相B为0.1%甲酸,梯度洗脱;流速为0.3 mL/min;柱温45℃;色谱柱BEH C18(1.7 μm,2.1 mm×100 mm);进样量2 μL。质谱条件:离子方式ESI+;毛细管电压3.5 kV;锥孔电压30 V;离子源温度100℃;脱溶剂温度400℃,流速为500 L/h;碰撞能量6 eV;质荷比(m/z)范围50~1 500;检测器电压1 800 V。数据的采集和评估使用MassLynx 4.1工作站。
2 结果与讨论
2.1 人肠道菌群对大豆皂苷Ⅱ的代谢转化结果
一般情况下,大豆皂苷在体内的生物利用度较低,人体吸收少,在肠道内滞留时间长,被肠道微生物中的糖苷酶降解,其含量逐渐降低。本实验在BHI和PBS两种体外模拟系统下采用HPLC/MS系统分别对大豆皂苷Ⅱ进行初步定量测定,结果见图2。

图2 在两种发酵系统中肠道微生物对大豆皂苷Ⅱ的体外代谢对照Fig.2 Comparison of in vitro metabolism of soyasaponinⅡin two fermentation systems
由图2可看出,在左边BHI系统中,12 h后大豆皂苷Ⅱ大部分被降解,这与Hu等人对大豆皂苷Ⅰ被肠道代谢的研究结果相类似[6]。再由图2右边PBS系统得出,大豆皂苷Ⅱ在12 h后全部被降解,说明肠道微生物降解皂苷的糖苷酶类在PBS系统中酶活力更高,这也许是因为在BHI培养液中,微生物需要消耗其它碳源、氮源等物质进行各种其它代谢活动,减少了对大豆皂苷Ⅱ的代谢活力。
2.2 在PBS模拟系统中人肠道微生物对大豆皂苷Ⅱ转化产物的分析与鉴定
在BHI培养液系统中,由于发酵后培养液成分复杂,较难分析鉴定出大豆皂苷的代谢产物,所以只在磷酸盐溶液中分析其转化产物。Zhang等人研究了在磷酸盐溶液(PBS)中多种大豆皂苷被一种肠道益生菌Lactobacillus rhamnosus转化降解[12],并产生一种小分子的物质。在PBS系统中肠道微生物对大豆皂苷Ⅱ的转化结果见图3-4。
由图3可以看出,标准品大豆皂苷Ⅱ在色谱s中保留时间值(RT)为7.38 min,则0 h时样品色谱p中RT=7.41 min的色谱锋即确定为大豆皂苷Ⅱ。根据文献[7-8]报道,大豆皂苷转化产物的色谱峰RT值一般比初始物大,可确定色谱a中RT=7.51 min色谱峰为转化产物M1,色谱b中RT=9.75 min色谱峰为转化产物M2。另根据图4中色谱p、a和b的质谱图并参考文献[13]进一步分析鉴定出,转化产物M1为大豆皂苷Ⅱ糖链末端脱去一个鼠李糖(Rha)生成的大豆皂苷Ⅳ,M2为大豆皂苷Ⅱ脱去整个糖链生成的大豆皂苷元B。大豆皂苷Ⅱ及其转化产物大豆皂苷Ⅳ、大豆皂苷元B的保留时间(RT)值和质谱碎片离子模式数据见表1。

图3 在PBS系统下人肠道菌群对大豆皂苷Ⅱ转化产物的LC/MS离子色谱图Fig.3 Ion chromatograms of soyasaponinⅡ(s,p)and its metabolites(a,b)by human intestinal microflora in the PBS system

图4 色谱p、a和b中各主要色谱峰(RT=7.41、7.51、9.75 min)对应的ESI+质谱图Fig.4 Positive mode mass spectra of soyasaponin II(p,RT=7.41 min),soyasaponin III(a,RT=7.51 min)and soyasapogenol B(b,RT=9.75 min)

表1 大豆皂苷Ⅱ、Ⅳ和大豆皂苷元B的HPLC和MS数据Table 1 HPLC and Mass Spectral Data of SoyasaponinⅡandⅣand Soyasapogenol B
2.3 大豆皂苷Ⅱ在体外PBS模型中代谢动力学模式
人肠道菌群中有许多水解苷键的代谢酶,主要有β-葡萄糖醛酸酶、β-葡萄糖苷酶、硝基还原酶等[14],不同的糖苷酶活力造成代谢积累的皂苷代谢产物不同,进一步会表现出不同的代谢动力曲线。利用HPLC/MS仪器检测不同代谢时间下的样品,使用MassLynx 4.1工作站收集和评估数据得出大豆皂苷Ⅱ的代谢动力学机制,结果见图5。

图5 大豆皂苷Ⅱ在PBS系统中的体外代谢动力学Fig.5 In vitro dynamic metabolism of soyasaponinⅡin PBS fermentation system
由图5看出,4 h时大豆皂苷Ⅱ的含量已明显降低,8 h后几乎完全被微生物酶水解;转化产物大豆皂苷Ⅳ含量在4 h时是最高的,随后逐渐降低,24 h后几乎完全消失;另一种转化产物大豆皂苷元B含量逐步增加,在48 h时达到最大。说明大豆皂苷Ⅱ在此体外模型下被肠道微生物酶转化时,先脱去一个鼠李糖基生成大豆皂苷Ⅳ,再接着脱去阿拉伯糖与葡萄糖酸组成的双糖链,最终生成大豆皂苷元B。这与大豆皂苷Ⅰ具有类似的代谢模式,两者最终会被降解为大豆皂苷元B[7],但A组皂苷中大豆皂苷Ab的降解模式除了产生大豆皂苷元A还会积累带有一分子葡萄糖酸糖链的大豆皂苷元 A[8],说明A组和B组大豆皂苷在肠道中的代谢模式有所不同。
3 结语
大豆皂苷Ⅱ在BHI和PBS两种模拟系统下均会被人肠道微生物降解,而在PBS中会12 h后会完全降解。在0~4 h内大豆皂苷Ⅱ在PBS中被肠内菌群酶水解为大豆皂苷Ⅳ,48 h后代谢转化为大豆皂苷元B。基于这些发现,推测来自膳食或药物的大豆皂苷Ⅱ在人体肠道内会被降解以大豆皂苷Ⅳ和大豆皂苷元B的形式吸收,所以在研究大豆皂苷Ⅱ药理活性的同时,有必要展开对大豆皂苷Ⅳ和大豆皂苷元B的研究。
[1]Hu J,Lee S O,Hendrich S,et al.Quantification of the group B soyasaponins by high-performance liquid chromatography[J]. Journal of Agricultural and Food Chemistry,2002,50(9):2587-2594.
[2]Lee S O,Simons A L,Murphy P A,et al.Soyasaponins lowered plasma cholesterol and increased fecal bile acids in female golden Syrian hamsters[J].Experimental Biology and Medicine,2005,230(7):472-478.
[3]Takahashi S,Hori K,Hokari M,et al.Inhibition of human renin activity by saponins[J].Biomedical Research,2010,31(2):155-159.
[4]刘宏帅,吴晓俊,胡之璧.大豆皂苷药理活性及抗癌机制研究进展[J].国际药学研究杂志,2013,40(1):79-84.
LIU Hongshuai,WU Xiaojun,HU Zhibi.Pharmacological studies and anti-cancer mechanisms of soyasaponins:research advances [J].Journal of International Pharmaceutical Research,2013,40(1):79-84.(in Chinese)
[5]Kim D H.Review:herbal medicines are activated by intestinal microflora[J].Natural Product Sciences,2002,8(2):35-43.
[6]Hu J,Zheng Y L,Hyde W,et al.Human fecal metabolism of soyasaponin I[J].Journal of Agricultural and Food Chemistry,2004,52(9):2689-2696.
[7]Chang S Y,Han M J,Han S J,et al.Metabolism of soyasaponin I by human intestinal microflora and its estrogenic and cytotoxic effects[J].Biomolecules&Therapeutics,2009,17(4):430-437.
[8]Chang S Y,Han M J,Joh E H,et al.Liquid chromatography/mass spectrometry-based structural analysis of soyasaponin Ab metabolites by human fecal microflora[J].Journal of Pharmaceutical and Biomedical Analysis,2010,52(5):752-756.
[9]Kinjo J,Yokomizo K,Hirakawa T,et al.Anti-herpes virus activity of fabaceous triterpenoidal saponins[J].Biological& Pharmaceutical Bulletin,2000,23(7):887-889.
[10]Oda K,Matsuda H,Murakami T,et al.Adjuvant and haemolytic activities of 47 saponins derived from medicinal and food plants [J].Biological Chemistry,2000,381(1):67-74.
[11]Zheng Y,Hu J,Murphy P A,et al.Rapid gut transit time and slow fecal isoflavone disappearance phenotype are associated with greater genistein bioavailability in women[J].Journal of Nutrition,2003,133(10):3110-3116.
[12]Zhang W,Tang F Y,Yeo M C,et al.Fermentation of group B soyasaponins with probiotic Lactobacillus rhamnosus[J].Journal of Food Biochemistry,2012,36(2):179-188.
[13]肖军霞,张声华.大豆皂苷的高效液相色谱-电喷雾串联质谱研究[J].中药材,2006,29(3):229-232.
XIAO Junxia,ZHANG Shenghua.Study on syasaponins by HPLC-electrospray ionization tandem mass spectrometry[J].Journal of Chinese Medicinal Materials,2006,29(3):229-232.(in Chinese)
[14]夏小燕,居文政,谈恒山.肠道菌群对中药皂苷类成分的代谢研究进展[J].中国中医药信息杂志,2008,15(2):96-98.
XIA Xiaoyan,JU Wenzheng,TAN Hengshan.Metabolism of saponins from the TCM by intestinal microflora:research advances [J].Chinese Journal of Information on Traditional Chinese Medicine,2008,15(2):96-98.(in Chinese)
In vitro Metabolism of Soyasaponin II by Human Intestinal Microflora
SANG Shangyuan, GUANG Cuie*, JIANG Bo
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
To investigate the metabolism of soyasaponin II by human intestinal microorganisms,the in vitro metabolic transformation of soyasaponin II by intestinal flora in the Brain Heart Infusion(BHI)broth and Phosphate Buffered Saline (PBS)systems was studied for 48 hours,and its metabolites were analyzed and identified by HPLC/MS.The results showed that soyasaponin II was firstly metabolized into soyasaponin IV by intestinal flora and was eventually translated into soyasapogenol B at 48 hours.The above results suggested that soyasaponins lost their sugar moieties due to hydrolysis and yielded smaller and more hydrophobic metabolites by human gut microorganisms.
soyasaponin II,soyasapogenol B,intestinal microflora,HPLC,MS
R 285.5
A
1673—1689(2015)05—0470—05
2014-03-07
国家自然科学基金项目(31201289);食品科学与技术国家重点实验室自主探索课题(SKLF-ZZB-201208)。
*通信作者:光翠娥(1976—),女,湖北仙桃人,工学博士,副教授,硕士研究生导师,主要从事食品营养与功能因子方面的研究。
E-mail:guang1226@hotmail.com

