镰刀菌Fusariumsp sp.JN 158色素的鉴定及其抗肿瘤活性
郑里翔, 蔡宇杰, 徐敏娟, 李昌伟,王巧凤, 王 月, 孟宪明, 廖祥儒*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江西中医药大学 基础医学院,江西 南昌330004)
镰刀菌Fusariumsp sp.JN 158色素的鉴定及其抗肿瘤活性
郑里翔1,2, 蔡宇杰1, 徐敏娟2, 李昌伟1,王巧凤2, 王 月2, 孟宪明2, 廖祥儒*1
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江西中医药大学 基础医学院,江西 南昌330004)
通过对镰刀菌发酵所产色素的分离及结构的分析,筛选其抗肿瘤的活性成分。采用形态与分子生物学方法对镰刀菌株鉴定,利用HPLC的对该菌株发酵所产的色素进行分离,分离的产物用紫外、红外、核磁进行结构鉴定,使用MTT的方法筛选抗肿瘤的活性成分。结果表明:该镰刀菌所产色素共6个不同的峰,相对分子质量均在380左右,其中VI号峰结构新颖,为花青苷类色素,分子式为C17H18O10,能抑制A539、MCF-7、MKN-45、HepG2、SW620五种不同肿瘤细胞的增殖,并呈现浓度的依赖性,其中MCF-7乳腺癌细胞抑制最明显(P<0.01),故VI号峰色素可能是一种很有前景的防治乳腺癌的化合物。
镰刀菌;色素;结构;抗肿瘤
色素广泛应用于食品工业、医药等行业,色素一般分为天然色素和合成色素。天然色素主要来源于植物、动物和微生物等,一般具有营养保健功能;合成色素虽然有很多优点,但有毒性和致癌性,因此,合成色素正逐渐被天然色素取代。微生物色素是天然色素的重要发展方向,可以不受季节、材料等限制,可连续不断的发酵生产,能满足日益增加的社会需求,而且大部分微生物色素具有一定的生物学活性[1-4]。
镰刀菌作为一类在自然界中广泛存在和分布的真菌微生物,对其研究主要集中在致病机理上。近年来,随着人们对于天然色素需求的增加,对镰刀菌所产的色素也引起人们的关注,开发利用也逐渐增加[5-6]。而镰刀霉菌产色素抗肿瘤的报道很少。作者将传统的形态学方法与现代分子生物学技术相结合,对该镰刀菌进行了鉴定;同时对镰刀菌所产的色素进行分离和结构的鉴定,并对部分成分进行抗肿瘤的活性研究。
1 材料与方法
1 1主要仪器与试剂
1.1.1 仪器超净工作台 (SW-CJ-1f):苏州净化厂;回转式恒温摇床(HZC-250):广州医疗器材厂;恒温恒湿培养箱(LHS-250 HC):苏州医疗器材厂;分光光度计(UV-3000):日本日立公司;立式压力蒸汽灭菌锅(YXD-LS-60):江苏仪器厂;液质联用仪(Waters Platform ZMD4000):美国waters公司;核磁共振仪(AVANCE III 400 MHz):傅立叶红外光谱仪(NICOLET NEXUS 470):美国;冷冻干燥机(EZ585Q):江苏吴中;扫描电子显微镜 (Quata-200):日本三菱。
1.1.2 试剂葡萄糖、果糖、乳糖、D-半乳糖、甘油、蔗糖、麦芽糖、尿素、硫酸铵、丙酮、氯仿、无水乙醇、盐酸、异丙醇、二甲基亚砜(DMSO)、柠檬酸、苯甲酸钠、三氟乙酸(TFA),以上均为分析纯,购自上海国药集团;四甲基偶氮唑盐(MTT):购自美国Sigma公司。
1.2 方法
1.2.1 镰刀霉菌培养基
1)PDA斜面培养基 (g/L):土豆200,葡萄糖20,琼脂20,pH自然;
2)种子培养基(g/L):土豆 200,葡萄糖20,pH自然;
3)液态发酵培养基(g/L):土豆200,葡萄糖20,牛肉膏3,pH自然。
1.2.2 菌株的形态学特征将供试菌株接种在培养基平板上,30℃培养,对病原菌在培养基上的菌落形态、生长情况、颜色以及孢子形状、大小、产孢结构等进行观察,将菌株的菌丝、孢子用电子显微镜及光学显微镜(石碳酸-棉蓝染色)观察,并拍照记录,并依据镰刀菌的分类系统[7-9],对镰刀菌菌株进行鉴定。
1.2.3 菌株的分子生物学鉴定采用CTAB法[10]提取镰刀菌基因组RNA,使用真菌26 rRNA基因间隔区通用引物(ITS1/ITS4)[11],对镰刀菌分离物的基因组rRNA进行PCR扩增,序列全长为606 bp,测序,获得的 ITS序列在 GenBank数据库(http://www. ncbi.nim.nih.gov/blast)中进行同源性比较。
1.2.4 镰刀霉菌的培养及色素提取从斜面培养基上挑取一小块菌落,转接到有种子培养基的三角瓶(250 mL三角瓶中装液量50 mL),30℃下旋转式摇床以200 r/min的转速培养36 h,以5%的接种体积分数接种到50 L的发酵罐中发酵72 h。
发酵液经10 000 g离心10 min,收集紫色菌体,加入4倍体积的95%酸性乙醇溶液 (乙醇-盐酸=9∶1)浸提过夜,得到色素提取液,用1 mol/L NaOH调PH至7.8左右,离心得到紫色沉淀,即得色素粗品。
1.2.5 色素的HPLC分离分离条件:色谱柱Phecda C18(5 μm,4.6 mm×250 mm),柱温25℃;DAD检测器检测波长254 nm;流量1.0 mL/min,进样量10 μL,流动相A为含体积分数0.1%TFA(氟乙酸)的乙腈,流动相B为含体积分数0.1%TFA的蒸馏水,梯度洗脱程序见表1。

表1 流动相梯度程序Table Gradient program of mobile phase
1.2.6 镰刀霉菌发酵产紫色素结构的分析
1)紫外光谱分析:取紫色素纯品2 mg溶于乙腈-三氟乙酸 (10∶1)中,通过 Waters Platform ZMD4000进行液质分析,液相扫描选择的波长为200~750 nm,然后利用Masslynx V4.1软件分析出该色素紫外图谱。
2)红外光谱分析(IR):取紫色素纯品2 mg,与200 mg干燥的KBr研磨混匀,用傅立叶变换红外光谱仪在4 000~400 cm-1区间扫描,扫描次数:32次,分辨率:4 cm-1。
3)核磁共振(NMR)分析:用氘代三氟乙酸将待测样品溶于5 mm标准的NMR管中,加入少量TMS作为基准参照物进行测定。
1.2.7 MTT比色法测定色素对不同肿瘤细胞增殖的影响用含10%胎牛血清的完全培养基,培养肺腺癌细胞A539、乳腺癌MCF-7、人胃癌细胞MKN-45、肝癌HepG2细胞株、大肠癌细胞株SW620等5种不同的细胞株 (上述细胞均购于上海细胞所),MTT方法参照文献[12],将制好的含细胞的完全培养液加入96孔培养板中,色素终浓度分别为5、10、15 μmol/L,对照组加入含等体积盐酸乙醇的新鲜完全培养液200 μL;阳性药物乌苯美司终浓度为(IC50)10 mmol/L,对照组含1%的醋酸培养液[13]。每组均为15个复孔,选择490 nm波长,在酶联免疫检测仪上测定各孔吸光度(A)。
1.3 统计学方法
应用SPSS11.5统计软件进行数据处理,数据采用均数±标准差(x±s)表示。两组间比较将采用LSD、Hochberg's GT2、Games-Howell统计学方法进行统计处理。取α=0.05做为显著性检验标准,以P<0.05为差异有显著性意义。
2 结果与分析
2.1 平板生长特性
将镰刀菌株接种于PDA固态培养基的平皿中,30℃恒温培养,观察菌体生长状态。培养3~4 d后,菌落中央的菌丝体顶部呈白色丛毛突起,菌落边缘整齐,菌丝体呈白色绒毛状,菌落背面呈紫色;7~8 d后,气生菌丝发达,密集丛立,少匍匐,菌落致密,质地呈棉絮状平展,菌落上有一层白色孢子,菌落和培养基紧密连接,难以挑取,无渗出液,无特殊气味。
2.2 显微形态特征
镜下观察发现透明分隔状菌丝,有顶生、间生的厚壁孢子和较多肾形小分生孢子,呈头状着生于不分支的分生孢子梗上,大分生孢子多见,呈镰刀状,两头尖,2~4个分隔,无足细胞或顶端突起。根据菌体形态特征的研究,查阅《真菌鉴定手册》[14]和《中国真菌志》[15],初步鉴定菌株为镰刀霉菌JN158。
2.3 镰刀菌株JN158的rRNA基因间隔序列测定
通过PCR扩增得到的26S rRNA基因间隔序列的D1/D2区,序列全长为606 bp,见图1。经GenBank,其登录号为HQ265299。根据BLAST结果,取相似度较高的序列列表,见表2。通过表2的分析发现,与Fusarium sp的26S r RNA基因其相似度为100%,因此结合菌株的形态特征,确定菌株JN158属于镰刀霉菌属,命名为Fusarium sp JN158。
2.4 利用HPLC对Fusarium sp.JN158产色素的分离纯化
本实验HPLC选用C18柱,对色素分离效果较好,由图2可看出有6个峰,与LC/MS分析的出峰数基本上一致(数据未显示),分别标记成Ⅰ~Ⅵ(图2a),Ⅵ峰的峰相对最高(图2b),与周围杂峰距离也较远,该组分较易分离纯化,所以只对这一组分进行了制备。
2.5 Fusarium sp.JN158紫色素结构的鉴定
2.5.1 紫色素的紫外光谱分析早期对有色的有机化合物研究发现,颜色的发生与分子中存在不饱和基团或体系有关如>C=C<、>C=O、—N=N—、苯环等,把这些基团或体系称为生色团。紫外光谱仅提供分子中的共轭体系和某些基团的结构信息。通过LC/MS的分析,得到该色素的紫外吸收光谱见图3。可以看出,该化合物在紫外区有两条吸收带,分别为253 nm和274 nm,可初步判断该色素是一种带苯环的化合物。

图1 镰刀菌Fusarium JN158 26S rRNA基因间隔区序列Fig.1 Gene sequence of Fusarium sp JN158 26S rRNA Spacer

表2 用于同源比对的镰刀菌 (Fusarium)真菌的RNA序列Table 2 RNA sequences from Fusarium used for alignment with the new sequence

图2 HPLC分离色素Fig.2 HPLC separate pigment
2.5.2 紫色素的质谱分析一级质谱主要是用于分析目标分子的相对分子质量,该紫色素的一级质谱图见图4,可以看出该色素的相对分子质量为382.0。
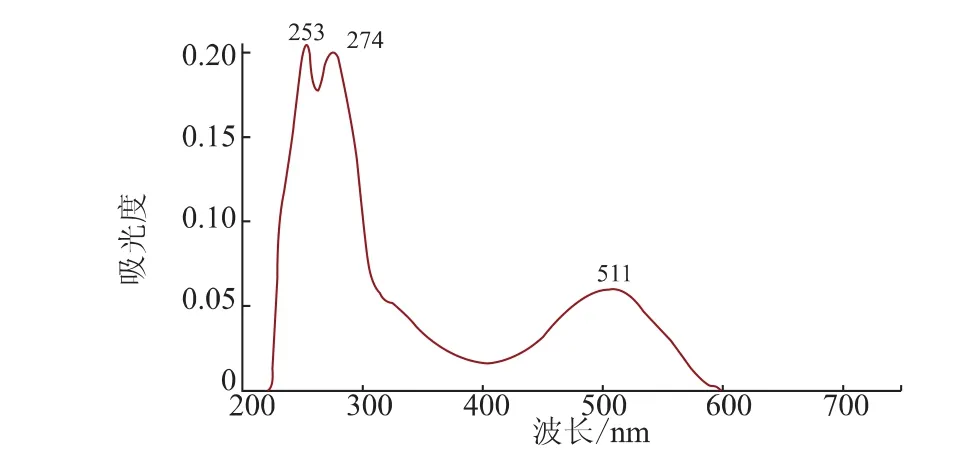
图3 紫色素的光谱扫描图Fig.3 Spectrum of purple pigment
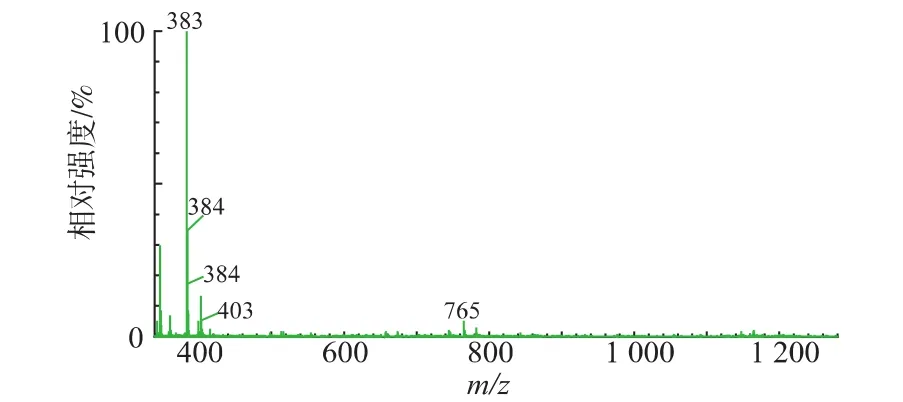
图4 Fusarium JN158紫色素的正离子质谱图Fig.4 MS spectra of purple pigment from Fusarium JN158
2.5.3 紫色素的红外光谱分析红外光谱是记录有机分子吸收红外光后产生化学键振动而形成的光谱吸收,测定范围一般为4 000~400 cm-1,常用来确定各种羧基、烷烃、芳环及炔烃等基团的特征吸收峰。基团频率区在4 000~1 300 cm-1之间,在1 800 cm-1(1 300 cm-1)~600 cm-1区域内,除单键的伸缩振动外,还有因变形振动产生的谱带。O—H基的伸缩振动出现在3 650~3 200 cm-1范围内;-CH2基的吸收峰出现在2 930 cm-1和2 850 cm-1附近;C=O伸缩振动出现在1 900~1 650 cm-1范围内;苯的衍生物的泛频谱带,出现在2 000~1 650 cm-1范围,是C—H面外和C=C面内变形振动的泛频吸收;频率范围在1 500~1 300 cm-1为C—H弯曲振动区;酚的相应谱带在较高频率1 200~1 280 cm-1;醇的C—O出现在1 000~1 200 cm-1。结合图5,该紫色素的红外光谱分析结果汇总见表3。
2.5.4 紫色素的核磁共振(NMR)分析
1)1H核磁共振图谱分析:从图谱的位移值及峰形来看,化学位移11.500为烯醇的H;化学位移5.384与芳环中的羟基中的H一致;化学位移3.908为醇羟基中的H;化学位移4.550为甲氧基相连的CH2中的H;化学位移4.053与羟基相连的CH2的H一致;化学位移4.486为C=C—OCH3中的H;化学位移3.527为C—C—OCH3中的H。
2)13C核磁共振图谱分析:从图谱的位移值及峰形来看,化学位移178.67、176.12与羧基中的C一致;化学位移53.12、53.71、55.68为甲氧基中的C,表明该色素含有3个甲氧基,其中2个是对位的,与氢谱结果一致;化学位移157.42为苯环中与羟基相连的C;化学位移为C=C中接羟基的碳;化学位移56.27与C—OH中的C一致。
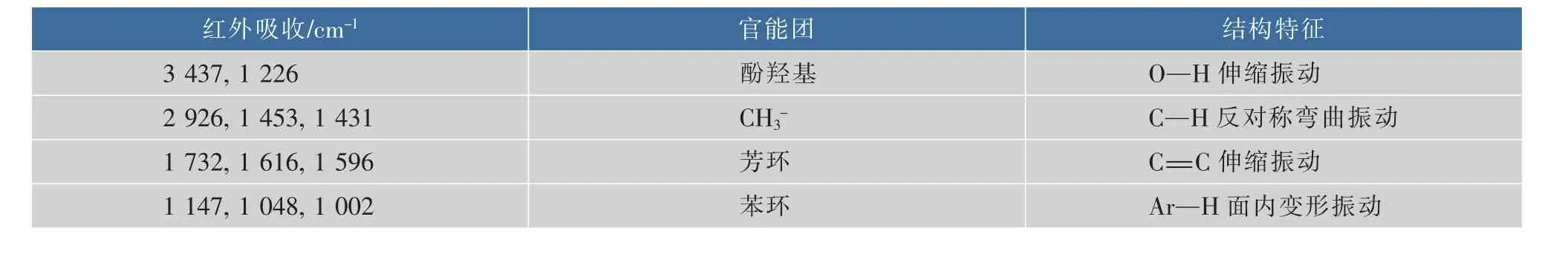
表3 Fusarium sp.JN158紫色素的红外光谱分析结果Table 3 IR spectrum results of purple pigment from Fusarium sp.JN158
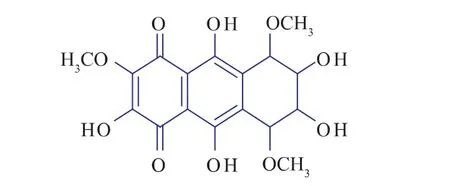
结合紫色素的性质及质谱与红外的光谱分析,通 过 COSY (Correlated Spectroscopy)、HMQC(Heteronuclear Multiple Quantum Coherece)、ROESY(Rotaing Frame Overhauser Efect Spectroscopy)及MLEV[M.Levitt(broadband composite decoupling sequence)]对1H、13C核磁共振谱峰进行准确的归属,确定了该色素的相对分子质量为382.0,分子式为C17H18O10,结构为:
2.6 镰刀霉菌产VI号化合物对不同瘤株细胞增殖的影响
MTT比色实验法检测Fusarium sp.JN158产VI号化合物对MCF-7、A549、NKM-45、SW 620结肠癌细胞、HePG2肝癌细胞5种肿瘤细胞增殖的影响,使用5、10、15 μmol/L 3个不同浓度的VI号化合物和乌苯美司(IC5010 mmol//L)作用于肿瘤细胞24 h,乌苯美司(Ubenimex)是从网状橄榄链霉菌培养液中发现的一种具有抗菌作用和免疫增强作用的小分子二肽化合物,相对分子质量与VI相似,已有体外研究表明,乌苯美司可诱导人非小细胞肺癌细胞、人白血病细胞等凋亡。
通过酶联免疫检测仪而测出的490 nm波长下的各组吸光度(A)值,见表4。
可以看出,VI号化合物对MCF-7、MKN-45、A549、SW 620、HePG2均有不同的抑制作用,并呈现浓度的依赖性,其中MCF-7有明显的抑制作用。在相同浓度的情况下,色素对所有肿瘤细胞的抑制均要优于阳性药物—乌苯美司,对正常人脐带静脉内皮细胞(HUVEC)没有影响(数据没有在表中列出),提示VI号化合物可能是一种有应用开发前景的抗肿瘤化合物。
3 结语
本研究使用的霉菌是根据霉菌的形态特征和培养性状的观察结果,参照Booth的镰刀菌分类系统及其生物学特点,根据26SRNA间隔测序的结果,判断为Fusarium sp.B158镰刀菌。
镰刀菌 Fusarium sp.B158发酵所使用的培养基只需要葡萄糖和土豆,培养基所用的成本低廉。发酵的产物在酸性乙醇中(pH 1.5左右)呈现红色,在碱性条件下(pH 7~8)变成紫黑色,并有结晶沉淀。该色素不溶于水,可溶于酸性乙醇。
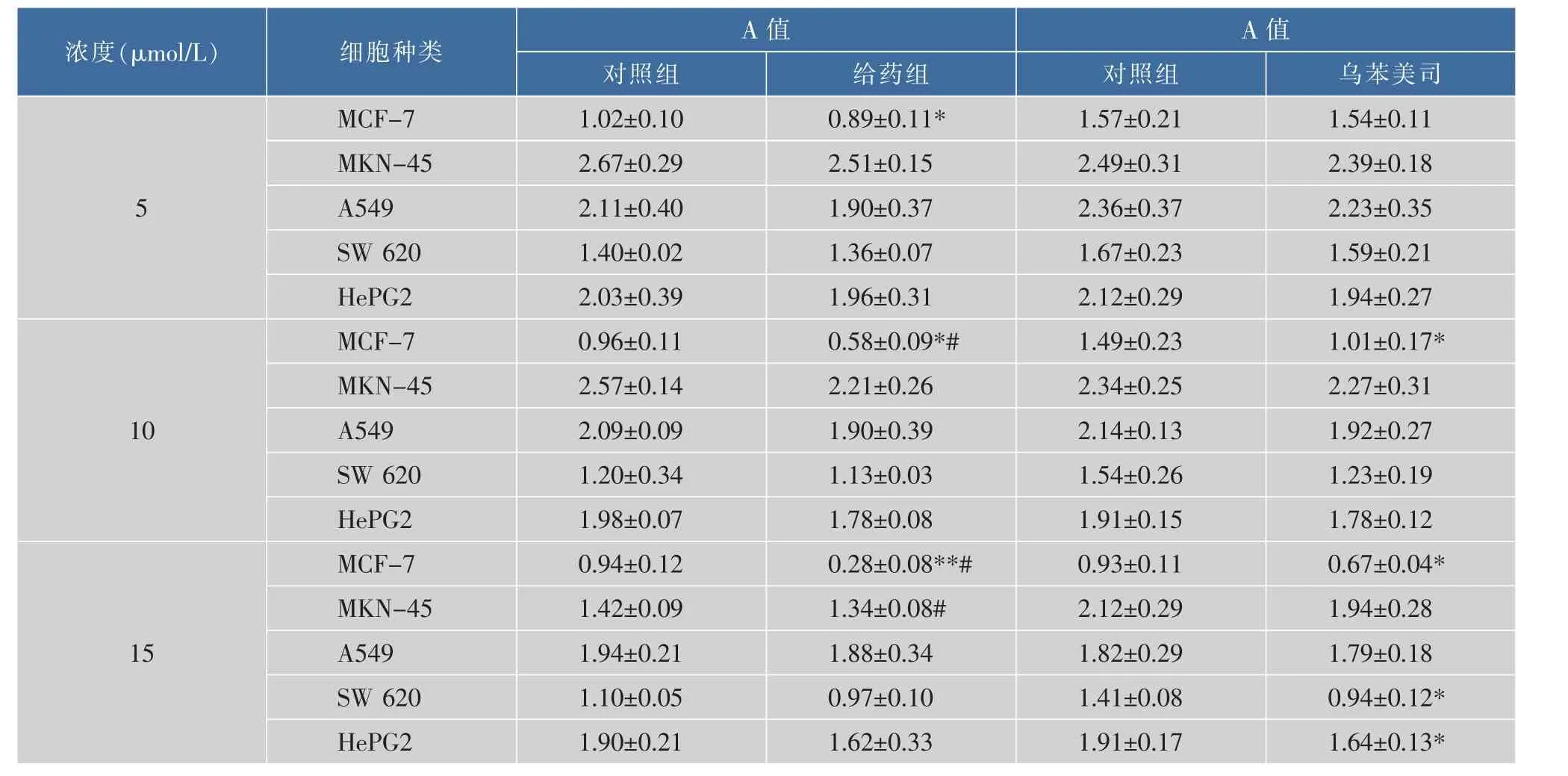
表4 VI号化合物对不同肿瘤细胞增殖的影响(x±s)Table 4 Effect of different cancer cell proliferation from NO.6 compound
通过色素的液相分离和制备实验,选择最佳流动相和最佳洗脱程序,分离得到6个峰,其中VI号峰远离其余的峰,通过液相制备系统制得纯度约98%。
质谱实验可知VI号峰的相对分子质量为382,结合有机元素实验数据,推测可能的分子式是C17H18O10,是花青苷类色素。通过科技查新可知:没有这种相对分子质量的分子式报道,故VI号峰的色素可能是一种新的化合物。
为证实该色素的功效特点,选择常见的5种瘤株,测定VI号化合物对肿瘤细胞的影响。结果发现,这个化合物对上述5种肿瘤细胞瘤株均具有抑制作用,而对MCF-7乳腺癌细胞抑制最为明显(P<0.05),而对正常细胞没有毒性作用(结果未在文章中显示),提示这可能是一种潜在的有开发前景的防治乳腺癌的化合物。
[1]周波,吴吉林,朱明军,等.微生物黄色素的研究进展[J].微生物学通报,2010,37(9):1362-1368.
ZHOU Bo,WU Jilin,ZHU Mingjun,et al.Research progress of microbial yellow pigment[J].Microbiology China,2010,37(9):1362-1368.(in Chinese)
[2]赵春安,李海燕,柳陈坚.微生物色素的生物合成及其遗传工程研究进展[J].现代化工,2009,29(12):35-37.
ZHAO Chunan,LI Haiyan,LIU Chenjian.Microbial pigment biosynthesis and genetic engineering progression[J].Modern Chemical Industry,2009,29(12):35-37.(in Chinese)
[3]孙肇喝,杨秀萍.放线菌素研究进展[J].首都师范大学学报:自然科学版,2011,32(2):54-57.
SUN Zhaohe,YANG Xiuping.Research progress of actinomycin[J].Journal of Capital Normal University:Natural Science Edition,2011,32(2):54-57.(in Chinese)
[4]李洪波,杜巍,赵凯,等.灵茵红素研究进展[J].生物技术通讯,2012,22(1):139-141.
LI Hongbo,DU Wei,ZHAO Kai,et al.Research progress of Ling Yin red pigment[J].Letters in Biotechnology,2012,22(1):139-141.(in Chinese)
[5]李昌伟,蔡宇杰,廖祥儒,等.镰刀霉菌(Fusarium JN158)紫色素的提取及理化性质[J].食品科学,2012,33(3):131-133.
LI Changwei,CAI Yujie,LIAO Xiangru,et al.Extraction and physico-chemical properties of purpurin pigment from liquid-cultured mycelia Fusarium sp B158[J].Food Science,2012,33(3):131-133.(in Chinese)
[6]王永威,沈健增,蔡宇杰,等.镰刀霉菌(Fusarium sp)JN158色素提取和分离技术的研究[J].Journal of Food Science and Biotechnology,2013,32(1):167-171.
WANG Yongwei,SHEN Jianzeng,CAI Yujie,et al.Research of extraction and separation on pigment of Fusarium sp JN158 and [J].Journal of Food Science and Biotechnology,2013,32(1):167-171.(in Chinese)
[7]Booth C.The genus fusarium commonwealth mycological institute[M].England:Kew Surrey,1971.
[8]Brayford D.The identification of fusarium species[M].Egham:international Mycological Intitute Press,1993.
[9]Leslie J F,Summerell B A.The fusarium laboratory manul[M].Iowa:Blackwell Professional Publishing,2006.
[10]Kuniyasu K,Kishi K. Seed transmission of Fusarium wilt of bottle gourd,Lagenaria siceraria Stand1,used as rootstock of watermelon.II.The seed infection course from the infected stem of bottle gourd to the fruit and seed[J].Annals of the Phytopathological Society of Japan,1977,43(2):192-198.
[11]O Donnell K,Cigelnik E,Casper H H.Molecular phylogenetic,morphological,and mycotoxin data support reidentification of the Quorn mycoprotein fungus as Fusarium venenatum[J].Fungal Genetics and Biology,1998,23(1):57-67.
[12]郑里翔,刘红宁,舒洋,等.不同体质血清对A549肺癌细胞周期蛋白表达的影响[J].中华中医药杂志,2012,27(2):324-326.
ZHENG Lixiang,LIU Hongning,SHU Yang,et al.The effect of different constitution serum on Cyclins/Cdk expression of A549 lung cancer[J].China Journal of Traditional Chinese Medicine and Pharmacy,2012,27(2):324-326.(in Chinese)
[13]郑艳波,弓建华,李毅,等.乌苯美司抑制肿瘤细胞侵袭与诱导凋亡的研究[J].药学学报,2012,47(12):1593-1598.
ZHENG Yanbo,GONG Jianhua,LI Yi,et al.Reseach of Ubenimex inhibiting tumor cell invasion and induced apoptosis[J].Acta Pharmaceutica Sinica,2012,47(12):1593-1598.(in Chinese)
[14]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[15]孔华忠.中国真菌志[M].北京:科学出版社,2007.
Pigment Production by Fermentation of Fusarium(Fusarium sp.JN158)and It's Anti-Cancer Activity
ZHENG Lixiang1,2, CAI Yujian1, XU Minjuan2, LI Changwei1,WANG Qiaofeng2, WANG Yue2, MENG Xianming2, LIAO Xiangru*1
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Basic Medicine,Jiangxi University,Nanchang 330004,China)
Through the separation and structural analysis of the pigment produced by Fusarium fermentation,the research aims to screen the anti-tumor active components.Fusarium was identified by using morphological and molecular biology methods.The pigmen was isolated by HPLC,the production structure was identified by UV,IR,NMR.,and the screening of anti-tumor activity was by MTT.The results showed that the pigment from Fusarium produced a total of six different peaks,the molecular weight is about 380,the VI peak,which is the anthocyanins,can inhibit the A539,MCF-7,MKN-45,HepG2,SW620 five different tumor cell proliferation in a concentrationdependent manner,among them MCF-7 breast cancer cells were inhibited most(P<0.01),so the VI compound with a new structure from Fusarium sp JN 158,may be a good treatment for breast cancer.
Fusarium,pigment,structure,anti-tumor
R 915
A
1673—1689(2015)02—0463—07
2014-01-03
国家自然科学基金项目(8116031);国家级大学生创新创业项目(2013)。
郑里翔(1965—),男,江西南昌人,医学硕士,教授,博士研究生导师,主要从事分子肿瘤方面的研究。E-mail:zlx000168@126.com
*通信作者:廖祥儒(1964—),男,江西赣州人,理学博士,教授,博士研究生导师,主要从事发酵工程方面的研究。
E-mail:13771104596@163.com

