抗CTLA-4抗体联合阿霉素治疗小鼠乳腺癌的疗效及机制分析
沈文状,董 鸿,张 林,刘谨文
(华中科技大学同济医学院附属同济医院甲乳外科,武汉 430030)
抗CTLA-4抗体联合阿霉素治疗小鼠乳腺癌的疗效及机制分析
沈文状,董 鸿,张 林,刘谨文△
(华中科技大学同济医学院附属同济医院甲乳外科,武汉 430030)
目的 探讨抗细胞毒性 T 淋巴细胞相关抗原(CTLA-4)抗体联合阿霉素治疗小鼠乳腺癌的疗效及机制。方法以小鼠乳腺癌细胞系4T-1接种Balb/c小鼠建立模型,随机分为空白组、溶剂组、单用抗CTLA-4抗体组、单用阿霉素组、联合用药组。观察各组小鼠肿瘤生长,脾和骨髓的细胞亚型,对肿瘤微环境中凋亡细胞和微血管密度(MVD)进行检测。结果单用抗CTLA-4抗体组、单用阿霉素组、联合用药组小鼠肿瘤体积均显著低于空白组、溶剂组(P<0.05),且联合用药组小鼠肿瘤体积和质量显著低于单用抗CTLA-4抗体组、单用阿霉素组小鼠肿瘤体积(P<0.05)。与空白组、溶剂组相比,单用抗CTLA-4抗体组、单用阿霉素组和联合用药组的荷瘤小鼠脾中 CD8+T和CD4+T 细胞占淋巴细胞的百分比显著增高(P<0.05)。联合用药组肿瘤细胞凋亡的阳性百分率显著高于其他组(P<0.05)。联合用药组MVD显著低于其他组,且单用抗CTLA-4抗体组和单用阿霉素组MVD显著低于空白组和溶剂组(P<0.05)。结论联合抗CTLA-4抗体和阿霉素可在一定程度提高小鼠机体免疫力,明显抑制乳腺癌小鼠肿瘤生长,促进肿瘤微环境中肿瘤细胞凋亡,减少肿瘤微环境中微血管生成,效果优于单一用药。
乳腺肿瘤;表柔比星;免疫;抗CTLA-4抗体
细胞毒性T淋巴细胞相关抗原(cytotoxic T lymphocyte antigen,CTLA-4)是白细胞表面抗原CD152,为跨膜蛋白,属于 CD28 家族成员,主要表达在活化的T细胞表面[1]。其配体为CD80/CD86(B7-1/B7-2),CTLA-4与CD80/CD86的亲和力远远高于CD28,具有抑制T淋巴细胞的活化,调节免疫应答强度的作用[2-3]。研究发现,在乳腺癌患者体内,CTLA-4对免疫细胞有抑制作用,从而抑制了机体的抗肿瘤免疫,被认为是机体肿瘤免疫逃逸发生的机制之一[4]。因此,以CTLA-4为靶点治疗乳腺癌成为研究的热点,可以达到治疗乳腺癌的目的[5]。CTLA-4抗体单独使用具有一定的抗肿瘤免疫作用,联合其他治疗方案效果更佳,包括联合多种化疗药、放疗等治疗方法,生物制剂[如细胞因子:白细胞介素-2(IL-2)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)等],细胞疫苗(T 细胞疫苗、DC 疫苗、肿瘤细胞疫苗等)[5-7]。本文将抗 CTLA-4 抗体联合阿霉素使用,探讨其对乳腺癌小鼠的疗效及其抗肿瘤机制,现将结果报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物及细胞 Balb/c小鼠,雌性,7~8周龄,平均体质量20 g,购自北京大学实验动物中心,无特定病原体(SPF)级条件下饲养。乳腺癌细胞系4T-1为同济医科大学附属医院冻存,用含10%胎牛血清(FBS)的RPMI 1640培养基培养,培养于湿度适中的细胞培养箱中,培养条件:5% CO2,37 ℃。
1.1.2 主要仪器及试剂 超净工作台(AIRTECH,苏净集团安泰公司);台式低温高速冷冻离心机(3K3,Sigma,美国);小动物活体成像(Caliper Lifesciences);流式细胞仪(FACSCantoTMⅡ型,美国BD公司产);牛血清清蛋白(Albumin Bovine,Sigma);RPMI 1640(GIBCO);0.25%胰酶消化液和青霉素/链霉素(Hyclone公司);TUNEL 细胞凋亡试剂盒(Promega);氨基联苯胺(DAB)显色试剂盒及Envision二步法免疫组织化学试剂盒均为武汉博士德生物工程有限公司生产。FITC anti-mouse CD3、PE anti-mouse CD8a、PE anti-mouse Gr-1、APC anti-mouse CD11b、APC anti-mouse CD4及PE-Cy7 anti-mouse CD25为BioLegend产品。
1.1.3 实验用药 实验药物为小鼠抗CTLA-4单克隆抗体(Cat#MAB434),购自Serotec公司。阿霉素为注射用盐酸多柔比星,为意法玛西亚生产。
1.2 方法
1.2.1 荷瘤小鼠模型的建立及分组 Balb/c小鼠采用随机数字表法分为5组,每组6只。4T-1 在培养瓶中传代2次后,取对数生长期细胞,将细胞浓度调整为7.5×106个/mL,置于冰上备用。将小鼠的接种部位的毛减掉,取上述收集的4T-1单细胞悬液,充分混合均匀,用1.0 mL注射器接种0.2 mL于每只小鼠右侧腹股沟皮下。肿瘤直径为6~9 mm时采用随机数字表法分为5组,分别为空白组、溶剂组、单用抗CTLA-4抗体组、单用阿霉素组、联合用药组。抗CTLA-4抗体按100 ng/只,每3天腹腔注射1次;阿霉素按2 mg/kg,每天尾静脉注射1次。每天观察小鼠存活状态,并扪及肿瘤结节生长情况,治疗后每隔2天,用小动物超声检测一次肿瘤大小。
1.2.2 检测项目
1.2.2.1 肿瘤抑制效应 治疗后的第31天,测量小鼠肿瘤大小:采用颈椎脱位术处死小鼠,肿瘤标本取出后先称瘤质量。成瘤后每2天测量小鼠体质量、肿瘤最长径(a)及与之垂直的横径(b),根据公式V=1/2ab2计算移肿瘤体积,绘制肿瘤生长曲线。
1.2.2.2 流式细胞检测 取小鼠的脾,制备脾单个核细胞样本;取小鼠的股骨制备成骨髓单个核细胞样本。T淋巴细胞检测:分别用FITC-CD3e,APC-CD4 和PE-CD8 标记,4 ℃避光孵育30 min,2 mL染色缓冲液洗2次,离心(1 500 r/min×5 min),用500 μL染色缓冲液悬起,于流失细胞仪检测。骨髓源性抑制细胞检测:首先加CD16/CD32,室温孵育15 min,后加PE-Gr-1和APC-CD11b标记,4 ℃避光孵育30 min,2 mL染色缓冲液洗2次,离心(1 500 r/min×5 min),用 500 μL染色缓冲液悬起,于流失细胞仪检测。调节性T细胞检测:分别用APC-CD4、PE-cy7-CD25、PE-Foxp3标记,4 ℃避光孵育30 min,2 mL染色缓冲液洗2次,离心(1 500 r/min×5 min),用500 μL染色缓冲液悬起,于流失细胞仪检测。
1.2.3 免疫组织化学 将瘤组织切成小块,置于常温下10%中性福尔马林浸泡24 h,梯度乙醇脱水,石蜡包埋,备用。采用Envision二步法进行CD34表达定位及半定量分析,严格按说明书操作。

2 结 果
2.1 各组肿瘤抑制效应 各组小鼠体质量、皮毛、食欲、行为等一般情况均未出现与治疗有关的改变。各组小鼠肿瘤体积治疗前与前15 d比较,差异无统计学意义(P>0.05)。治疗结束后,空白组、溶剂组、单用抗CTLA-4抗体组、单用阿霉素组、联合用药组肿瘤体积分别为(2 899.52±378.53)mm3、(2 785.55±425.18)mm3、(2 452.53±365.26)mm3、(2 235.13±375.26)mm3和(1 525.36±451.25)mm3。单用抗CTLA-4抗体组、单用阿霉素组、联合用药组小鼠肿瘤体积均显著低于空白组、溶剂组小鼠(P<0.05),且联合用药组小鼠肿瘤体积显著低于单用抗CTLA-4抗体组、单用阿霉素组小鼠肿瘤体积(P<0.05)。联合用药组小鼠肿瘤质量均显著低于空白组、溶剂组、单用抗CTLA-4抗体组和单用阿霉素组小鼠肿瘤质量(P<0.05)。小鼠肿瘤生长曲线及肿瘤质量见图1。
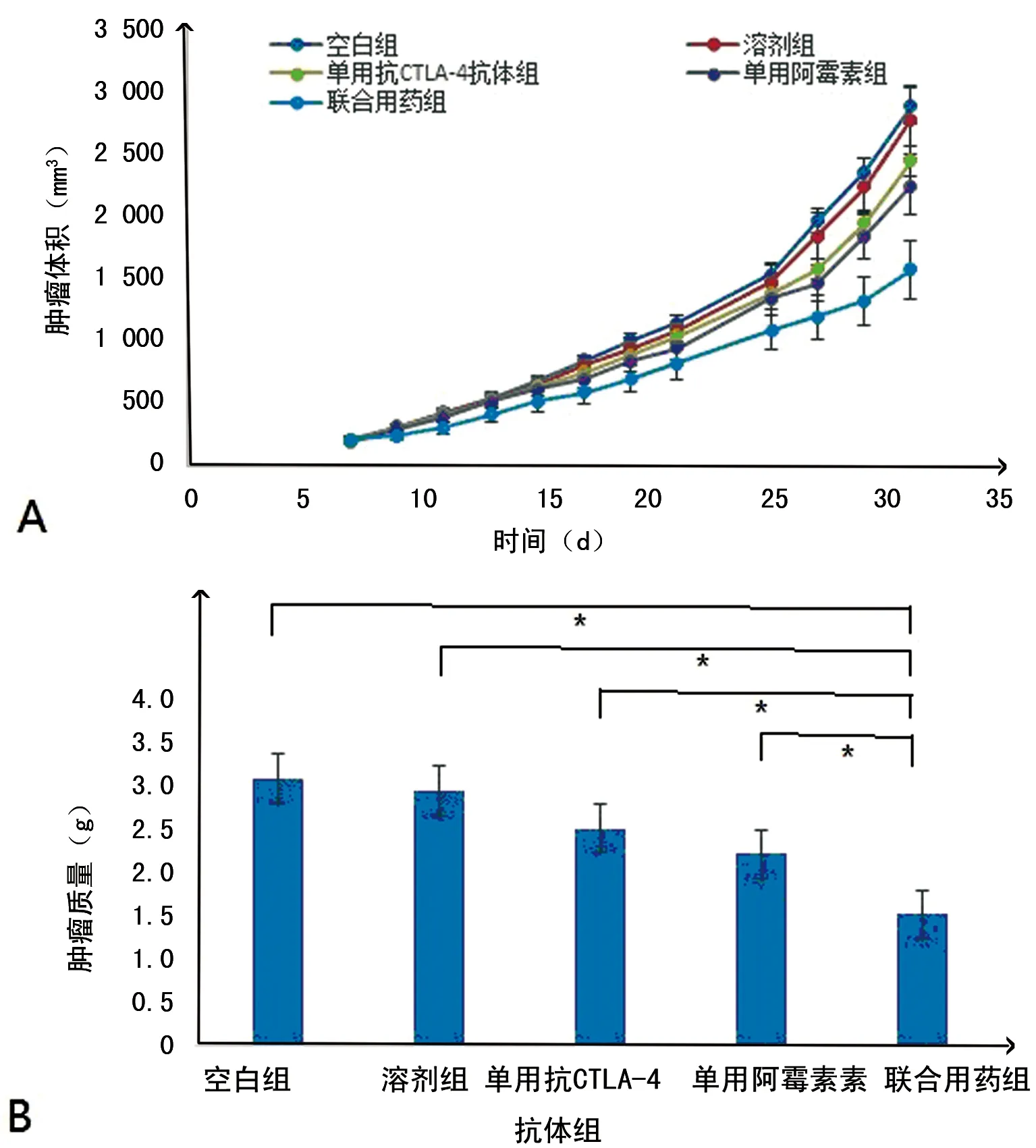
*:P<0.05,组间比较。
图1 各组小鼠肿瘤生长曲线(A)及肿瘤质量(B)
2.2 各组免疫细胞的检测 结果显示,与空白组、溶剂组相比,单用抗CTLA-4抗体组、单用阿霉素组和联合用药组的荷瘤小鼠脾中 CD8+T和CD4+T 细胞占淋巴细胞的百分比显著增高(P<0.05)。与单用抗CTLA-4抗体组和单用阿霉素组相比,联合用药组CD8+T和CD4+T 细胞占淋巴细胞的百分比相对增高,但差异无统计学意义(P>0.05)。与其他组相比,联合用药组脾抑制性细胞(MDSC)相对降低,但差异无统计学意义(P>0.05)。骨髓MDSC组间比较差异无统计学意义(P>0.05)。各组免疫细胞的检测结果见表1。

表1 各组免疫细胞的检测结果
*:P<0.05,与空白组、溶剂组比较。
2.3 各组肿瘤微环境中凋亡细胞的检测 结果显示,空白组、溶剂组、单用抗CTLA-4抗体组、单用阿霉素组、联合用药组肿瘤细胞凋亡的阳性百分率分别为(9.21±2.05)%,(24.75±2.87)%,(43.67±7.58)%,(47.13±2.10)%和(69.83±4.14)%。联合用药组肿瘤细胞凋亡的阳性百分率显著高于其他组,且单用抗CTLA-4抗体组和单用阿霉素组肿瘤细胞凋亡的阳性百分率显著高于空白组和溶剂组(P<0.05)。TUNEL染色检测肿瘤细胞凋亡结果见图2。

*:P<0.05,组间比较。
图2 各组肿瘤微环境中凋亡细胞的百分比
2.4 各组肿瘤微环境中微血管密度(MVD)检测 结果显示,空白组、溶剂组、单用抗CTLA-4抗体组、单用阿霉素组、联合用药组计数MVD分别为(53.90±5.22)%,(56.45±9.78)%,(24.63±4.49)%,(23.42±4.51)%和(16.12±4.38)%,联合用药组MVD显著低于其他组,且单用抗CTLA-4抗体组和单用阿霉素组MVD显著低于空白组和溶剂组(P<0.05)。各组肿瘤微环境中MVD检测结果见图3。
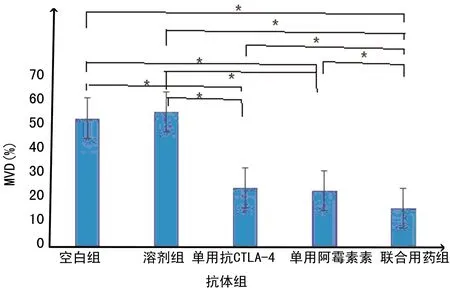
*:P<0.05,组间比较。
图3 各组肿瘤微环境中MVD检测结果
3 讨 论
乳腺癌是危害女性健康的恶性肿瘤之一,位居女性肿瘤发病率的首位,随着医疗技术的发展,乳腺癌的病死率有下降趋势,但传统的治疗方法仍不能得到令人满意的治疗效果[8]。研究表明免疫逃逸在乳腺癌发病机制中具有重要作用,如CD4+T 细胞、CD25+T 细胞和FOXP3+调节性T细胞[9-10]。近年来,针对这些靶点的肿瘤免疫治疗逐渐成为肿瘤治疗的重要方面。
本研究针对在乳腺癌患者体内,CTLA-4对免疫细胞的抑制作用,采用抗CTLA-4抗体联合阿霉素化疗治疗乳腺癌小鼠模型。结果显示,联合用药组小鼠肿瘤质量均显著低于空白组、溶剂组、单用抗CTLA-4抗体组和单用阿霉素组小鼠肿瘤质量(P<0.05)。提示联合应用抗CTLA-4抗体和阿霉素对乳腺癌小鼠的肿瘤抑制效果明显优于任何一种单一用药治疗方案。阿霉素被广泛用于治疗各种肿瘤,其主要功能是嵌入DNA碱基对之间,来抑制RNA和DNA的合成,导致细胞凋亡。由于阿霉素剂量限值毒性及肿瘤细胞对该药产生耐药性,联合应用其他治疗方法治疗成为研究的热点。刘晓东[11]探讨了新型光动力疗法联合阿霉素对小鼠乳腺癌体外、体内抑瘤效应及其相关机制,发现新型光动力疗法联合阿霉素可增强抑瘤效果。王平虎[12]报道称CD147调控了阿霉素介导的人乳腺癌细胞株MCF-7的凋亡。
CTLA-4表达于激活的T细胞表面,通过与B7.1和B7.2结合产生负性调节信号,抗CTLA-4抗体可阻滞该负性调节信号,从而增强T细胞介导的肿瘤杀伤作用[5]。本文采用流式细胞术检测各组免疫细胞情况,判断小鼠的免疫能力。结果显示,与空白组、溶剂组相比,单用抗CTLA-4抗体组、单用阿霉素组和联合用药组的小鼠脾中 CD8+T和CD4+T 细胞占淋巴细胞的百分比显著增高(P<0.05)。与单用抗CTLA-4抗体组和单用阿霉素组相比,联合用药组CD8+T和CD4+T 细胞占淋巴细胞的百分比相对增高,但差异无统计学意义(P>0.05)。表明联合用药组小鼠的免疫能力高于其他组。CD4+细胞为免疫应答中主要的反应细胞,具有辅助和诱导其前体细胞,影响辅助性T淋巴细胞和抑制性T 淋巴细胞的成熟,影响B细胞抗体产生的作用。CD8+细胞具有负调节效应,可对靶细胞产生细胞介导的细胞毒作用,同时可调节性抑制CD4+细胞。二者的比值是反应机体免疫状态的重要参数,其比值变化表明机体细胞免疫功能失调,抗肿瘤能力被弱。因此二者水平的提升预示小鼠机体免疫能力增强,其免疫肿瘤杀伤能力提高,可能是联合用药组小鼠肿瘤抑制效果最好的原因之一。MDSC 具有大量表达CTLA-4的功能,本研究中与其他组相比,联合用药组脾MDSC相对降低,但差异无统计学意义(P>0.05)。骨髓MDSC组间比较差异无统计学意义(P>0.05)。可能是与抗CTLA-4抗体不足以抵制MDSC的表达量有关,或者与抗原提呈能力的不足有关,有待于进一步深入研究。王建霞[1]认为抗CTLA-4抗体与JAK2抑制剂在提高荷瘤机体的免疫能力方面可能发挥了协同效应。本组研究为发现,抗CTLA-4抗体与阿霉素可协同提高小鼠机体免疫能力。
阿霉素可直接嵌入DNA碱基对之间,来抑制RNA和DNA的合成,达到细胞凋亡的作用,而抗CTLA-4抗体主要通过提高机体的抗体免疫能力起到肿瘤杀伤作用[13-15]。本研究发现,二者联用其促细胞凋亡作用增强,联合用药组肿瘤细胞凋亡的阳性百分率显著高于其他组(P<0.05)。肿瘤长到几个立方毫米时处于缺氧状态,可分泌缺氧诱导因子促进 MDSC 的形成和CD4+T 细胞向Treg分化,分泌趋化因子和内皮生长因子等诱导肿瘤血管生成,从而促进肿瘤细胞生长。联合用药组MVD显著低于其他组,且单用抗CTLA-4抗体组和单用阿霉素组肿瘤细胞凋亡的阳性百分率显著低于空白组和溶剂组(P<0.05),提示联合用药可显著降低肿瘤MVD,达到抑制肿瘤生长的目的,效果高于单一用药。
综上所述,联合抗CTLA-4抗体和阿霉素可在一定程度提高小鼠机体免疫力,明显抑制乳腺癌小鼠肿瘤生长,促进肿瘤微环境中肿瘤细胞凋亡,减少肿瘤微环境中微血管生成,效果优于单一用药。
[1]王建霞.联合抗 CTLA-4 抗体及 JAK2 抑制剂治疗小鼠乳腺癌的实验研究[D].长春:吉林大学,2014.
[2]吴介恒,杨安钢,温伟红.治疗性抗体用于肿瘤治疗的临床转化研究现状[J].中国肿瘤生物治疗杂志,2014,21(3):325-333.
[3]Pardoll DM.The blockade of immune checkpoints in cancer immunotherapy[J].Nat Rev Cancer,2012,12(4):252-264.
[4]Mocellin S,Nitti D.CTLA-4 blockade and the renaissance of cancer immunotherapy[J].Biochim Biophys Acta,2013,1836(2):187-196.
[5]许静,李晶,杨杨,等.抗 CTLA-4嵌合抗体的制备及生物学活性鉴定[J].现代免疫学,2012,32(5):359-364.
[6]Yuan JD,Ginsberg B,Page D et al.CTLA-4 blockade increases antigen-specific CD8+T cells in prevaccinated patients with melanoma:three cases [J].Cancer Immunol Immunother,2011,60(8):1137-1146.
[7]Curran M,Allison JP,Kim M,et al.Combination CTLA-4 blockade and 4-1BBActivation enhances tumor rejection by increasing T-Cell infiltration,proliferation,and cytokine production[J].PLoS One,2011,6(4):e19499.
[8]朱红梅,胡婷,杨媚,等.小鼠乳腺癌动物模型中调节性T细胞的动态检测及其实验意义[J].四川大学学报:医学版,2012,43(6):877-881.
[9]Watanabe MA,Oda JM,Amarante MK,et al.Regulatory T cells and breast cancer:implications for immunopathogenesis[J].Cancer Metastasis Rev,2010,29(4):569-579.
[10]钦传辉,黄平,莫军扬,等.Ki-67在乳腺癌新辅助化疗中的表达及与病理学相关性研究[J].重庆医学,2010,39(5):545-546.
[11]刘晓东.新型光动力疗法联合阿霉素治疗乳腺癌的基础实验研究[D].天津:天津医科大学,2012.
[12]王平虎.CD147调控阿霉素介导的乳腺癌细胞凋亡的研究[D].长沙:中南大学湘雅医院,2013.
[13]李刚,刘良忠,熊德明,等.三维适形放疗联合鸦胆子油乳介入治疗原发性肝癌临床研究[J].重庆医学,2012,41(3):238-243.
[14]张昭军,周洋,阿尔孜古丽·吐尔逊,等.左旋棉酚联合低浓度阿霉素诱导纤维肉瘤细晌凋亡及其机制[J].重庆医学,2013,42(20):2372-2375.
[15]Fan TY,Zhang L,Chen W.Feasibility of MRl-guided high intensity focused ultrasound treatment for adenomyosis[J].Eur J Radio1,2012,81(11):3624-3630.
Effect and mechanism of combined therapy using anti-CTLA-4 antibody and doxorubicin on mice bearing breast cancer*
ShenWenzhuang,DongHong,ZhangLin,LiuJinwen△
(ThyroidandBreastSurgery,TongjiHospitalAffiliatedtoTongjiMedicalCollegeofHuazhongUniversityofScienceandTechnology,Wuhan,Hubei430030,China)
Objective To investigate the effect and mechanism of combined therapy using anti-CTLA-4 antibody and doxorubicin on mice bearing breast cancer. Methods Balb/c mice inoculated with 4T-1 mouse breast cancer cell were used as tumor models, which were randomly divided into blank group, solvent control group, anti-CTLA-4 antibody only group, doxorubicin only group and combined therapy group. Tumor growth of mice was observed. The ratio of spleen and bone marrow cell subgroup were evaluated. Tumor microenvironment apoptosis and microvessel density (MVD) were evaluated. Results The tumor volume of anti-CTLA-4 antibody only group, doxorubicin only group and combined therapy group were lower than those in the rest groups(P<0.05).The tumor volume and mass of combined therapy group was significantly higher than those of anti-CTLA-4 antibody only group, doxorubicin only group (P<0.05). Compared with blank group, solvent control group, CD8+Tand CD4+T ratio in anti-CTLA-4 antibody only group, doxorubicin only group, combined therapy group increased with significant difference (P<0.05). The positive cell apoptosis rate of combined therapy group was significantly higher than those of other groups(P<0.05). The MVD of combined therapy group was significantly lower than those of other groups(P<0.05). The positive cell apoptosis rate and MVD of anti-CTLA-4 antibody only group, doxorubicin only group were better than those of blank group, solvent control group. Conclusion Combined therapy using anti-CTLA-4 antibody and doxorubicin could improve the immune, significantly inhibit the growth of tumor, promote cancer cell apoptosis and decrease MVD.
breast neoplasms;epirubicin;immunity;anti-CTLA-4 antibody
著·
10.3969/j.issn.1671-8348.2015.23.002
国家自然科学基金资助项目(81372204)。
沈文状(1979-),主治医师,博士,主要从事甲状腺及乳腺肿瘤综合治疗。
△通讯作者,E-mail:shenwenzhuang123@163.com。
R361.2
A
1671-8348(2015)23-3172-04
2015-02-18
2015-07-15)

