髓核去细胞基质复合骨髓间充质干细胞体外构建组织工程髓核的研究
谭 伟,吕 海,曹 纬,张 朋,杨刘柱,周初松
(南方医科大学珠江医院骨科中心,广州 510282)
髓核去细胞基质复合骨髓间充质干细胞体外构建组织工程髓核的研究
谭 伟,吕 海,曹 纬,张 朋,杨刘柱,周初松△
(南方医科大学珠江医院骨科中心,广州 510282)
目的 体外培养兔骨髓间充质干细胞(rBMSCs)-髓核去细胞基质支架(NPAMS)复合体(rBMSCs-NPAMS)构建组织工程髓核。方法制备若干NPAMS,接种BMSCs至NPAMS体外培养分为NPAMS组、实验组和正常对照组(正常髓核)。肉眼及显微镜观察复合体形态变化,并行扫描电镜(SEM)、苏木素-伊红(HE)染色、免疫组织化学、实时定量PCR(qRT-PCR)、支架的生物力学等检测。结果肉眼下rBMSCs-NPAMS形态接近正常髓核;SEM显示细胞在支架表面大量黏附、并向深部迁移,表面细胞密度比横截面细胞密度大;HE染色表明随时间延长,rBMSCs-NPAMS内细胞量递增,分布更广泛;免疫组织化学显示细胞外基质2型胶原(CollagenⅡ)分泌量随时间递增,且实验组CollagenⅡ表达量大于NPAMS组,小于正常对照组;qRT-PCR结果:NPAMS组未提取到mRNA,实验组CollagenⅡ、聚集蛋白聚糖(Aggrecan)mRNA相对表达量呈时间依赖性递增,但均小于正常对照组(P<0.01),支架与正常髓核在相同位移下的压缩载荷差异无统计学意义(P>0.05)。结论采用髓核体外NPAMS复合rBMSCs可成功构建组织工程髓核。
组织工程;支架;髓核;去细胞;骨髓间充质干细胞
临床上对早期椎间盘退变尚无有效治疗手段,组织工程作为修复退变组织的一种途径应运而生,或许能够通过构建组织工程髓核治愈早期椎间盘退变。组织工程是以细胞为核心的移植工程[1],包括种子细胞、支架材料、细胞因子。髓核组织工程是以构建髓核为目的。组织工程的基础是支架,髓核支架研究很多[2],然而天然髓核成分结构复杂,很难完全模拟其中的成分与微环境,人工材料生物相容性差,天然蛋白成分合成支架则通常力学性能弱。去细胞基质极接近于正常髓核,且已经在膀胱[3]、血管[4]、真皮[5]、心瓣膜[6]等取得较大成功并被批准用于临床。兔髓核取材方便,国内外研究兔椎间盘退变模型的方法成熟[7-8],故本研究采用兔作为实验对象。兔骨髓间充质干细胞(rBMSCs)是一类具有多向分化能力的成体干细胞[9],具有取材简便、来源较广、易于体外增殖、抗原性小、组织修复能力强等优点[10],国内外文献都有报道利用BMSCs向类髓核细胞成功分化[11-12],因此是一种理想的种子细胞。本研究将探讨髓核去细胞基质支架(NPAMS)接种rBMSCs构建髓核组织的可行性。
1 材料与方法
1.1 材料 扫描电镜(SEM),细胞培养箱,低氧培养箱,荧光显微镜,切片机,恒温震荡箱,离心机,核酸浓度测量仪,罗氏PCR仪,M5酶标仪均为南方医院临床医学实验中心设备。健康成年新西兰大白兔24只,雌雄不限,2.5~3.0 kg,同批次购自南方医科大学实验动物中心[批号:SCXK(粤)2011-0015]。实验方案均经过南方医院实验动物研究所伦理审查委员会批准。
1.2 方法
1.2.1 NPAMS制备 在Mercuri等[13]基础上优化,前期研究筛选出最佳转速及去污剂浓度(120 r/min,0.3%)[14-15]。将新西兰兔注射麻醉后,取出其腰2至腰5髓核,尽量保持髓核原状,浸泡在4 ℃无菌磷酸盐缓冲液(PBS)中,去除碎骨组织。选取60枚大小一致[重量(0.10±0.02)g,P>0.01]的完整髓核,随机选取12枚置于液氮冷冻保存;48枚脱细胞,置于含0.3%(V/V) TritonX-100和 0.5%(V/V)脱氧胆酸钠的Tris缓冲液(50 mmol/L,pH=7.5)震荡(120 r/min)24 h。期间每8 h换液1次,换液前PBS漂洗3次,20 分钟/次。然后样本置于100 mL核酸酶混液中(750 mU/mL DNAse I+750 mU/mL RNAse A,pH=7.4) 反应30 min,PBS漂洗3次,20 分钟/次,成功制备NPAMS。将NPAMS送至辐照中心25 kGy60Co照射消毒。
1.2.2 rBMSCs培养、传代、接种 将P2代rBMSCs (Cyagen公司)传代培养至P7代,收集P7代细胞用诱导培养基稀释至2×107个/mL。将NPAMS分成A、B两组,A组12个,B组36个,正常髓核为C组(n=12)。A、C组液氮冷冻保存,将B组样品分别置于48孔板,微量注射器分别吸取50 uL细胞悬液通过多点及中心注射均匀注射至样品中,置于37 ℃,5% CO2孵箱内孵育4 h,期间每隔1小时滴加20 μL条件培养基,4 h 后,每孔加入1 mL条件培养液。参考Chen等[16]的方法配制条件培养基,包含DMEM/F12,40 μg/mL脯氨酸,100 nmol/L地塞米松,0.1 mmol/L抗坏血酸,100 U/mL青链霉素,1% ITS+premix,20 ng/mL转化生长因子-β1(TGF-β1),4%胎牛血清(FBS)。
1.2.3 rBMSCs-NPAMS体外诱导培养 将rBMSCs-NPAMS移入5% O2、5% CO2、37 ℃低氧培养箱培养[16],模拟髓核生理低氧环境,每隔2天用条件培养基换液,分别在培养第7、14、21天分别收集12个B组样本并保存,并分别命名为B1、B2、B3组。
1.2.4 rBMSCs-NPAMS的性能评估
1.2.4.1 大体观 常温下,肉眼观察rBMSCs-NPAMS体外培养7、14、21 d后的大小、外形、色泽、透明度,并与NPAMS正常髓核进行对比。
1.2.4.2 组织学及免疫组织化学观察 各组均选取3个样本经4%多聚甲醛浸泡过夜,梯度乙醇脱水,二甲苯透明石蜡包埋,切片 (5 μm),脱蜡,苏木素染色,分化,伊红染色,脱水透明,树胶封片完成苏木素-伊红(HE)染色流程;同时切片经抗原修复,3%H2O2浸泡,滴加2型胶原(CollagenⅡ)一抗及二抗,二氨基联苯胺(DAB)染色后完成免疫组织化学流程,光镜下观察。
1.2.4.3 显微镜及电镜观察 光镜下观察rBMSCs-NPAMS的形态、大小、透亮度;rBMSCs-NPAMS培养24 h后,取NPAMS(n=3)及rBMSCs-NPAMS样本(n=3)经2.5%戊二醛固定12 h,梯度脱水,临界点真空干燥,喷金,扫描电子显微镜(SEM)观察。为方便观察复合体内部情况,用薄刀片将样本横切成两半。
1.2.5 实时定量PCR(qRT-PCR)检测 通常认为CollagenⅡ与聚集蛋白聚糖(Aggrecan)为特异性髓核细胞外基质蛋白,检测A、B1、B2、B3、C组(n=3)不同培养时间点CollagenⅡ跟Aggrecan的mRNA水平。样本经液氮冷冻碾磨后提取、逆转录,再经qRT-PCR检测。
1.2.6 NPAMS生物力学检测 将支架(n=5)及正常髓核(n=5)在PBS中浸泡8 h后取出,滤纸吸干后置于微型生物力学测试机的载物台上,进行压缩性能测试。加载速度为1 mm/min,测试过程中用PBS保持样本湿润,固定位移为样本压平为止,重复测试5次,比较两组相同压缩位移条件下的载荷均值。

2 结 果
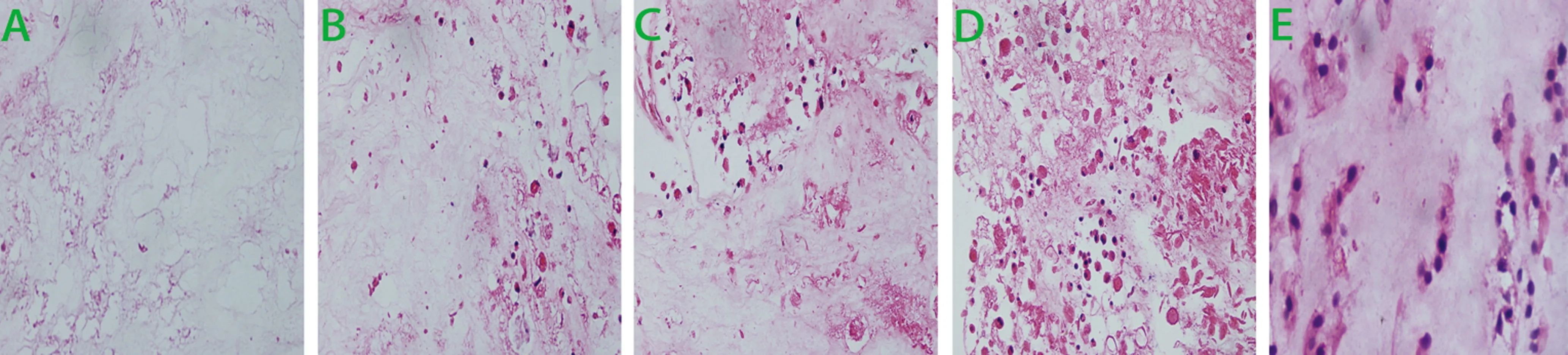
2.1 大体观 肉眼观,NPAMS较韧,半透明,表层及浅层较疏松,形态与正常髓核相仿。接种rBMSCs后体外诱导培养后的复合体质地柔软,黄白色,可能跟种子细胞分泌基质有关,随培养时间延长,体积增大,颜色渐深,形态保存良好,接近正常髓核;复合体表层跟浅层相对中心颜色深,可能与接种细胞大量集中在表层有关,见图1。
2.2 HE染色及免疫组织化学 HE染色观察,C组基质染色最深,细胞外基质结构清晰,细胞呈不规则簇状分布(图2);A组基质染色较淡,几乎未见蓝色胞核颗粒残留,原有细胞清除彻底,基质结构较正常髓核轻度紊乱,大体结构未见破坏;B1、B2、B3组细胞外基质染色渐深,但均较A组深,较C组浅,可见蓝色深染胞核;B1、B2、B3组胞核数量递增,均较A组多,较C组少,且细胞分布范围逐渐向中心扩散,细胞外基质结构轻度紊乱。CollagenⅡ免疫组织化学观察,C组呈褐色,A组染色较浅,B组黄褐色,A、B1、B2、B3、C组的颜色依次递增,染色均匀(图3)。
A:A1组;B:B1组;C:B2组;D:B3组;E:C组。
图1 样本的肉眼观
A:A1组;B:B1组;C:B2组;D:B3组;E:C组。
图2 HE染色观察(×100)
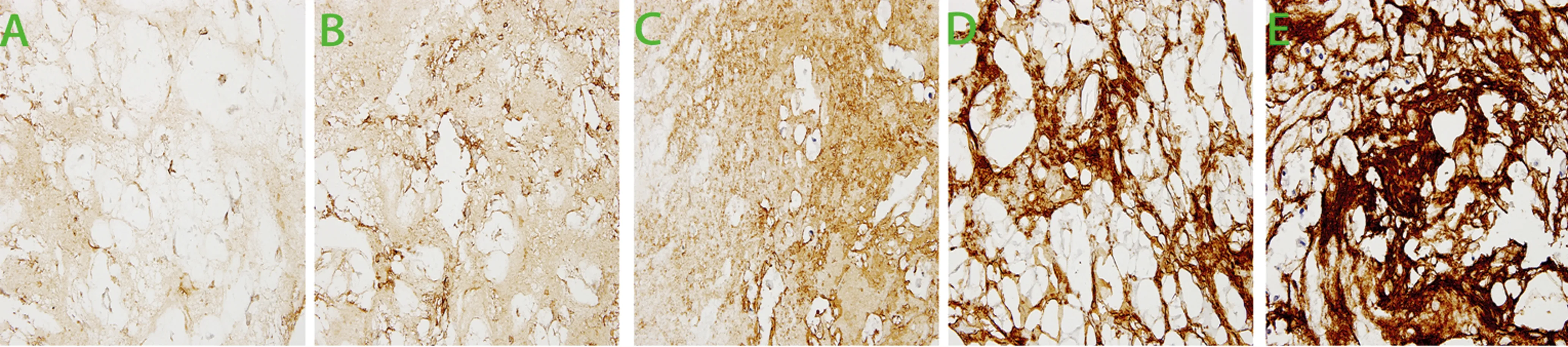
A:A1组;B:B1组;C:B2组;D:B3组;E:C组。
图3 免疫组织化学染色观察(×200)
2.3 显微镜及电镜观察 显微镜下rBMSCs-NPAMS培养21 d后大小、形态与正常髓核相似,结构致密,无透光性(图4)。NPAMS电镜下见胶原纤维分布规则,有一定的孔隙率及较小的孔径(图5),接种细胞48 h后在扫描镜下可见大量种子细胞黏附在支架表面及内部,多数呈不规则扁平状,少数成球形,同时支架表面细胞密度明显高于横截面,高倍镜下可见细胞外基质分泌(图6)。
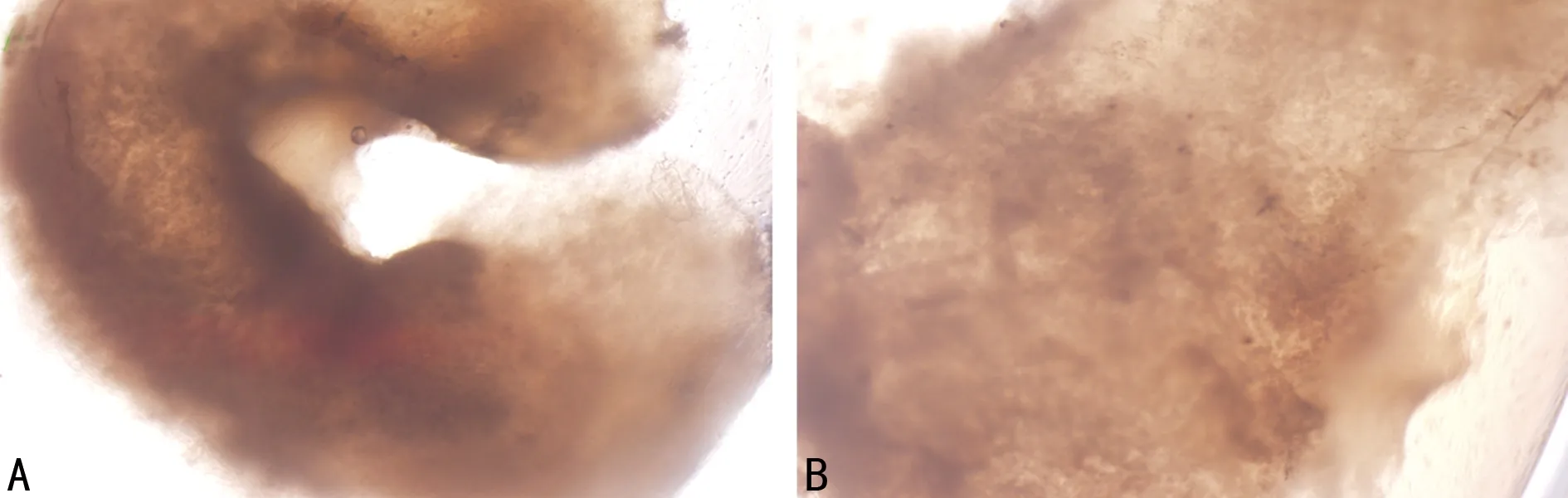
A:rBMSCs-NPAMS培养21 d后镜下观察(×4);B:rBMSCs-NPAMS培养21 d后镜下观察(×20)。
图4 倒置相差显微镜观察
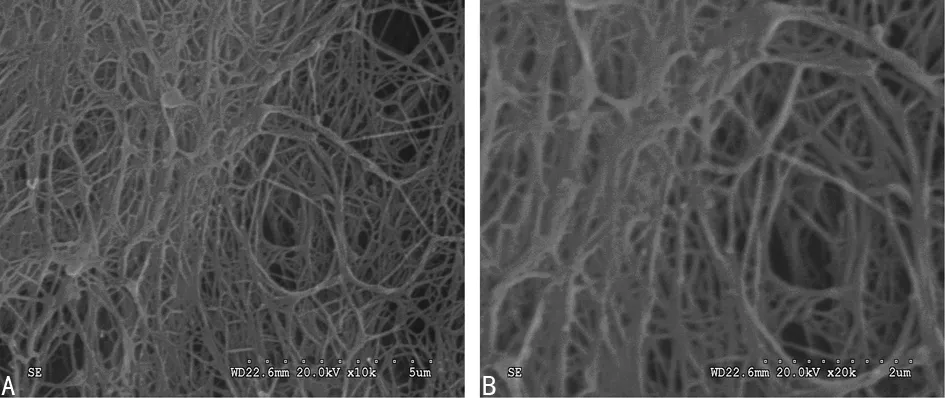
A:比例尺为5 μm;B:比例尺为2 μm。
图5 SEM观察支架表面
2.4 qRT-PCR检测 A组未提取到RNA,B1、B2、B3组的CollagenⅡmRNA表达量递增(P<0.01),同样Aggrecan mRNA表达量递增(P<0.01),但均较C组低。
2.5 NPAMS生物力学性能测定 对比湿润状态下支架及正常髓核的压缩载荷均值。在相同位移条件下,NPAMS压缩载荷为(0.574±0.029)MPa,正常髓核为(0.538±0.022)MPa,差异无统计学意义(P>0.05)。

A:复合体表面;B:复合体横截面(内部)。
图6 SEM观察复合体(×1 000)
3 讨 论
NPAMS极接近于正常髓核,本研究首次报道NPAMS复合接种rBMSCs成功构建类髓核组织,为今后进一步的动物体内实验及后续临床研究提供参考。创新点在首次将NPAMS与rBMSCs复合培养,通过体外添加细胞因子TGF-β1及模拟髓核生理低氧环境[16],成功诱导rBMSCs分化为类髓核细胞。
NPAMS基本保留了髓核组织的天然骨架,去除了原有髓核细胞及一些小分子抗原,极接近于天然髓核的细胞外基质成分、力学性能及细胞所需微环境,有利于种子细胞的增殖及分化。本研究对Mercuri等[13]的细胞萃取方法进行改进,证明120 r/min及0.3%去污剂浓度为最佳兔髓核脱细胞条件[14-15]。最佳条件下脱细胞彻底,且良好地保留了髓核基质的三维结构及大分子蛋白成分。正常髓核含有大量CollagenⅡ、Aggrecan,这些基质成分是维持椎间盘弹性的关键,故选用的种子细胞必须能大量增殖、表达相关基质蛋白。髓核细胞来源较少,分离困难,增殖缓慢,rBMSCs来源广泛,易提取,具有多向分化能力,能成功诱导分化为类髓核细胞[16]。SEM下可见支架表层及横截面均有细胞分布,表明该支架具有一定的孔径,利于种子细胞向深部迁移。髓核组织无血管,处于低氧环境,TGF-β1细胞因子等可有效诱导rBMSCs向类髓核细胞分化,将复合物置于5%O2低氧培养箱长期培养[17],尽可能模拟髓核生理环境,可能进一步促进rBMSCs向髓核细胞分化及分泌基质。rBMSCs-NPAMS体外培养21 d,肉眼及显微镜下可见组织结构致密,不透光,表明细胞外基质大量分泌使支架渐充实。HE染色表明随培养时间延长,种子细胞增殖且逐渐向内部迁移。CollagenⅡ免疫组织化学染色表明随时间延长,表达量增加,可接近于正常髓核,间接证明种子细胞向类髓核细胞分化并分泌髓核细胞基质蛋白。qRT-PCR检测结果表明经长时间诱导培养,种子细胞表达较特异的CollagenⅡ及Aggrecan mRNA,且随培养时间延长,mRNA表达量递增,证明种子细胞在支架上可长期存活,且渐分化为髓核细胞,在相当长一段时间内,细胞活力良好,髓核细胞主要基质蛋白基因表达逐步增加。本研究通过设置NPAMS与正常髓核分别作为阴性对照和阳性对照来更好地反映rBMSCs-NPAMS的变化。
NPAMS仍存在不足,需要后续进一步研究改进,理想的组织工程支架需要合适的孔隙率及一定大小孔径[18],SEM下表层细胞多且集中,横截面细胞少且不均匀,表明表面与浅层结构有理想的孔隙率及一定孔径,而中心较致密,不利于种子细胞进一步迁移至髓核中心及均匀分布,这提示在尽可能保留髓核基质三维结构跟主要基质蛋白成分的前提下,进一步优化NPAMS的制作步骤以扩大去细胞髓核孔径及提高孔隙率。尚无法判断NPAMS本身对种子细胞有无诱导分化作用,有待今后的进一步研究证实。本研究只对去细胞基质构建组织工程髓核进行了体外研究,下一步需进行动物研究及后续的临床研究。
综上所述,组织学及基因表达结果都表明rBMSCs接种入NPAMS后可以增殖、分化并分泌基质,体外成功构建类髓核组织。髓核去细胞髓核基质在三维结构、理化特性、生物相容性都接近正常髓核,是组织工程髓核的理想支架。
[1]孙建华,郑启新.椎间盘组织工程种子细胞及细胞支架研究进展[J].国际骨科学杂志,2010,31(1):32-34.
[2]Silva-Correia J,Correia SI,Oliveira JM.Tissue engineering strategies applied in the regeneration of the human intervertebral disk[J].Biotechnol Adv,2013,31(8):1514-1531.
[3]Evren S,Loai Y,Antoon R,et al.Urinary bladder tissue engineering using natural scaffolds in a porcine model:role of Toll-like receptors and impact of biomimetic molecules[J].Cells Tissues Organs,2010,192(4):250-261.
[4]Mangold S,Schrammel S,Huber GA,et al.Evaluation of decellularized human umbilical vein (HUV) for vascular tissue engineering-comparison with endothelium-denuded HUV[J].J Tissue Eng Regen Med,2015,9(1):13-23.
[5]Matsushima R,Nam K,Shimatsu Y,et al.Decellularized dermis-polymer complex provides a platform for soft-to-hard tissue interfaces[J].Mater Sci Eng C Mater Biol Appl,2014,35:354-362.
[6]Moroni F,Mirabella T.Decellularized matrices for cardiovascular tissue engineering[J].Am J Stem Cells,2014,3(1):1-20.
[7]Huang GF,Zou J,Shi J,et al.The effect of electroacupuncture on the extracellular matrix synthesis and degradation in a rabbit model of disc degeneration[J].Evid Based Complement Alternat Med,2014,20(14):395-731.
[8]Liu HF,Zhang H,Qiao GX,et al.A novel rabbit disc degeneration model induced by fibronectin fragment[J].Joint Bone Spine,2013,80(3):301-306.
[9]Ma JL,Both SK,Yang F,et al.Concise review:cell-Based strategies in bone tissue engineering and regenerative medicine[J].Stem Cells Transl Med,2014,3(1):98-107.
[10]Graessel S,Lorenz J.Tissue-Engineering strategies to repair chondral and osteochondral tissue in osteoarthritis:use of mesenchymal stem cells[J].Curr Rheumatol Rep,2014,16(10):452.[11]Takitoh T,Bessho M,Hirose M,et al.Gamma-cross-linked nonfibrillar collagen gel as a scaffold for osteogenic differentiation of mesenchymal stem cells[J].J Biosci Bioeng,2015,119(2):217-225.
[12]Bertolo A,Mehr M,Aebli N,et al.Influence of different commercial scaffolds on the in vitro differentiation of human mesenchymal stem cells to nucleus pulposus-like cells[J].Eur Spine J,2012,21 Suppl 6:826-838.
[13]Mercuri JJ,Gill SS,Simionescu DT.Novel tissue-derived biomimetic scaffold for regenerating the human nucleus pulposus[J].J Biomed Mater Res A,2011,96(2):422-435.
[14]张朋,曹纬,周初松,等.制备去细胞髓核支架最佳条件的初步优化研究[J].脊柱外科杂志,2013,11(3):168-172.
[15]曹纬,吕海,周初松.脱细胞兔髓核支架的形态学及体外细胞毒性研究[J].实用医学杂志,2014,30(7):1041-1044.
[16]Chen S,Emery SE,Pei M.Coculture of synovium-derived stem cells and nucleus pulposus cells in serum-free defined medium with supplementation of transforming growth factor-beta1:a potential application of tissue-specific stem cells in disc regeneration[J].Spine (Phila Pa 1976),2009,34(12):1272-1280.
[17]Yuan M,Yeung CW,Li YY,et al.Effects of nucleus pulposus cell-derived acellular matrix on the differentiation of mesenchymal stem cells[J].Biomaterials,2013,34(16):3948-3961.
[18]Matsiko A,Gleeson JP,O′Brien FJ.Scaffold mean pore size influences mesenchymal stem cell chondrogenic differentiation and matrix deposition[J].Tissue Eng Part A,2015,12(3/4):486-497.
In vitro fabrication of a tissue engineering nucleus pulposus with nucleus pulposus acellular matrix scaffold and bone marrow mesenchymal stem cells*
TanWei,LvHai,CaoWei,ZhangPeng,YangLiuzhu,ZhouChusong△
(DepartmentofOrthopaedics,ZhujiangHospitalofSouthernMedicalUniversity,Guangzhou,Guangdong510282,China)
Objective To construct tissue engineering nucleus pulposus by culture of rabbit bone marrow mesenchymal stem cells (rBMSCs)-nucleus pulposus acellular matrix scaffold (NPAMS) complexes (rBMSCs-NPAMS).Methods Several NPAMS were prepared,and rBMSCs was seeded into NPAMS.The scaffolds and complex were detected by general observation,HE staining,immunohistochemical,qRT-PCR,scanning electron microscopy.Results The scanning electron microscopy showed the seed cell in nucleus pulposus ECM-derived scaffold could adhesion and growth.The cell attachment and proliferation were observed by HE staining.Immunohistochemical examination with typeⅡ collagen showed positive results.qRT-PCR revealed the time-dependent of the mRNA expression of collagen Ⅱ,and which was smaller than positive control(P<0.01).The relative expression of Aggrecan mRNA grew in a time dependent fashion,which was still lower than positive control(P<0.01).Scaffolds and normal nucleus pulposus had no statistical significance of the compression load under the same displacement of the compression(P>0.05).Conclusion Natural nucleus pulposus acellular matrix scaffold composite allogeneic bone marrow mesenchymal stem cells can be successfully built into tissue engineering nucleus pulposus.
tissue engineering;scaffold;nucleus pulposus;acellular matrix;bone marrow mesenchymal stem cells
·基础研究
10.3969/j.issn.1671-8348.2015.23.003
国家自然科学基金面上项目(81372869)。
谭伟(1987-),住院医师,硕士,主要从事椎间盘组织工程研究。
△通讯作者,E-mail:zhoucs2014@163.com。
R318.08
A
1671-8348(2015)23-3176-04
2015-02-08
2015-07-15)

