大分子拥挤条件下光诱导辣根过氧化物酶还原的光谱研究
曹洪玉,王 珍,唐 乾,郑学仿
(1.大连大学 生命科学与技术学院,辽宁 大连116622;2.大连大学 辽宁省生物有机化学重点实验室,辽宁 大连116622;3.大连大学 环境与化学工程学院,辽宁 大连116622)
蛋白质、核酸、多糖等大分子物质在细胞内的浓度很高,使得细胞内的环境是高度拥挤的,大分子在细胞内的浓度可高达80~400g/L[1],能占细胞总容积的20%~30%[2],由于排斥容积效应,任何可增加可用容积的反应都能被大分子拥挤试剂刺激发生[3-6]。在生物体内,大多数的生化反应都是在这种高度拥挤的环境中完成的,当蛋白存在于大分子拥挤环境中时,其微环境会发生改变,使得蛋白的结构及稳定性发生变化[2,7],从而使得蛋白的功能表达在拥挤试剂和稀溶液中不同。
生命体的重要组成部分——血红素类蛋白,在生命体中承担着极其重要的功能,例如作为生物催化剂、电子传递蛋白、氧载体和生物传感器等[8]。由于血红素类蛋白含有原卟啉Ⅸ辅基,故其能够吸收特定波长的光,光照通过影响血红素功能的表达而影响蛋白功能。关于光照射血红素类蛋白的研究已有报道,如血红蛋白、肌红蛋白、细胞色素P450、细胞色素C、细胞色素C氧化酶和辣根过氧化物酶等[9-14],但是这些研究是在稀溶液中进行的,忽略了生物体细胞内的拥挤环境。目前关于血红素类蛋白在高度拥挤环境下光照的研究还很少。
辣根过氧化物酶(Horseradish Peroxidase,HRP)是以铁卟啉为辅基的血红蛋白,辣根过氧化物酶能利用过氧化氢氧化一些有机和无机化合物,它与植物的呼吸作用、光合作用及生长素的氧化等都紧密相关,而且对氧自由基具有消除作用,减少过氧化物对植物体的毒害作用。辣根过氧化物酶在生物传感器[15]、环境监测、工业应用[16]等方面也发挥了很大的作用,广泛地运用于基因学、生理学及病理学研究中[17,18]。
我们最近研究了紫外-可见光诱导细胞色素C、高铁肌红蛋白[19,20]和 HRP的还原及其机制,发现它们的光还原反应机制都是光诱导分子内电子转移。为了进一步了解光诱导血红素蛋白在细胞内环境中的还原过程,本文通过在光照体系中加入大分子拥挤试剂来模拟细胞内环境,研究了该条件下光诱导HRP的还原,利用紫外-可见吸收光谱、同步荧光光谱及圆二色谱等方法对拥挤环境中光照射HRP后其血红素中铁原子价态、蛋白构象及二级结构的变化进行了研究,确定了拥挤环境中HRP的最适光还原条件,分析了光照波长、温度、拥挤试剂浓度等对HRP光还原的影响。
1 实验部分
1.1 试剂与仪器
辣根过氧化物酶(Horseradish Peroxidase,HRP)样品购自美国Sigma公司,使用时未经进一步提纯,溶解在0.05mol/L的 Na2HPO4-NaH2PO4缓冲溶液(pH=7.4)中,配置成浓度为5×10-4mol/L的蛋白溶液,蛋白溶液冷冻避光保存并尽快应用于实验。
Dextran70和Ficoll70购自上海生工公司,分别将大分子拥挤试剂Dextran70和Ficoll70溶解到pH 7.4的PB缓冲溶液中,使其终浓度达到50g/L、100 g/L、200g/L和400g/L,实验用水为去离子水。
实验仪器主要有 UV-Vis分光光度计(V-560,日本Jasco公司),荧光光谱仪(FP-6500,日本Jasco公司)和圆二色光谱仪(J-810,日本Jasco公司),制冷和加热循环器(F-12,德国Julabo公司),实验室pH计(PHSJ-4A,上海雷磁分析仪器厂),实验所用光源为荧光光谱仪的氙灯。
1.2 实验过程
1.2.1 样品处理
取20μL浓度为5×10-4mol/L的 HRP蛋白分别加入到1.98mL PB缓冲液和已配好的Dextran70、Ficoll70溶液中,得到浓度为5×10-6mol/L的HRP蛋白溶液,将蛋白样品置于10mm石英比色池中,密封并持续通入N2,用荧光光谱仪中的氙灯进行光照,然后进行光谱测定。
1.2.2 光谱测定
UV-Vis光谱测定:狭缝宽度2nm,扫描波长范围220~700nm,扫描速度200nm/min,响应时间为中等,累计扫描3次。
荧光光谱测定:将拥挤试剂Dextran70和Ficoll70放入10mm石英比色池中进行荧光光谱测定,测定条件为:激发波长280nm,激发和发射狭缝宽度均为5nm,扫描速度为500nm/min,响应时间为0.5s,检测器灵敏度为中等,累计扫描3次。
同步荧光光谱测定:以Δλ=20nm和Δλ=60 nm测定处理后样品的同步荧光光谱。激发和发射狭缝均为5nm,扫描速度为500nm/min,响应时间为0.5s,检测器灵敏度为中等,累计扫描3次。
圆二色光谱测定:狭缝宽度1nm,扫描波长范围190~250nm,扫描速度50nm/min,响应时间1s,累计扫描3次。
2 结果与讨论
2.1 稀溶液/拥挤环境中HRP的紫外-可见与同步荧光光谱
在稀溶液中,辣根过氧化物酶在403nm处的吸光度为0.43,在拥挤试剂Dextran70与Ficoll70中,HRP在403nm处的吸光度分别为0.48和0.49,与稀溶液中的HRP蛋白在403nm处的紫外吸收强度相比,拥挤试剂中的HRP蛋白在403 nm处的紫外吸收强度要强。这是由于拥挤试剂对血红素周围的环境有一定的影响,血红素在拥挤试剂中暴露较多,使得吸光度较强。HRP的紫外-可见吸收光谱见图1。
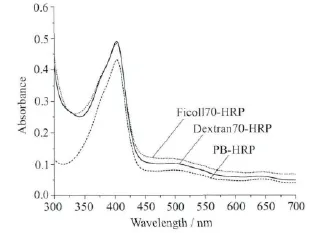
图1 HRP的紫外-可见吸收光谱
色氨酸残基和酪氨酸残基是蛋白质荧光的主要贡献因素[21]。利用同步荧光光谱可得到酪氨酸和色氨酸残基的特征峰。当选择Δλ=20nm时显示的是酪氨酸残基的荧光峰,当选择Δλ=60nm时表现的则是色氨酸残基的荧光峰,并且色氨酸残基的荧光强度和位置对其周围的环境是敏感的[22]。色氨酸残基的最大发射波长红移,表明其所处环境极性增加,疏水性降低,蛋白疏水结构瓦解,肽链伸展程度有所增加;蓝移则表明疏水性增加,分子趋于折叠状态[23]。我们可以根据这些现象来判断蛋白质的构象变化[21]。
在稀溶液中,Δλ=20nm时(图2A),HRP的酪氨酸残基的荧光峰在305nm处,Δλ=60nm(图2B)时,HRP的色氨酸残基的荧光峰在344nm处。由于拥挤试剂自身能够吸收一定波长的光而发射出荧光(图3),所以在稀溶液中加入拥挤试剂时,使得HRP蛋白溶液的荧光强度急剧增强,酪氨酸和色氨酸残基的荧光峰被掩盖。与相同浓度的Dextran70相比,Ficoll70的荧光强度更强(图3C)。
2.2 不同溶液中HRP的光还原
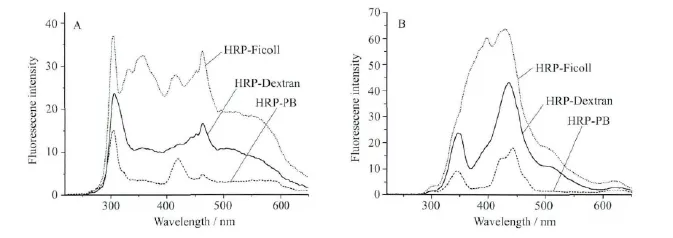
图2 不同溶液中HRP的同步荧光光谱
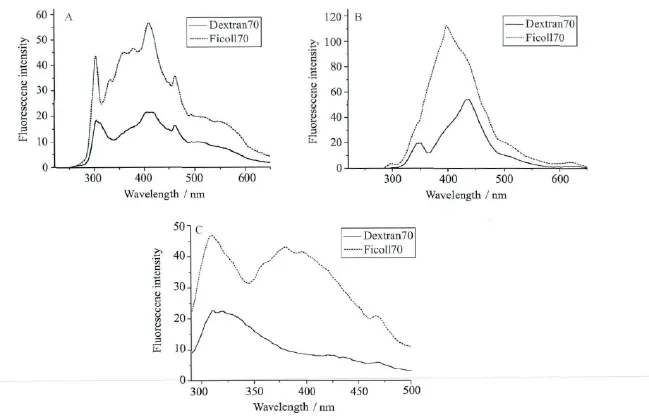
图3 大分子拥挤试剂Dextran70和Ficoll70的同步荧光光谱(A)Δλ=20nm;(B)Δλ=60nm;(C)荧光光谱
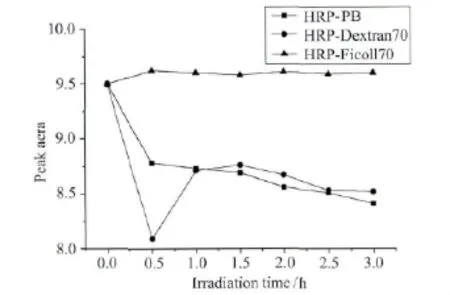
图4 24℃,403nm光照射不同溶液中HRP其Soret带吸收峰面积的变化
辣根过氧化物酶在稀溶液与大分子拥挤试剂中采用403nm单色光照射前后Soret带吸收峰面积变化情况如图4。从图可以看出,403nm光照射 时,HRP在PB溶液及Dextran 7 0溶液中可以发生光还原反应,而在Ficoll70溶液中没有发生光还原反应。在PB溶液中HRP蛋白随着光照时间的增长被光还原的量增多,而在Dextran70溶液中,光照0.5h之内HRP蛋白被还原的量较多,随着光照时间的增长HRP蛋白被还原的量有所减少。辣根过氧化物酶在稀溶液与大分子拥挤试剂中,分别采用280nm单色光照射前后其Soret带吸收峰面积变化情况如图5。从图中可以看出,HRP蛋白在拥挤试剂Dextran70和Ficoll70溶液中有利于光还原反应的发生,并且相同光照时间内,在Ficoll70溶液中HRP蛋白被光还原的量更多。HRP的光还原机理为光诱导的蛋白分子内电子转移,在拥挤条件下HRP蛋白光还原反应易于发生的主要原因是:拥挤试剂Dextran70和Ficoll70自身均能发射荧光,在Dextran70和Ficoll70溶液中HRP蛋白的光还原程度不同,也体现了这两种拥挤试剂光吸收和荧光发射的差异。这种差异是由拥挤试剂结构的不同造成的,Dextran70的持续长度约为0.4nm,是一种无交联线性的、相对灵活的大分子聚合物,而Ficoll70具有高度交联的结构,是一种刚性共聚体。因此,当Dextran70与Ficoll70浓度相同时,Dextran70可以在溶液中形成准随机螺旋,从而容纳更多的间隙空间,排阻体积效应变小,吸收光能力变弱,使得其荧光发射强度较小,不利于HRP蛋白分子内电荷转移现象的发生。
2.3 光照波长对HRP光还原的影响
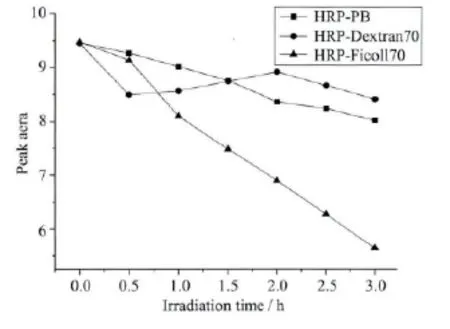
图5 24℃,280nm光照射不同溶液中HRP其Soret带吸收峰面积的变化
不同波长的光能量是不同的,对HRP的光还原情况不同,因此我们考察了拥挤条件下不同定波长光照射HRP溶液的光还原情况,图6A为在拥挤试剂Dextran70溶液中,分别用272、280、403和498nm波长的光照射HRP蛋白样品后,其Soret带吸收峰面积随光照时间的变化。发现272和498nm两种波长的光不能使HRP蛋白发生光还原反应。而280和403nm两种波长的光照射HRP蛋白溶液可以使其发生光还原反应。图6B为在拥挤试剂Ficoll70溶液中,分别用280、403和498nm波长的光照射HRP蛋白样品后,其Soret带吸收峰面积随光照时间的变化。发现只有280 nm波长的光照射蛋白溶液时能使HRP发生光还原反应。造成这种现象的原因是拥挤试剂Ficoll70在280nm处有紫外吸收,采用280nm波长的光照射HRP蛋白溶液,可以激发拥挤试剂Ficoll70发射荧光,从而诱导HRP发生还原。
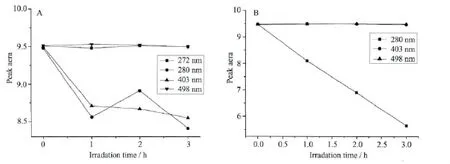
图6 拥挤条件下不同定波长光照射HRP溶液后其Soret带吸收峰面积的变化
2.4 温度对HRP光还原的影响
温度的改变可引起HRP蛋白构象发生变化,而HRP蛋白构象的变化会影响其酶活性。为此我们考察了不同温度(4℃、24℃、44℃)对大分子拥挤环境中HRP光还原的影响。
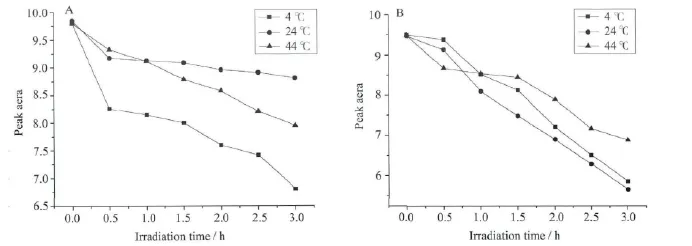
图7 不同温度下光照HRP其Soret带吸收峰面积随时间的变化
在拥挤试剂Dextran70中(图7A),HRP蛋白溶液在4℃、24℃、44℃三种温度下采用403nm单色光照射0.5h后,其Soret带吸收峰面积减小都比较明显。在温度为24℃时,随着光照时间的增长,Soret带峰吸收峰面积趋于平缓,在温度为4℃和44℃时,随着光照时间的增长,Soret带吸收峰面积越来越小,且4℃时Soret带峰面积减少更明显,说明在Dextran70大分子拥挤环境中,403nm单色光照、4℃时最有利于HRP光还原反应的发生。在拥挤试剂Ficoll70中(图7B),HRP蛋白溶液在4℃、24℃、44℃三种温度下采用280nm单色光照射,随着光照时间的增加,其Soret带吸收峰面积逐渐减少,在24℃,Soret带吸收峰面积减少程度最明显,说明在拥挤试剂Ficoll70中,280nm单色光照、24℃时,最有利于HRP光还原反应的进行。
2.5 拥挤试剂浓度对HRP光还原的影响
图8为不同浓度大分子拥挤试剂中HRP光还原的情况。大分子拥挤试剂Dextran70浓度为100g/L时,光照后HRP蛋白在Soret带吸收峰面积减少的最多,浓度为400g/L时Soret带吸收峰面积反而增加。说明Dextran70浓度为100g/L时光照还原HRP的能力最强。可能是Dextran70在较高浓度时使得HRP蛋白的血红素暴露增多,Soret带的吸收峰面积增大,且当Dextran70浓度达到200g/L时会发生浓度荧光猝灭,其荧光发射强度降低,引起HRP光还原程度降低。在大分子拥挤试剂Ficoll70中,光照后HRP蛋白在Soret带吸收峰面积随着Ficoll70浓度的增大而逐渐减小,Ficoll70浓度为400g/L时吸收峰面积减少的最多,即浓度为400g/L时HRP的光还原能力最强。Ficoll70浓度增加其荧光发射强度则会逐渐增强,从而使HRP的光还原程度增大。
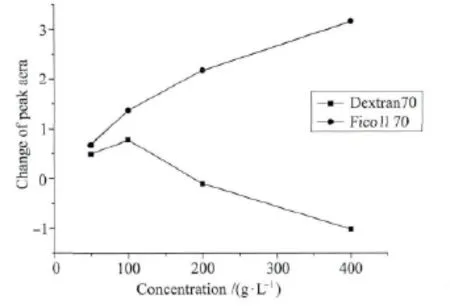
图8 光照后不同浓度大分子拥挤试剂中HRP Soret带吸收峰面积的变化
2.6 拥挤环境中光照射HRP二级结构的变化
某些反应引起的蛋白分子二级结构变化可以通过CD光谱进行检测,因此,我们选用远紫外区CD光谱对拥挤环境中光诱导HRP还原所引起的蛋白二级结构的变化进行检测,进一步了解拥挤环境中光诱导HRP蛋白的还原过程。不同光照时间HRP的远紫外CD光谱如图9。由图可知,稀溶液和拥挤试剂中的辣根过氧化物酶在208nm和222nm均表现出两个负峰,反映的是α-螺旋结构蛋白的特征谱带,随着光照时间的增加(0.5h、1h、2h、3h)HRP在稀溶液与拥挤试剂中208nm和222nm的两个负峰未发生变化,说明光照时间内蛋白未变性,光照后蛋白的二级结构未发生改变。
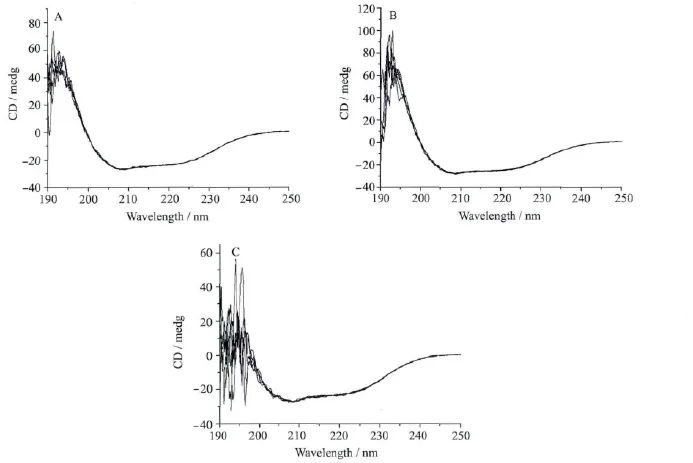
图9 不同溶液中HRP光照后的CD光谱CD spectra of HRP under different solutions
3 结论
本文通过光谱法,对光诱导大分子拥挤环境中辣根过氧化物酶的还原过程进行了研究,结果表明大分子拥挤试剂对光还原HRP的电子传递过程及效率有影响。当采用403nm单色光照射HRP蛋白溶液时,HRP在拥挤试剂葡聚糖70(Dextran70)中还原程度较好,而在聚蔗糖70(Ficoll70)拥挤环境下HRP不发生光还原反应;采用280nm单色光照射时,在大分子拥挤试剂葡聚糖70(Dextran70)和聚蔗糖70(Ficoll70)环境中,HRP光还原反应得到促进,且大分子Ficoll70溶液对HRP光还原反应的促进作用更加明显;光诱导HRP还原的最适温度在Dextran70和Ficoll70溶液中分别为4℃和24℃,定波长280nm光照射利于HRP还原;HRP在Dextran70溶液中的最适光还原浓度是100g/L,在Ficoll70环境中HRP还原程度随着Ficoll70浓度的增加增大;通过CD光谱可知光照射拥挤环境中HRP被还原后,其二级结构基本没有变化。
[1] Ellis R.Macromolecular crowding:obvious but underappreciated[J].Trends in Biochemical Science,2001,26:597-604.
[2] Perham M,Stagg L,Wittung-Stafshede P.Macromolecular crowding increases structural content of folded proteins[J].Febs Letters,2007,581(26):5065-5069.
[3] Zimmerman S B,Minton A P.Macromolecular crowding:biochemical,biophysical,and physiological consequences[J].Annual Review of Biophysics and Biomological Structures,1993,22:27-65.
[4] Minton A P. Models for excluded volume interaction between an unfolded protein and rigid macromolecular cosolutes:macromolecular crowding and protein stability revisited[J].Biophysical Journal,2005,88(2):971-985.
[5] Minton A P.Influence of macromolecular crowding upon the stability and state of association of proteins:predictions and observations [J].Journal of Pharmaceutical Science,2005,94(8):1668-1675.
[6] Zhou H X.Protein folding and binding in confined spaces and in crowded solutions[J].Journal of Molecular Recognition,2004,17(5):368-375.
[7] Zhu J,He H W,Li S.Macromolecular crowding enhances thermal stability of rabbit muscle creatine kinase[J].Tsinghua Science and Technology,2008,13(4):454-459.
[8] 林英武,黄仲贤.血红蛋白结构及功能相互转换[J].世界科技研究与发展,2006,28:8.Lin Y W,Huang Z X.Structural and functional conversion between hemoproteins[J].World Science-Technology R &D,2006,28:8.
[9] Pierre J,Bazin M,Debey P,Santus R.One-electron photoreduction of bacterial cytochrome P-450by ultraviolet light.I.steady-state irradiations [J].European Journal of Biochemistry,1982,124(3):533-537.
[10] Sakai H,Onuma H,Umeyama M,TAkeoka S,Tsuchida E.Photoreduction of methemoglobin by irradiation in the near-ultraviolet region[J].Biochemistry,2000,39(47):14595-14602.
[11] Liang X Q,Chen G F,Zhang X,Liu S,Li G X.Study of UVA irradiation on hemoglobin in the presence of NADH[J].Journal of Photochemistry and Photobiology B,2008,90(1):53-56.
[12]Vorkink W P,Cusanovich M A.Photoreduction of horse heart cytochrome c [J].Photochemistry and Photobiology,1974,19(3):205-215.
[13] Masuda T,Minemura A,Yamauchi K,Kondo M.A mechanism of direct photoreduction of ferricytochrome c[J].Journal of Radiation Research,1980,21(2):149-156.
[14] Winterle J S,Einarsdóttiró.Photoreactions of cytochrome c oxidase[J].Photochemistry and Photobiology,2006,82(3):711-719.
[15] 李 军,王柯敏,肖 丹,羊小海.改进溶胶-凝胶法固定酶结构剖析及在苯酚光化学传感器中的应用 [J].高等学校化学学报,2000,21(7):1018-1022.Li J,Wang K,Xiao D,Yang X H.The microstructure analysis of enzymes immobilized by sol-gel method and its application in phenol optical chemical sensor[J].Chemical Journal of Chinese University,2000,21(7):1018-1022.
[16] 周海峰,杨东杰,邱学青,伍晓蕾.辣根过氧化物酶改性木质素磺酸钠的结构特征及吸附分散性能 [J].高等学校化学学报,2014,35(4):895-902.Zhou H F,Yang D J,Qiu X Q,Wu X L.Structural characterization,adsorption and dispersion properties of sodium lignosulfonate by horseradish peroxidase incubation[J].Chemical Journal of Chinese University,2014,35(4):895-902.
[17] Taraban M B,Anderson M A.Magnetic field dependence of electron transfer and the role of electron spin in heme enzymes:horseradish peroxidase[J].Journal of the American Chemical Society,1997,1199(24):5768-5769.
[18] Baek H K,Van Wart H E.Elementary steps in the formation of horseradish peroxidase compound I:direct observation of compound 0,a new intermediate with a hyperporphyrin spectrum[J].Biochemistry,1989,28(14):5714-5719.
[19] 顾晓天,吴晓红,周家宏,魏少华,刘 颖,冯玉英.竹红菌甲素与细胞色素C相互作用的同步荧光光谱研究[J].南京师范大学学报,2005,28:70.Gu X T,Wu X H,Zhou J H,Wei S S H,Liu Y,Feng Y Y.Study on the interaction between hypocrellin a and cytochrome c using synchronous fluoresecence of spectra[J].Journal of Nanjing Normal University,2005,28:70.
[20] 杨昌英,李 敏,付 静,李 昕.脂质体对细胞色素C结构的稳定作用 [J].分析科学学报,2010,26:153.Yang C Y,Li M,Fu J,Li X.Structral stability of cyto chrome c in egg phosphatidylcholine liposomes[J].Journal of Analytical Science,2010,26:153.
[21] Joseph R L.Principles of Fluorescence Spectroscopy[M].New York:Plenum Press,1983.533.
[22] Munk M B,Huvaere K,Bocxlaer J V,Skibsted L H.Mechanism of light-induced oxidation of nitrosylmyoglobin[J].Food Chemistry,2010,121(2):472.
[23] 马 静,郑学仿,唐乾,杨彦杰,孙 霞,高大彬.光谱法研究Cu2+与肌红蛋白的相互作用[J].高等学校化学学报,2008,29(2):258-263.Ma J,Zheng X F,Tang Q,Yag Y J,Sun X,Gao D B.Spectroscopic studies on the interaction of Cu2+with myoglobin[J].Chemical Journal of Chinese University,2008,29(2):258-263.

