一种以环戊并双噻吩作为π电子桥的新型发色团的合成和电光性质的表征
杨 丹,徐化君,丛晟宇,薄淑晖,邱 玲,甄 珍,刘新厚*
(1.中国科学院 理化技术研究所,北京100190;2.中国科学院大学,北京100049)
过去的几十年里,有机二阶非线性光学材料持续被科学工作者所关注。与无机电光材料相比,有机电光材料有着不可比拟的优势,如非线性系数高、介电常数低、响应时间快、成本低等[1-3]。但有机材料要实现器件化的实际应用还需满足电光系数大、热稳定性高、易于分子设计加工等要求。因此,合成新型有机二阶非线性光学发色团,实现材料中发色团分子微观的非线性(的一阶超极化率β)高效地转化成宏观的电光系数(r33)仍然是当前极具挑战性的课题[4,5]。
目前,大多数的发色团被设计成一维的电荷转移分子,这类发色团代表性的结构为D-π-A形式,其中D代表电子给体,A代表电子受体,D和A通过π电子桥连接。研究表明,发色团的非线性光学性质不仅决定于发色团给体和受体的推拉电子能力,同时显著地受到电子桥的影响[6]。根据文献报道,多烯结构常常被应用为π电子桥。因为多烯结构能够为电子的传输提供良好的通道,但所形成发色团的稳定性较差。于是,人们考虑用热稳定性较高的芳环结构作为π电子桥。研究表明这类发色团的热稳定性确实得到了提高,但是与多烯类的发色团相比,其一阶超极化率(β)明显地减小了[7]。为了权衡分子一阶超极化率和热稳定性这两方面因素,研究者开始把注意力转移到杂环上,其中以噻吩为共轭桥的发色团表现出了优良的效果,能很好地平衡这两个因素,因而被广泛地应用[8]。
同时研究发现,低聚噻吩作为共轭桥具有很好的刚性和共平面性,对发色团的μβ值的提高有很大的贡献[6]。本文采用4,4-二己基-环戊并[2,1-b:3,4-b′]二噻吩作为π电子桥,N,N-二乙基苯胺作为给体,三氰基-二氢呋喃(TCF)作为受体,合成新型的发色团(如图1),其中以本实验室合成的FTC发色团作为参比发色团。
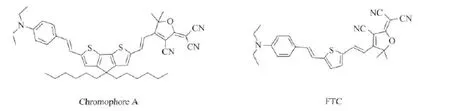
图1 化合物A和FTC结构图
1 实验部分
1.1 试剂与仪器
所有溶剂如果没有经特别说明都是国产分析纯试剂。N,N-二乙基苯胺购买于百灵威化学品公司;其他试剂均购于北京偶合科技有限公司。N,N-二甲基甲酰胺(DMF):CaH2回流,减压蒸馏;绝对无水乙醚的制备:加入适量金属钠回流,直至溶液中加入二苯甲酮后呈现蓝色,在隔绝湿气的条件下蒸馏收集;无水THF的制备:同无水乙醚的制备。
UV-2001型紫外-可见吸收光谱仪;基质辅助激光解吸电离分离飞行时间质谱仪(MALDITOF);Varian Gemini3001HNMR(400MHz)核磁共振仪;电晕极化装置和简单反射法测量电光系数装置均为实验室自主搭建。
1.2 化合物A的合成
化合物的合成路线如图2所示。其中给体部分(化合物3)和受体部分(TCF)的合成参考文献[9-12],化合物4的合成参考文献[13],化合物5的合成参考文献[14],化合物6和化合物7的合成参考文献[15]进行。
化合物8的合成:将化合物7(500mg,1.5 mmol)溶解于无水四氢呋喃中,氮气保护,冷却至-78℃,缓慢加入正丁基锂(1.0mL)。保持低温搅拌1h后,加入N,N-二甲基甲酰胺(1mL),再反应1h后缓慢恢复到室温。然后,将反应物倒入200mL的饱和氯化铵溶液中猝灭中和,用二氯甲烷萃取(×3),旋除部分溶剂后用无水 MgSO4干燥。最后,硅胶柱层析分离得到黄色油状物,产率为70%。
1HNMR (400MHz,CDCl3):9.91 (s,2H),7.63(s,2H),1.94~1.88(m,4H),1.17(d,J =12.1Hz,12H),0.94(d,J=8.3Hz,4H),0.82(t,J=6.8Hz,6H).MS(MALDITOF),m/z:402.61(M+)。
化合物9的合成:将化合物8(500mg,1.2 mmol)和化合物3(630mg,1.2mmol)混合于50mL四氢呋喃中,冷却至-78℃,分批次向其中加入150mg叔丁醇钾。持续搅拌1h后,恢复到室温。反应物用饱和氯化铵溶液中和,用乙酸乙酯萃取后,无水 MgSO4干燥,硅胶柱层析分离得到红色油状物,产率为70%。
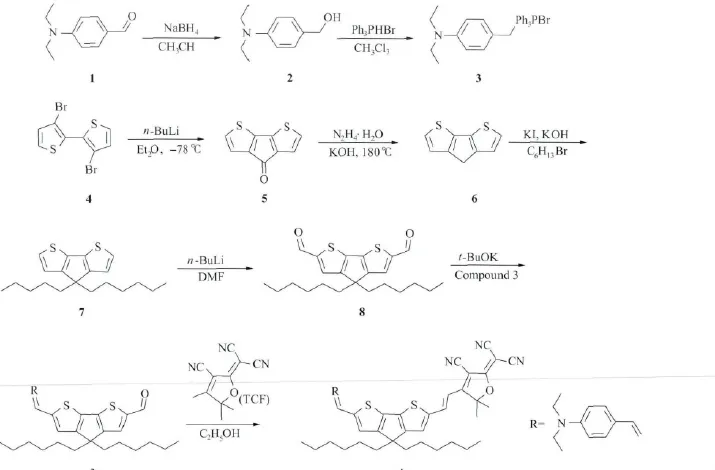
图2 化合物A的合成路线图
1HNMR (400MHz,CDCl3):9.81(s,1H),7.54(s,1H),7.35(d,J=8.6Hz,2H),7.00(d,J=16.0Hz,1H),6.92(d,J=15.9Hz,1H),6.87 (s,1H),6.66 (d,J = 8.5Hz,2H),3.39(q,J=6.8Hz,4H),1.86(dd,J=15.8,6.2Hz,4H),1.18(dd,J=13.2,6.0 Hz,18H),0.99(d,J=6.9Hz,4H),0.83(t,J= 6.8Hz,6H).MS (MALDI-TOF),m/z:547.86(M+)。
化合物10的合成:将化合物9和TCF按照1∶1.5投放到250mL的圆底烧瓶中,加入100 mL的乙醇。80℃加热回流,点板查看反应进度,反应持续4h后,停止加热。温度降到室温后,旋蒸除去溶剂,硅胶柱层析分离得到深蓝色固体,产率为60%。
1HNMR (400MHz,CDCl3):7.86 (d,J=15.2Hz,1H),7.29(d,J=8.4Hz,2H),7.23(s,1H),6.89(d,J=15.4Hz,2H),6.80(s,1H),6.59(d,J=6.6Hz,2H),6.42(d,J=15.8Hz,1H),3.33(s,4H),1.79(dd,J=13.2,6.7Hz,4H),1.65(s,6H),1.13~1.08(m,12H),0.92~0.84(m,4H),0.75(t,J=6.9Hz,6H).MS(MALDI-TOF),m/z:729.05(M+)。
2 结果与讨论
2.1 紫外可见吸收图谱
为了探究化合物A的电荷转移能力,分别将化合物A溶于6种不同介电常数的溶剂(浓度相同)中,分别测试了每种溶液的紫外吸收光谱,吸收图谱如图3所示,相关的数据列于表1中。从紫外吸收图谱可以看出,发色团的吸收主要分布在500~800nm,该可见光区域的吸收主要源于苯胺给体和TCF受体的分子间电荷转移。同时,我们可以看出,随着溶剂介电常数的增加,最大吸收波长(λmax)先增大后减小,发色团在氯仿中的最大吸收波长最大,为748nm。文献报道,正溶剂化效应某种程度上反映了发色团的μβ值。如表1所示,化合物A在氯仿中最大吸收峰较1,4-二氧六环中的最大吸收峰红移了72nm,远大于FTC(55nm)发色团。这表明化合物A比FTC发色团更容易极化,同时证明环戊二噻吩拥有更好的电荷转移能力,所形成的发色团有良好的二阶非线性。
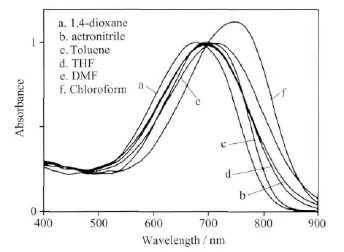
图3 不同溶剂中化合物A的紫外吸收图谱

表1 紫外吸收和DFT计算数据一览Data from DFT calculation and cyclic voltammetry
2.2 密度泛函理论计算(DFT)
为了更好地了解发色团在基态和激发态时电子分布情况,我们进行了密度泛函理论计算(DFT)。该理论计算使用Gaussian 03软件包,用B3LYP方法结合6-31G*基组完成[18-20]。首先对化合物A进行结构优化,分别计算了该化合物的基态和激发态能级,电子云密度和微观一阶超极化率β。所得结果列于表1中。分子微观二阶非线性可以由一阶超极化率(β)来表征,它的大小取决于分子内电荷转移能力、取代基和位阻效应等因素。
从电子云的分布图(图4)中我们可以看出,基态时,电子主要集中在给体处;而激发态时,电子主要集中在受体处。同时,我们也可以看出,基态和激发态的电子分布在发色团的轴向上是非对称的,这是发色团获得较大β的关键。
DFT计算的结果表明,化合物A具有较小的能极差ΔE=1.87eV,而作为经典的发色团FTC的ΔE=2.05eV[21]。且计算所得化合物的一阶超极化率为1454×10-30esu,远大于FTC发色团的(883×10-30esu)[21]。
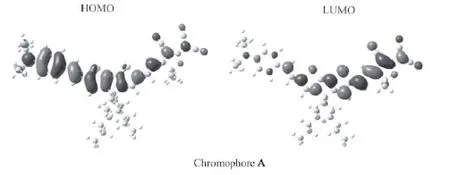
图4 化合物A的前线轨道和极化结构
2.3 热分析和电光活性
热稳定性是影响发色团后续加工的一个重要因素,直接关乎发色团的实际应用。我们对化合物进行了热重分析,测得化合物A的热力学分解Td为213℃,完全可以满足后续加工应用的需求。
材料的宏观电光活性可以用电光系数(r33)来表征,我们采用简单反射法测定了发色团的电光系数[22],将发色团掺杂到主体聚合物聚碳酸酯APC(Tg=190℃)中,测试了含不同发色团浓度的极化聚合物薄膜的电光系数r33,通过不断地摸索发现,当化合物浓度为20%,极化电压为12000 V,极化温度为135℃时,所得r33最大,为85pm/V。
可以看出,化合物A的r33值比FTC发色团的r33值(25pm/V)要大,这可能是由于发色团的微观结构导致的。从化合物的微观结构中(图4),我们可以看到侧链上的两个己基分布在主轴的两侧,这样就能很好地减小分子间的静电相互作用。根据下面两个经验公式,当静电作用W(公式2)减小时,取向度参数(cos3θ)会增加,从而有利于电光系数r33(公式1)的提高。
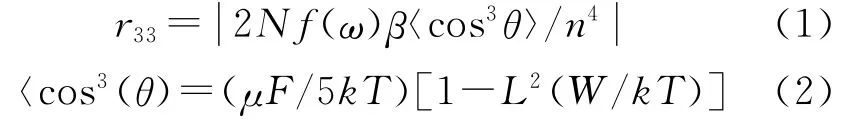
式中N是有序取向的发色团数密度,f(ω)为本地场因子(Local area field),它取决于发色团周围环境的介质特性,n是折射率,〈cos3θ〉为取向度参数,θ为发色团偶极矩与电场的夹角,W 为分子间静电作用。
3 结论
合成并表征了一种含有4,4-二己基-4H-环戊并[2,1-b:3,4-b′]二噻吩的发色团,通过各项表征和计算结果,我们可以得出4,4-二己基-4H-环戊并[2,1-b:3,4-b′]二噻吩作为电子桥有利于分子内电荷转移速率和一阶超极化率的提高,并且明显地提高了发色团的电光活性。结果显示,浓度为20%的极化聚合物薄膜r33值为85pm/V。同时,侧链二己基有效地减小了发色团间静电作用,有利于发色团电光系数的提高。所以,我们相信4,4-二己基-4H-环戊并[2,1-b:3,4-b′]二噻吩应用于非线性光学材料是非常有前景的。
[1] Dalton L R,Sullivan P A,Bale D H.Electricfield poled organic electro-optic materials:state of the art and future prospects[J].Chemical Reviews,2010,110(1):25-55.
[2] Cho M J,Choi D H,Sullivan P A,Akelaitis A J P,Dalton L R.Recent progress in second-order nonlinear optical polymers and dendrimers [J].Progress in Polymer Science,2008,33(11):1013-58.
[3] Dalton L,Benight S.Theory-guided design of organic electro-optic materials and devices[J].Polymers,2011,3(3):1325-51.
[4] Muhammad S,Xu H,Janjua M R S A,Su Z,Nadeem M.Quantum chemical study of benzimidazole derivatives to tune the second-order nonlinear optical molecular switching by proton abstraction [J].Physical Chemistry Chemical Physics,2010,12(18):4791-9.
[5] Wu W,Qin J,Li Z.New design strategies for second-order nonlinear optical polymers and dendrimers[J].Polymer,2013,54(17):4351-82.
[6] Kim O K,Fort A,Barzoukas M,Blanchard-Desce M,Lehn J M.Nonlinear optical chromophores containing dithienothiophene as a new type of electron relay [J].Journal Material of Chemistry,1999,9(9):2227-32.
[7] Benight S J,Bale D H,Olbricht B C,Dalton L R.Organic electro-optics:understanding material structure/function relationships and device fabrication issues [J].Journal Material of Chemistry,2009,19(40):7466-75.
[8] Wu W,Xin S,Xu Z,Ye C,Qin J,Li Z.Main-chain second-order nonlinear optical polyaryleneethynylenes containing isolation chromophores:enhanced nonlinear optical properties,improved optical transparency and stability[J].Polymer Chemistry,2013,4(11):3196-203.
[9] Hou J H,Park M H,Zhang S,Yao Y,Chen L M,Li J H,Yang Y.Bandgap and molecular energy level control of conjugated polymer photovoltaic materials based on benzo[1,2-b:4,5-b′]dithiophene[J].Macromolecules,2008,41(16):6012-8.
[10] Slocum D W,Gierer P L.Directed metalation reactions.8.Directed metalation of 3-mono-and 2,5-disubstituted thiophenes[J].The Journal of Organic Chemistry,1976,41(23):3668-73.
[11] Beimling P,Koßmehl G.Synthesis of benzo[1,2-b′:4,5-b′]dithiophene and its 4,8-dimethoxy and 4,8-dimethyl derivatives[J].ChemischeBerichte,1986,119(10):3198-203.
[12] He M Q,Leslie T M,Sinicropi J A.alpha-Hydroxy ketone precursors leading to a novel class of electro-optic acceptors[J].Chemistry of Materials,2002,14(5):2393-400.
[13] Barlow S,Odom S A,Lancaster K,Getmanenko Y A,Mason R,Coropceanu V,Br das J L,Marder S R.Electronic and optical properties of 4H-cyclopenta[2,1-b:3,4-b′]bithiophene derivatives and their 4-heteroatom-substituted analogues:ajoint theoretical and experimental compari-son[J].The Journal of Physical Chemistry B,2010,114(45):14397-407.
[14] Wang Z,Putta A,Mottishaw J D,Wei Q,Wang H,Sun H.Molecular origin of isomerization effects on solid state structures and optoelectronic properties:a comparative case study of isomerically pure dicyanomethylene substituted fused dithiophenes[J].The Journal of Physical Chemistry C,2013,117(33):16759-68.
[15] Li R,Liu J,Cai N,Zhang M,Wang P.Synchronously reduced surface states,charge recombination,and light absorption length for high-performance organic dyesensitized solar cells[J].The Journal of Physical Chemistry B,2010,114(13):4461-4.
[16] Padhy H,Sahu D,Patra D,Pola M K,Huang J H,Chu C W,Wei K H,Lin H C.Synthesis and applications of cyano-vinylene-based polymers containing cyclopentadithiophene and dithienosilole units for photovoltaic cells [J].Journal of Polymer Science,Part A,Polymer Chemistry,2011,49(15):3417-25.
[17] Thelakkat M,Fink R,Haubner F,Schmidt H W.Synthesis and properties of novel hole transport materials for electroluminescent devices [J].Macromolecular Symposia,1998,125(1):157-64.
[18] Dickson R M,Becke A D.Basis-set-free local densityfunctional calculations of geometries of polyatomicmolecules[J].Journal of Chemical Physics,1993,99(5):3898-905.
[19] Frisch M J,Trucks G W,Schlegel H B,Scuseria G E,Robb M A,Cheeseman J R,et al.Gaussian 03,revision B.03.Gaussian Inc,Pittsburgh,PA.2003.
[20] Lee C,Parr R G.Exchange-correlation functional for atmos and molecules[J].Physical Review A,1990,42(1):193-200.
[21] Yang Y H,Xu H J,Liu F G,Wang H R,Deng G W,Si P,Huang H Y,Bo S H,Liu J L,Qiu L,Zhen Z,Liu X H.Synthesis and optical nonlinear property of Y-type chromophores based on double-donor structures with excellent electro-optic activity [J].Journal of Materials Chemistry C,2014,2(26):5124.
[22] Teng C C,Man H T.Simple reflection technique for measuring the electro-optic coefficient of poled polymers [J].Applied Physics Letters,1990,56(18):1734.

