一种多通道匀浆装填毛细管色谱柱的新装置及应用
吕雅瑶, 郝斐然, 王欢欢, 付 斌, 钱小红, 张养军
(蛋白质组学国家重点实验室, 北京蛋白质组研究中心, 军事医学科学院放射与辐射医学研究所, 北京 102206)
研究论文
一种多通道匀浆装填毛细管色谱柱的新装置及应用
吕雅瑶, 郝斐然, 王欢欢, 付 斌, 钱小红, 张养军*
(蛋白质组学国家重点实验室, 北京蛋白质组研究中心, 军事医学科学院放射与辐射医学研究所, 北京 102206)
针对目前毛细管色谱柱装柱效率低、不同批次装填的毛细管色谱柱之间性能差异大的问题,我们发展了一种多通道匀浆装填毛细管色谱柱的新装置。该装置以液相色谱泵提供压力、采用磁力搅拌保持匀浆液均匀分散,一次可装填多达6根毛细管色谱柱。以牛血清白蛋白(BSA)的胰蛋白酶酶切肽段混合物为样本,选择峰容量、蛋白覆盖率、3个特定离子的保留时间以及毛细管色谱柱柱压为指标,在毛细管液相色谱-质谱联用系统上对装填的反相毛细管色谱柱的性能进行了评价。分别考察了一次装填的6根毛细管色谱柱、两次装填的12根毛细管色谱柱以及一次装填1根与一次装填6根毛细管色谱柱的性能及稳定性。实验结果表明:同一批次装填的6根毛细管色谱柱的性能相近;不同批次装填的12根毛细管色谱柱的峰容量和覆盖率没有明显的区别,但保留时间和毛细管色谱柱柱压的稳定性较差;一次装填1根和一次装填6根毛细管色谱柱柱性能的稳定性与两次分别装填6根毛细管色谱柱的稳定性相近,即采用本装置可显著提高毛细管色谱柱的装填效率且每次装填毛细管色谱柱的数量不会对柱性能产生影响。
毛细管液相色谱-质谱联用;毛细管色谱柱;装柱装置;多通道
目前,液相色谱-质谱联用技术已经成为复杂生物样本中多肽、蛋白质、蛋白质组定性鉴定和定量分析的常用方法。由于生物样品中生物大分子组成的极端复杂性,如组成种类繁多、动态范围宽,毛细管液相色谱的高效分离已经成为液相色谱-质谱联用分析中的关键步骤[1,2]。大多数实验室都是自己装填毛细管色谱柱以满足他们的不同需求,因此毛细管色谱柱的装柱技术已经成为一般实验室的必备技术。毛细管色谱柱的填充方法主要有电动填充方法[3-5]、气压匀浆装填方法[5]和液压匀浆装填方法[5-7]。电动填充方法是基于填料与溶剂表面接触时,填料颗粒表面常常会带一定量的电荷,在高压电场的作用下,填料颗粒定向迁移进入毛细管,实现装填毛细管色谱柱的目的[3]。该方法的优点是填充的毛细管色谱柱的柱床比较致密,但设备复杂,成本高。气压匀浆装填方法采用高压氮气瓶提供压力将填料的匀浆液压入毛细管柱中,这种方法可以满足长度为20 cm左右,装填3 μm或5 μm粒径颗粒填料的毛细管色谱柱,可满足一般生物样本中蛋白质组定性和定量分析的需求。但要满足目前提出的蛋白质组深度覆盖和准确定量分析的需求,则需要装填更长的毛细管色谱柱(3 μm或5 μm粒径颗粒填料)[8]或装填长度约为20 cm的毛细管色谱柱(亚2 μm填料)[9-11]。对于装填这类毛细管色谱柱,气压匀浆装填方法(一般采用的氮气钢瓶的压力不超过25 MPa)不能满足要求,为此,研究人员发展了一种液压匀浆装填毛细管色谱柱的方法,即由高压色谱泵提供压力,与匀浆罐连接实现毛细管色谱柱高效快速的装填[12]。但目前采用这种装填方法一次仅能装填1根毛细管色谱柱,装柱效率低,不能满足毛细管高效液相色谱与质谱联用技术快速发展和使用的需求。另外,不同批次装填的毛细管色谱柱的性能稳定性不易保证。针对以上问题,根据帕斯卡原理(即液相色谱泵输入匀浆罐的压强可大小不变地传输到匀浆罐内部的各点),我们发展了一种以液相色谱泵提供压力,连接带有磁力搅拌的六通道匀浆装填毛细管色谱柱的新装置(6个装柱通道分别位于匀浆罐的6个侧面的同一水平高度)。使用本装置具有如下优点:(1)可同时装填最多6根毛细管色谱柱,具有高的装填效率;(2)可有效减小不同批次装填色谱柱带来的稳定性差的问题;(3)兼具了每次仅装填1根毛细管色谱柱装置的功能,且没有增加额外的成本;(4)与每次仅装填1根毛细管色谱柱装置的装填方法相同,易于掌握和推广。
1 实验部分
1.1 仪器、试剂与材料
纳升级液相色谱(NanoLC-2D, Eksigent Technologies公司,美国)-电喷雾-线性离子阱质谱仪(ESI-LTQ MS, ThermoFisher Scientific公司,美国);液相色谱泵(ThermoFisher Scientific公司,美国);磁力搅拌器(海辰科瑞机电设备有限公司,北京);真空冰冻干燥机(SC100A Speedvac Plus, Thermo Savant公司,美国);高速离心机(ThermoFisher Scientific公司,美国); Milli-Q A10型纯水仪(Millipore公司,美国); 15 cm×75 μm直喷头空管柱(New Objective公司,美国);直径3 μm、孔径10 nm的十八烷基硅胶(ODS)填料(金欧亚公司,北京)。
牛血清白蛋白(BSA)购自北京迪拜尔生物技术有限公司;测序级胰蛋白酶购于美国Promega公司;二硫苏糖醇(DTT)、碘乙酰胺(IAA)、碳酸氢铵、甲醇、乙腈购自美国Sigma公司;乙醇、异丙醇、氯仿购自国药集团化学试剂有限公司。
1.2 色谱柱装填条件
1.2.1匀浆溶剂的选择
平行称取6份2.5 mg粒径3 μm的ODS填料分别加入6个1.5 mL塑料离心管中,依次编号为1、2、3、4、5和6,分别在1~6号管中加入750 μL分析纯的甲醇、乙醇、异丙醇、乙腈、水、氯仿,涡旋30 s,使其均匀分散,静置10 min后观察填料沉降状态,以沉降速度作为匀浆溶剂选择的依据之一。
1.2.2磁搅拌条件的选择
称取10 mg粒径3 μm的ODS填料置于4 mL塑料离心管中,并在其中放入工程塑料包埋铁棒制作的磁子,剩余体积用甲醇补满后盖紧离心管盖。将离心管竖直放置在磁力搅拌器上,将磁力搅拌器打开并逐渐升到最大功率档位,在30 min内持续观察填料沉降状态,依据匀浆液的分散程度确定最佳搅拌速度。
1.3 多通道匀浆装填毛细管色谱柱装置的设计和制造
如图1a所示,多通道匀浆装填毛细管色谱柱的装柱罐包括匀浆罐(1)、匀浆罐盖(2)、连接管(3)、固定螺母(4)和固定螺母(5)以及毛细管色谱柱空管(6)。其中匀浆罐是由不锈钢加工而成的一个正六方体,其高为39 mm,平行平面间距为54 mm。其内部为盛放色谱填料匀浆液的腔体(7)(高为18 mm,直径为12 mm,体积为2 mL)(如图1b所示);六面体的每一面都有一个阴性孔与腔体连通,其位置在距腔体底部以上10 mm;在腔体(7)中放一个磁子(8);匀浆罐盖(2)由不锈钢加工而成,其上有与固定螺母(4)连接的阴性孔,与匀浆罐(1)之间通过圆形聚四氟乙烯密封垫实现密封;连接管(3)为能够耐受40 MPa以上压力的不锈钢管或工程塑料管,其中一端与匀浆罐盖(2)连接,另一端与高压色谱泵连接,且高压色谱泵能够提供大于40 MPa的压力;固定螺母(4)和(5)配套有锥形不锈钢垫圈或锥形工程塑料垫圈以及固定毛细管和毛细管色谱柱的工程塑料套管;毛细管色谱柱空管(6)为内径小于0.3 mm,外径略小于毛细管工程塑料管内径且能耐受40 MPa压力的玻璃毛细管。按此设计加工和组装,图1c为由匀浆罐、液相色谱泵、储液罐和磁力搅拌器组装的多通道匀浆装填毛细管色谱柱装置的实物照片。
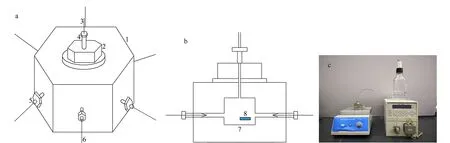
图1 多通道匀浆装填毛细管色谱柱新装置的(a)整体结构示意图、(b)剖面结构示意图和(c)装置的实物照片Fig.1 (a) A schematic diagram, (b) a cross-sectional diagram and (c) a photo of a multiple-channel can for packing capillary chromatographic column 1. multiple-channel can; 2. lid of multiple-channel can; 3. tube; 4. nut; 5. nut; 6. capillary chromatographic column; 7. cavity of multiple-channel can; 8. magnetic stick.
1.4 毛细管色谱柱的装填及性能评价
首先选取需要装填的毛细管色谱柱空管和个数,将其分别固定于匀浆罐的任意一个阴性孔上。如果装填的毛细管色谱柱少于6根,剩余的阴性孔用堵头封闭。然后选择需要装填的色谱填料,用匀浆试剂将其配制成匀浆液并转移到匀浆罐的圆柱形腔体中,放入磁子,装上匀浆罐盖后,将匀浆罐放在磁搅拌器上,调节磁子转速到适当大小对匀浆液进行搅拌。通过连接管将匀浆罐与高压色谱泵连接后,打开色谱泵电源开关,调节流动相的流速,流动相携带色谱填料进入毛细管色谱柱,等待色谱柱装填到需要的长度后,关闭高压色谱泵,使装填系统压力与大气压平衡后,卸下毛细管色谱柱,对其性能进行测试和评价。
采用上述方法分别装填了3批毛细管色谱柱,其中2批分别装填6根毛细管色谱柱(其中1批柱编号分别为0403-1、0403-2、0403-3、0403-4、0403-5、0403-6,另1批柱编号分别为0407-1、0407-2、0407-3、0407-4、0407-5、0407-6。另外一次装填1根毛细管色谱柱的编号为0410。在液相色谱-质谱联用系统上对这些毛细管色谱柱的性能进行评价,主要考察同批次装填的6根毛细管色谱柱性能的稳定性、不同批次装填的色谱柱性能的稳定性以及一次装填1根毛细管色谱柱与一批装填6根毛细管色谱柱性能的稳定性。在比较之前,选择1批装填的任1根毛细管色谱柱重复分离1个样品6次,以其在液相色谱-质谱联用系统上的性能结果作为参考来评价不同毛细管色谱柱的性能。
1.5 样品前处理
取100 mg BSA,以50 mmol/L碳酸氢铵溶液溶解至终浓度为1 mg/mL,加入DTT(终浓度为10 mmol/L),在37 ℃恒温箱中放置4 h。再加入碘乙酰胺(终浓度为50 mmol/L),暗处放置1 h。按照胰蛋白酶与BSA的质量比为1∶50加入胰蛋白酶,在37 ℃下酶切18 h,用C18柱脱盐,冷冻干燥后用流动相A液复溶,并使肽段终浓度为1 μg/μL。
1.6 仪器条件
1.6.1色谱条件
所用带喷头的毛细管色谱柱的规格为15 cm×75 μm,装填的全多孔型反相色谱填料的粒径为3 μm,孔径为10 nm。在NanoLC-2D毛细管液相色谱仪上对毛细管反相色谱柱的性能进行评价。流动相A为2%(v/v)乙腈和0.1%(v/v)甲酸的水溶液,流动相B为98%(v/v)乙腈和0.1%(v/v)甲酸的水溶液;梯度洗脱程序:0~5 min, 5%B~8%B; 5~30 min, 8%B~40%B; 30~35 min, 40%B~95%B; 35~40 min, 95%B; 40~42 min, 95%B~5%B; 42~52 min, 5%B。流动相流速为300 nL/min。
1.6.2质谱采集条件
液相色谱-质谱联用分析时,选用电喷雾离子源、正离子模式采集数据,毛细管温度设定为180 ℃,质谱扫描范围设为m/z400.0~1 600.0,采集时间设为52 min。采用数据依赖模式(DDA)进行串联质谱分析,选取一级质谱中10个信号最强的离子进行二级质谱分析,其碰撞能量设为35%,采用动态排除功能(dynamic exclusion),排除时间为30 s。
1.7 质谱数据处理
将质谱采集后产生的raw文件通过Thermo Proteome Discoverer软件(版本号1.3.0.339, ThermoFisher Scientific公司,美国)对质谱数据进行检索,其参数设置:母离子质量偏差(precursor tolerance)为0.5 Da;碎片离子质量偏差(fragment tolerance)为0.8 Da;假阳性率(FDR)为1%;蛋白质酶解选用胰蛋白酶,选择2个漏切位点;固定修饰:半胱氨酸的烷基化修饰;可变修饰:甲硫氨酸氧化修饰;蛋白质数据库为牛血清白蛋白数据库(2015年2月30日从http://www.ncbi.nlm.nih.gov/protein/?term=bsa下载)。
2 结果与讨论
2.1 匀浆溶剂的选择
填料在溶剂中沉降的速率公式为[5]:
式中:V代表填料颗粒沉降速度(cm/s),g为重力加速度(cm/s2),d为填料颗粒直径(cm),ρ为填料颗粒密度(g/cm3),ρo为液体密度(g/cm3),η为液体的黏度(mPa5s)。
为了保证毛细管柱填充均匀致密,首先应使悬浮液尽量稳定,防止在色谱柱填充过程中填料颗粒分级沉淀。从以上公式可以看出,对某一种粒径的填料可以通过两种方法来减小其沉降速度:一是选择溶剂密度与填料颗粒密度相近的溶剂;二是选择溶剂黏度系数较大的溶剂。另外,选取极性和填料相近的溶剂也能使填料较好地润湿和分散在匀浆液中。同时,还需要从实验者安全角度及溶剂成本考虑,选取毒性小、价格便宜的溶剂配制匀浆。基于此,我们选择了6种溶剂(见表1)进行试验,考察6种溶剂对3 μm ODS填料的悬浮液涡旋混匀后放置10 min后的分散状态,由图2可见填料在氯仿中分散均匀,但是考虑到其毒性以及对装置中使用的塑料部件所具有的溶解作用,不能选择氯仿作为匀浆溶剂;水由于极性大,无法分散填料;乙醇、异丙醇对填料的分散状态稍好于甲醇、乙腈,但由于它们的黏度大,装柱时产生的压力大;而乙腈的价格较甲醇高,故选择甲醇作为匀浆溶剂装填毛细管色谱柱。
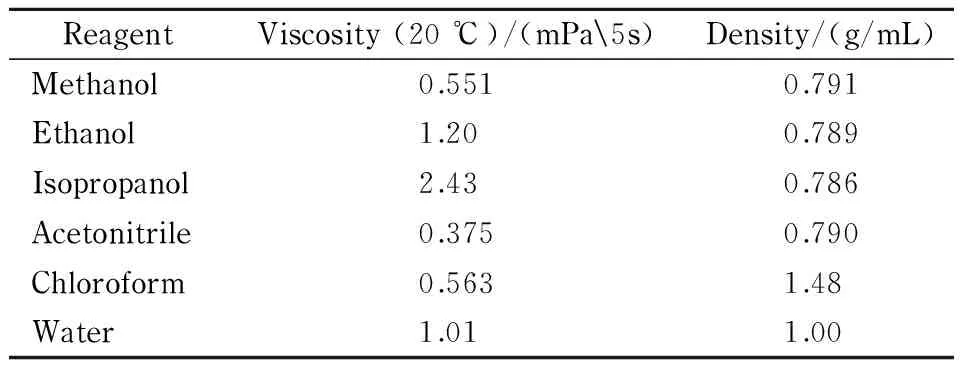
表1 6种匀浆溶剂的黏度和密度

图2 3 μm ODS填料分散在不同溶剂中的分散状态Fig.2 Suspended states of 3 μm ODS in different solvents Solvents: 1. methanol; 2. ethanol; 3. isopropanol; 4. acetonitrile; 5. water; 6. chloroform.
2.2 磁力搅拌条件的选择
逐渐增加磁力搅拌器的功率档,在最大功率档搅拌匀浆液,持续观察30 min,匀浆液一直维持均匀分散状态,说明在磁力搅拌条件下,甲醇能够均匀分散ODS填料,可以满足毛细管色谱柱装柱时对匀浆液的要求。
2.3 毛细管色谱柱的性能评价
2.3.1同批次装填的毛细管色谱柱的稳定性
以本装置1次装填了6根毛细管色谱柱,从中随机选取1根毛细管色谱柱,在液相色谱-质谱联用系统上分别对BSA酶切肽段混合物进行6次色谱分离分析,对柱效、保留时间及柱压的稳定性进行考察,并以此作为比较同一批次装填的6根色谱柱的柱效和保留时间稳定性的参考。
图3为采用同一根色谱柱重复6次色谱分离BSA酶切肽段混合物的基峰总离子流色谱图,表2为图3中的峰容量以及软件搜库后的覆盖率。另外,在总离子流色谱图中出峰时间前、中和后3个位置提取m/z722.95、m/z653.90、m/z582.71 3个信号强度较强的离子色谱峰,分别比较6次色谱分离的保留时间,结果如表3所示。以相对标准偏差(RSD)表示其离散程度:峰容量的RSD=7.3%;覆盖率的RSD=5.3%;m/z722.95峰保留时间的RSD=0.9%,m/z653.90峰保留时间的RSD=0.3%,m/z582.71峰保留时间的RSD=0.5%。从表2和表3的结果可知,由于液相色谱-质谱联用分析过程中受随机因素的影响,即使采用一根毛细管色谱柱重复分离同一样品,其峰容量、蛋白覆盖率及保留时间也会有一定的波动。我们将此结果作为评价同一批次装填的6根毛细管柱稳定性的参考。

图3 同一根色谱柱重复6次分离BSA酶切肽段混合物的基峰总离子流色谱图Fig.3 Base peak chromatograms of the separation for six times on the capillary chromatographic column of a peptide mixture digested from BSA

表2 同一根色谱柱重复6次分离鉴定BSA酶切肽段混合物的峰容量及覆盖率比较
2.3.2同批次装填的6根毛细管色谱柱的性能
图4为0407-1、0407-2、0407-3、0407-4、0407-5和0407-6毛细管色谱柱分离BSA酶切肽段混合物的基峰总离子流色谱图;表4和表5分别列出了其峰容量、覆盖率和从总离子流色谱图中提取的m/z722.95、m/z653.90、m/z582.71 3个离子的保留时间;图5为各毛细管色谱柱分离样品时的压力曲线。从表4和表5可知,峰容量的RSD=7.1%;覆盖率的RSD=3.8%;m/z722.95峰保留时间的RSD=6.0%,m/z653.90峰保留时间的RSD=2.7%,m/z582.71峰保留时间的RSD=4.2%;从图5可知,在液相色谱分离的有效梯度时间内(即5~30min)0407系列毛细管色谱柱的柱压范围为(11.5±1.5) MPa。

表3 1根色谱柱重复6次分离中3个离子的保留时间的重复性
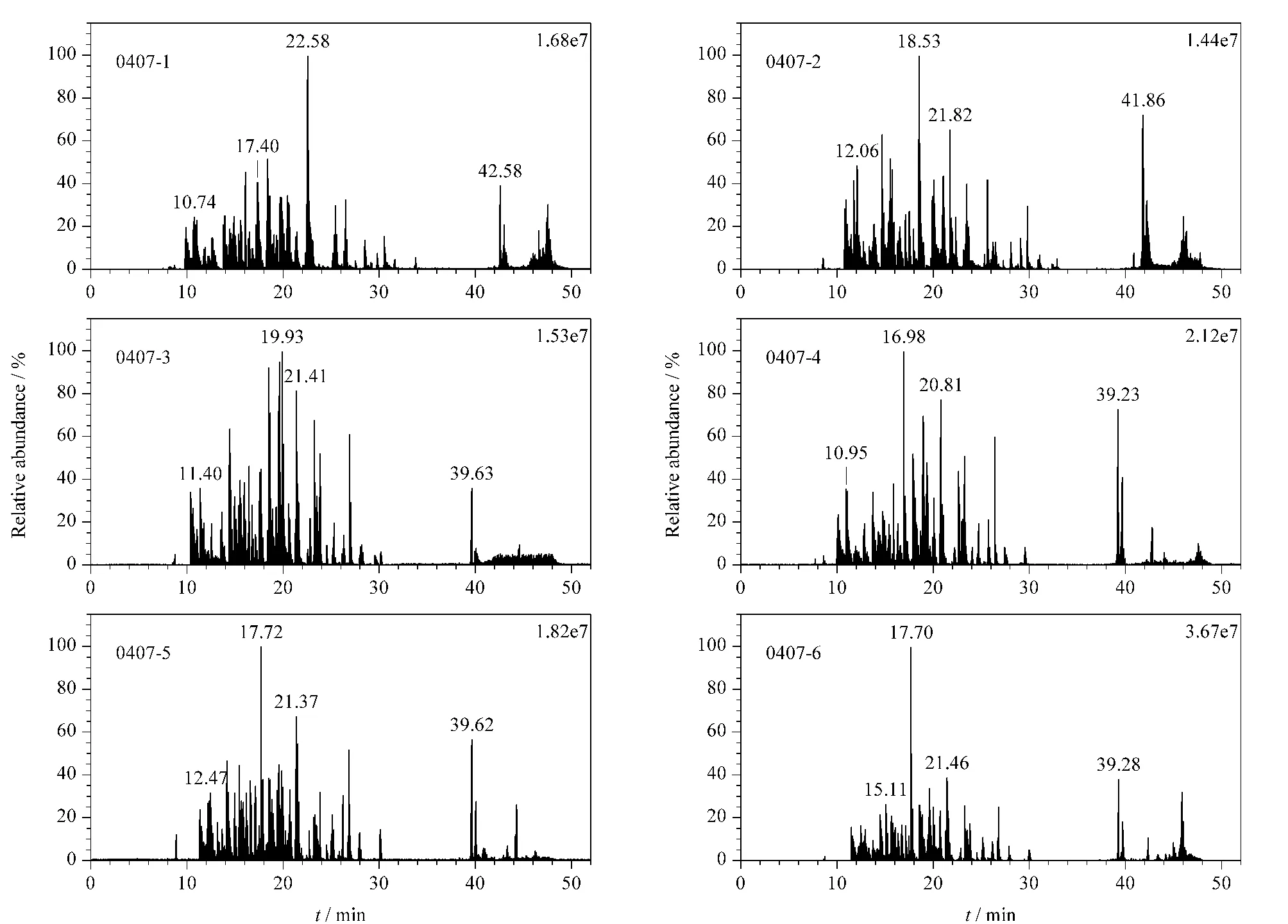
图4 0407系列毛细管色谱柱(0407-1~0407-6)分离BSA酶切肽段混合物的基峰总离子流色谱图Fig.4 Base peak chromatograms of the separation of a peptide mixture digested from BSA on the capillary chromatographic columns denoted as 0407-1-0407-6

表4 0407系列毛细管色谱柱(0407-1~0407-6)分离鉴定BSA酶切物的峰容量及覆盖率比较
相对于以1根毛细管色谱柱重复6次分离同一样品的分离结果,0407系列6根毛细管色谱柱分离样品保留时间的RSD值与前者最大差异为8倍,柱压波动范围为±12.9%,峰容量的RSD值比前者小2.7%,覆盖率的RSD值比前者小28.3%。由此得出结论,同一批次装填的6根毛细管色谱柱虽然保留时间和柱压有所差异,但柱效基本一致。
2.3.3不同批次装填的12根毛细管色谱柱的性能
以0403系列毛细管色谱柱分离BSA酶切肽段混合物,类似于2.3.2节中0407系列毛细管色谱柱的柱效分析。通过对实验结果进行分析,0403-1~0403-6系列色谱柱的覆盖率依次为53.34%、54.55%、51.80%、44.94%、55.57%、56.26%,以Grubbs法判断,44.94%这个数值应舍去(置信度95%),其他数据平均值54.30%;峰容量依次为33、33、34、29(舍去)、35、34,平均值为33.8;m/z722.95的保留时间依次为16.91、16.58、15.91、14.63、13.11、12.84 min,平均值15.00 min;m/z653.90的保留时间依次为21.51、22.57、23.63、19.67、18.79、20.24 min,平均值21.07 min;m/z582.71的保留时间依次为25.72、26.67、28.22、23.60、23.10、25.55 min,平均值25.48 min;在液相色谱分离的有效梯度时间内(即5~30 min),0403系列毛细管色谱柱的柱压范围为(19.2±1.9) MPa。表6和表7分别列出了0403系列毛细管色谱柱和0407系列毛细管色谱柱峰容量、蛋白覆盖率和保留时间的对比结果。
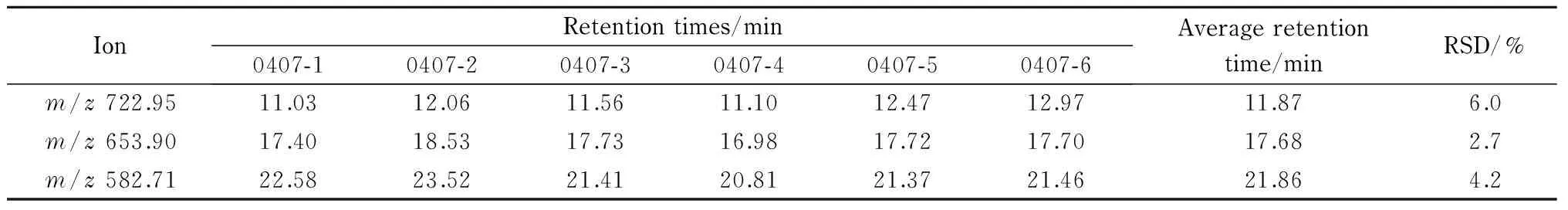
表5 0407系列毛细管色谱柱(0407-1~0407-6)分离BSA酶切物的3个离子保留时间的比较

图5 0407系列毛细管色谱柱(0407-1~0407-6)分离 BSA酶切肽段混合物的柱压曲线图Fig.5 Column pressure diagrams of the separation of a peptide mixture digested from BSA on the capillary chromatographic columns denoted as 0407-1-0407-6

表6 0407和0403两批次装填的色谱柱分离鉴定BSA酶切物的峰容量及覆盖率比较
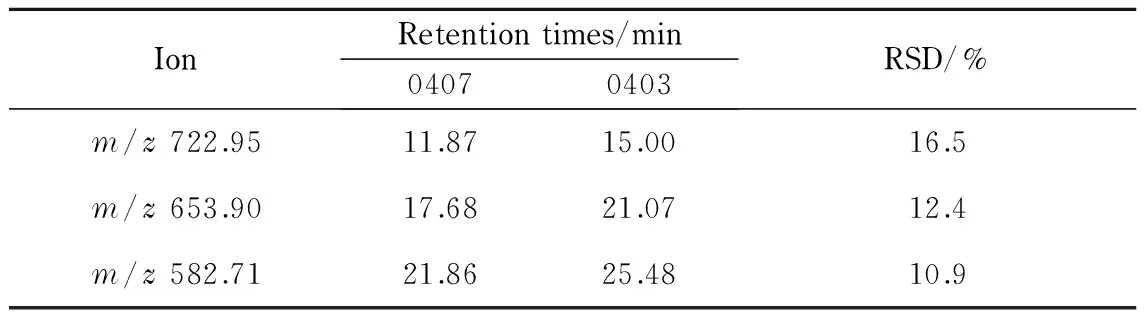
表7 0407和0403两批次装填的色谱柱分离BSA酶切物的3个离子的保留时间比较
从以上结果看出,0403系列毛细管色谱柱和0407系列毛细管色谱柱之间的稳定性与0407系列6根毛细管色谱柱之间的稳定性比较,前者保留时间的RSD值比后者最大相差3.6倍,峰容量的RSD值比后者大87.3%,覆盖率的RSD值比后者大39.5%,两批次装填的毛细管色谱柱的柱压相差49.8%,其波动范围是同一批次毛细管色谱柱之间的柱压波动的3.9倍。即两批毛细管色谱柱的保留时间和柱压存在较大差异,且二者的峰容量和覆盖率差异都明显大于同一批次装填的毛细管色谱柱之间的差异。由此得出结论,不同批次装填的毛细管色谱柱的性能的一致性要差于同一批次色谱柱柱效的一致性。产生这种现象的主要原因是:在开始装填毛细管色谱柱时,随着溶剂携带填料进入毛细管柱并在喷头处形成筛板,由于各个商品化的空毛细管柱喷头内径不完全一致,筛板的形成方式各不相同,造成毛细管色谱柱柱压不同,进一步造成填料在毛细管柱中的堆积方式不同;另外,在毛细管色谱柱装填过程中,随着毛细管色谱柱装填长度的增加,为使压力不至于超过液相色谱泵能提供的最大压力,需要通过调节溶剂流速来控制压力,但由于不同批次装填的毛细管柱的筛板形成情况、压力变化不会完全一样,流速调节过程也不同,这样就导致了不同批次装填的毛细管色谱柱的填料逐渐堆积方式有所不同,导致其色谱性能的一致性要差于同一批次色谱柱柱效的一致性。
2.3.4比较一次装填1根毛细管色谱柱和一次装填6根毛细管色谱柱的性能
0410毛细管色谱柱分离BSA酶切肽段混合物的峰容量为30,覆盖率为53.08%,3个特定离子(m/z722.95、653.90、582.71)的保留时间分别为12.88、18.08、21.72 min,柱压为16.1 MPa。
将0410毛细管色谱柱与0407系列毛细管色谱柱的性能进行比较,二者之间峰容量的RSD=4.9%,覆盖率的RSD=3.8%, 3个离子保留时间的RSD分别为5.8%、1.6%和0.5%,其值小于两批次装填的毛细管色谱柱峰容量、覆盖率及保留时间的RSD。再将0410毛细管色谱柱与0403系列毛细管色谱柱的性能进行比较,二者之间峰容量的RSD=8.5%,覆盖率的RSD=1.7%, 3个离子保留时间的RSD分别为10.8%、10.9%和11.3%,其值不大于两批次装填的毛细管色谱柱峰容量、覆盖率及保留时间的RSD。0410毛细管色谱柱与0407系列毛细管色谱柱的柱压相差33.2%,二者柱压之间的差别小于两批次装填毛细管色谱柱之间柱压的差别。即以我们设计的多通道匀浆装填毛细管色谱柱的新装置一次装填1根与一次装填6根毛细管色谱柱的性能没有明显的区别。以上结果表明,批量装填毛细管色谱柱比一次仅装填1根毛细管色谱柱具有优势。
3 结论
本文发展了一种多通道匀浆装填毛细管色谱柱的新装置,采用该装置可显著提高毛细管色谱柱的装填效率。通过对该装置使用条件的优化,采用牛血清白蛋白的胰蛋白酶酶切肽段混合物为样本,以峰容量、蛋白覆盖率、保留时间和柱压为指标,对本装置同时以及不同批次装填的毛细管色谱柱的性能进行评价和比较,实验结果表明同一批次装填的毛细管色谱柱的性能相近;不同批次装填的毛细管色谱柱以及一次装填1根和一次装填6根毛细管色谱柱的峰容量和覆盖率没有明显的区别,但保留时间和柱压相差较大。这些结果将为实际应用中毛细管色谱柱的选择和使用提供参考。
[1] Aebersold R, Mann M. Nature, 2003, 422(6928): 198
[2] Devreese B, Vanrobaeys F, Van Beeumen J. Rapid Commun Mass Spectrom, 2001, 15(1): 50
[3] Yan C. US 5453163. [1995-09-26]
[4] Qu Q S, Zhou Y, Peng S W, et al. Chinese Journal of Chromotography (瞿其曙, 周瑜, 彭生微, 等. 色谱), 2010, 28(3): 260
[5] Liu G Q, Yu Z L. Chromatographic Column Technology. Beijing: Chemical Industry Press (刘国诠, 余兆楼. 色谱柱技术. 北京: 化学工业出版社), 2005: 114
[6] Blue L E, Jorgenson J W. J Chromatogr A, 2015, 1380: 71
[7] Zhou W H, Lin B C. Ion Exchange and Adsorption (周卫红, 林炳昌. 离子交换与吸附), 2009, 25(2): 151
[8] Zhou F, Lu Y, Ficarro S B, et al. Nat Commun, 2013, 4: 2171
[9] Feng Z, Yu L, Scott B. F, et al. Nat Commun, 2013, 4: 2171
[9] Bruns S, Frabklin E G, Grinias J P, et al. J Chromatogr A, 2013, 1318: 189
[10] Dorazio G, Rocco A, Fanali S. J Chromatogr A, 2012, 1228: 213
[11] Burgess M W, Keshishian H, Mani D R, et al. Mol Cell Proteomics, 2014, 13(4): 1137
[12] Zhang X M, Guan X (张祥民, 关霞). CN 201886008U. [2011-06-29]
A novel multiple-channel apparatus for packing capillary chromatographic column and its application
(1.DivisionofChemicalMetrologyandAnalyticalScience,NationalInstituteofMetrology,Beijing100029,China; 2.PolytechInstrument,Beijing100095,China)
LÜ Yayao, HAO Feiran, WANG Huanhuan, FU Bin, QIAN Xiaohong, ZHANG Yangjun*(StateKeyLaboratoryofProteomics,BeijingProteomeResearchCenter,BeijingInstituteofRadiationMedicine,Beijing102206,China)
A novel multiple-channel apparatus for packing capillary chromatographic column was designed and manufactured for packing six capillary chromatographic columns with close column efficiency at the same time. Briefly, it consists of a magnetic stirrer, a liquid chromatographic pump and a multiple-channel can. The reagents used for preparing ODS (C18) slurry and stirring condition of the magnetic stirrer were optimized in the study. Two batches of capillary chromatographic columns were packed under the optimum condition, and these packed capillary chromatographic columns were evaluated in the terms of peak capacity, sequence coverage, retention times of three peptide ions and column pressure using the tryptic digest of a bovine serum albumin (BSA) and detected by LC-MS in electrospray ionization (ESI) mode. The experimental results showed that the six capillary chromatographic columns packed at the same time had close column efficiencies, however, the column efficiencies of twelve capillary chromatographic columns packed at two times were significantly different. In addition, there was no significant column efficiency difference when packing one or six capillary chromatographic columns at the same time. The multiple-channel apparatus designed by us is simple, time-saving, and can be applied to pack capillary chromatographic columns with similar column efficiencies, thus it is of evident advantage over traditional one-channel apparatus.
capillary liquid chromatography-mass spectrometry (CLC-MS); capillary chromatographic column; packing column apparatus; multiple-channel
10.3724/SP.J.1123.2015.06021
国家重大科学计划项目(2012CB910603);国家高技术研究发展规划项目(2012AA020202);国家重大科学仪器设备开发专项项目(2012YQ12004407,2011YQ030139,2011YQ06008408,2013YQ14040506);国家自然科学基金项目(21275519,20735005,31100591).
2015-06-16
O658
:A
:1000-8713(2015)11-1155-08
*通讯联系人.Tel:(010)80727777-1142,E-mail:13683167093@163.com.