QuEChERS-超高效液相色谱-高分辨串联质谱技术检测鸡肉中6种抗球虫药物
木合他拜尔, 严 华, 徐 姗, 冯 楠, 郝 杰, 朱尘琪, 郭 爽, 张朝晖, 韩南银*
(1. 北京大学药学院, 北京 100191; 2. 北京出入境检验检疫局检验检疫技术中心, 北京 100026; 3. 北京市食品安全监控和风险评估中心, 北京 100041)
技术与应用
QuEChERS-超高效液相色谱-高分辨串联质谱技术检测鸡肉中6种抗球虫药物
木合他拜尔1, 严 华2, 徐 姗2, 冯 楠3, 郝 杰3, 朱尘琪1, 郭 爽1, 张朝晖2, 韩南银1*
(1. 北京大学药学院, 北京 100191; 2. 北京出入境检验检疫局检验检疫技术中心, 北京 100026; 3. 北京市食品安全监控和风险评估中心, 北京 100041)
建立了鸡肉中二硝托胺、尼卡巴嗪、地克珠利、妥曲珠利、莫能菌素及盐霉素6种抗球虫药物的超高效液相色谱-高分辨串联质谱多残留检测方法。经QuEChERS样品净化,首先使用含有1%(v/v)三氯乙酸的乙腈-水(3∶7, v/v)溶液提取样品中的被测物,再加入氯化钠,使用50 mg/mLN-丙基乙二胺(PSA)+50 mg/mL中性氧化铝(Alumina-N)的混合分散固相萃取(dispersive solid phase extraction, DSPE)粉末净化提取,过0.22 μm滤膜后以超高效液相色谱-高分辨串联质谱检测。选择Waters Acquity UPLC®BEH C8色谱柱(100 mm×2.1 mm, 1.7 μm),以甲醇-5 mmol/L醋酸铵水溶液为流动相进行梯度洗脱。使用正、负离子同时扫描模式,基质外标法定量。研究表明,6种目标化合物的线性范围为:二硝托胺,1.0~30.0 μg/L;尼卡巴嗪,0.2~6.0 μg/L;地克珠利、妥曲珠利,2.0~60.0 μg/L;莫能菌素、盐霉素,4.0~120.0 μg/L。空白样品中添加低、中、高3个水平的混合标准溶液,回收率在67.7%~126.8%之间,相对标准偏差(RSD)≤10.4%。6种抗球虫药物的定量限分别为:二硝托胺,2.50 μg/kg;尼卡巴嗪,0.50 μg/kg;地克珠利、妥曲珠利,5.00 μg/kg;莫能菌素、盐霉素,20.00 μg/kg。该方法操作简便,灵敏度高,且能够满足日常检测要求。
QuEChERS;超高效液相色谱-高分辨串联质谱;抗球虫药;鸡肉
球虫病是一种由艾美球虫属原球虫所致[1],可对禽类肠道造成损害的寄生虫疾病。感染球虫后将会严重影响禽类的肉蛋产出,严重者可导致大量禽类死亡,给农民带来严重损失。据估算,感染临床和亚临床球虫病的禽类分别占到全球禽类总数的5%和20%[2]。每年禽类养殖业因艾美球虫属感染而造成的损失高达24亿美元,其中24%为相关药物花费[3]。在我国,每年由于球虫感染而给养殖者带来的损失接近7亿人民币[4]。自20世纪40年代发现磺胺类药物具有抗球虫作用以来,先后应用于鸡球虫病防治的药物约有50种。然而,抗球虫药物的使用极易产生耐药性[5,6],加之药物的功效与药物毒性[7]等多方面影响,多数药物已经退出市场。合理的使用抗球虫药物,在对抗球虫感染方面发挥着重要的作用。现在养禽业仍在使用的抗球虫药可以分为以下两类:(1)通过作用于寄主的代谢过程而发挥作用的具有固定化学结构的化学药物,如二硝托胺、地克珠利、妥曲珠利和尼卡巴嗪等;(2)以干扰离子传输和渗透平衡为基本作用机制的聚醚类离子载体药物,如莫能菌素和盐霉素等[6]。
现有的抗球虫药物检测标准方法多为单一化合物的检测,涉及比色法、薄层法、免疫分析法、液相色谱法[8,9]、液相色谱-质谱法[10,11]等多种检测手段,而其中所使用的样品前处理方法复杂,操作步骤繁琐,致使其总体检测效率低下。与此同时,聚醚类离子载体抗生素类抗球虫药物缺乏紫外、荧光特性,在检测前需要对其进行衍生操作,使得检测方法更加繁琐。另一方面,由于抗球虫药物易产生耐药性,在实际禽类养殖过程中为达到理想的使用效果往往使用联合用药的给药方式[12],造成禽类产品中多种药物同时残留。因此,建立一种快速、简便的前处理方法实现多种抗球虫药物的同时检测,具有十分重要的意义。
QuEChERS方法是一种快速便捷的前处理方法,由Anastassiades等[13]在2003年首次提出。该方法由提取和净化两个主要步骤组成,主要用于果蔬中农药的检测。在Anastassiades等的基础上,QuEChERS方法不断发展,建立了应用于农药残留检测的官方方法AOAC 2007.01[14]和欧盟CEN 2002/657/EC[15],在兽药检测、生化检测以及环境检测等多个领域也得到应用[16-19]。严华等[20]在对鸡肉组织中5种糖皮质激素进行残留检测时,使用了优化后的QuEChERS方法作为前处理手段,取得了较好的实验结果。
本研究中,采用QuEChERS方法进行前处理,超高效液相色谱-四极杆-静电场轨道阱高分辨质谱联用(UPLC-Q Exactive)技术,同时对禽类基质中二硝托胺、尼卡巴嗪(残留标志物为4,4-二硝基均二苯脲(4,4′-dinitrocarbanilide))、地克珠利、妥曲珠利、莫能菌素以及盐霉素这6种抗球虫药物(化学结构式见图1)进行残留检测。该方法不仅快速、简便、灵敏,且满足鸡肉中抗球虫药物检测的限量要求[21]。
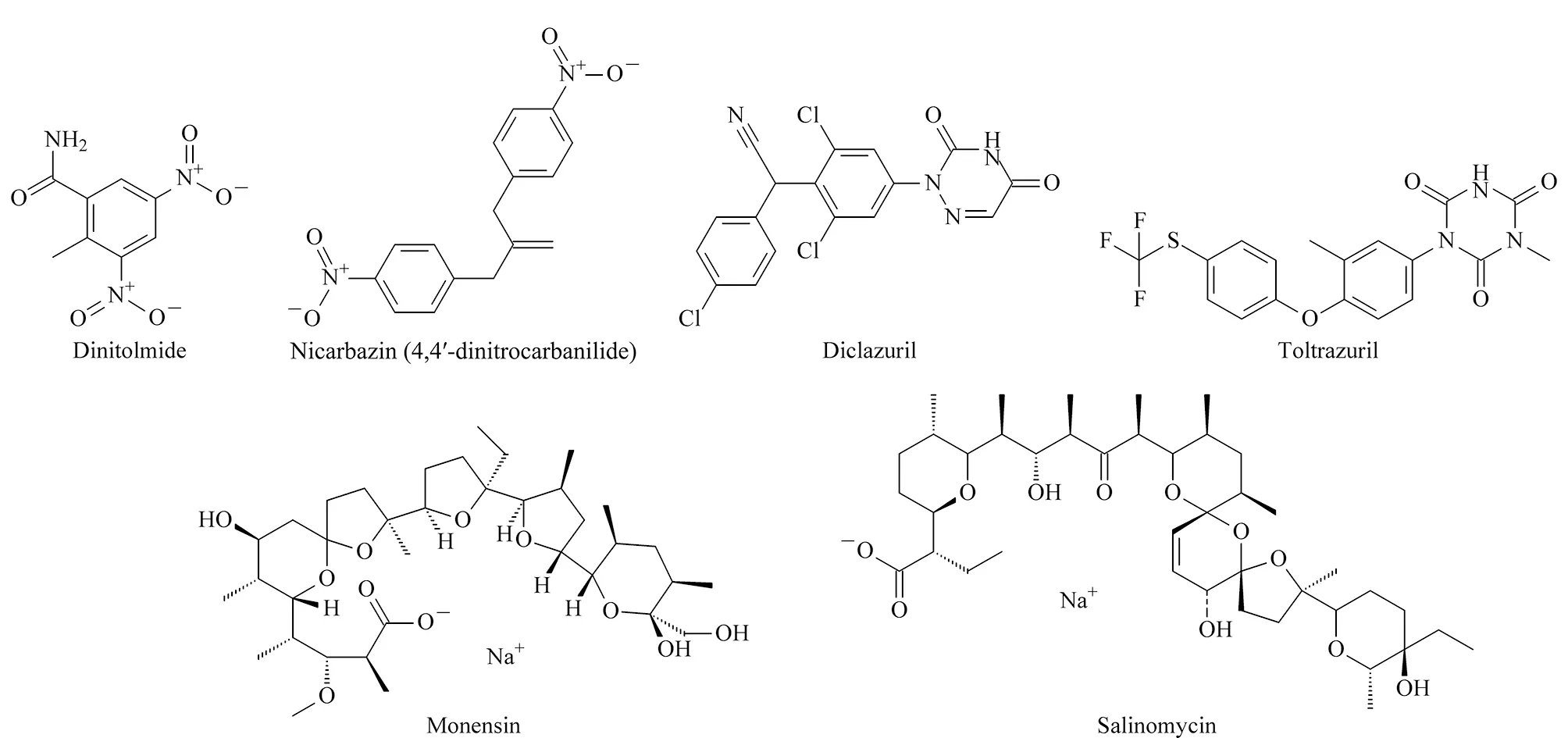
图1 6种抗球虫药物的化学结构式Fig.1 Chemical structures of the six anticoccidials
1 实验部分
1.1 仪器与试剂
Ultimate 3000液相色谱仪,美国Thermo Fisher公司;Q-Exactive高分辨质谱仪,配电喷雾离子(ESI)源,美国Thermo Fisher公司;GM200刀式研磨仪,德国Retsch公司;IKA MS3 basic圆周振荡器,德国IKA公司;Sigma 3-18KS冷冻离心机器,德国Sigma公司;Elix/RiOs纯水系统,美国Millipore公司。
二硝托胺(dinitolmide, CAS No. 148-01-6)、尼卡巴嗪(nicarbazin,为4,4-二硝基均二苯脲与2-羟基-4,6-二甲基嘧啶的复合物,CAS No. 330-95-0)、地克珠利(diclazuril, CAS No. 101831-37-2)、妥曲珠利(toltrazuil, CAS No. 69004-03-1)、莫能菌素(monensin, CAS No. 22373-78-0)和盐霉菌素(salinomycin, CAS No. 55721-31-8),德国Dr. Ehrenstorfer公司;乙腈、甲醇、乙酸乙酯(分析纯),冰醋酸、醋酸铵(色谱级),美国Thermo Fisher公司;冰醋酸;三氯乙酸;甲酸;Cleanert PSA/C18/NH2/Alumina-N/GBC/Florisil填料,天津博纳艾杰尔科技有限公司;无水硫酸钠、无水硫酸镁、氯化钠,北京化学试剂公司。
1.2 标准溶液的配制
标准储备液:准确称取6种标准品,分别用甲醇溶解,配制质量浓度为10 g/L的标准储备液,在4 ℃冰箱内保存,需要时配制成不同浓度标准工作液。
混合储备液:取上述标准储备液用甲醇配制成质量浓度为1 g/L的混合标准储备液,在4 ℃冰箱内保存。
1.3 提取液的制备
准确称量70 mL乙腈,加入30 mL水制得乙腈-水(7∶3, v/v)溶液,加入1.00 g三氯乙酸,超声10 min,得到含1%三氯乙酸的乙腈-水(7∶3, v/v)溶液。
1.4 样品的制备
称取样品5.00 g置于50 mL具塞离心管中,加入提取液10 mL,涡旋振荡20 s后超声20 min,加入4 g NaCl,涡旋振荡30 s, -10 ℃条件下以8 000 r/min离心10 min,取上清液1 mL于含有50 mg PSA+50 mg Alumina-N的Eppendorf管中净化,涡旋振荡30 s,以12 000 r/min离心5 min,取上清液过0.22 μm滤膜后进行UPLC-Q Exactive分析。
1.5 UPLC-Q Exactive质谱条件
1.5.1UPLC条件
色谱柱:Waters Acquity UPLC®BEH C8色谱柱(100 mm×2.1 mm, 1.7 μm)。流动相:A为5 mmol/L醋酸铵,B为甲醇。梯度程序:0.0~1.0 min, 95%A; 1.0~6.0 min, 95%A~2%A; 6.0~10.0 min, 2%A; 10.0~10.1 min, 2%A~95%A; 10.1~11.0 min, 95%A。流速:0.25 mL/min;柱温:40 ℃;进样量:10 μL。
1.5.2Q-Exactive高分辨质谱条件
离子源:ESI;扫描方式:正、负离子同时扫描;采集方式:目标选择性离子扫描(target-SIM);离子源温度:350 ℃;毛细管温度:320 ℃;毛细管电压:正离子模式下为3.5 kV,负离子模式下为2.8 kV;鞘气气流:4.6 L/min;各化合物信息见表1。
2 结果与讨论
2.1 色谱条件的选择
本研究最初使用Waters Acquity UPLC®BEH C18柱(100 mm×2.1 mm, 1.7 μm)作为分离柱,但尼卡巴嗪残留较为严重。改用Waters Acquity UPLC®BEH C8柱(100 mm×2.1 mm, 1.7 μm)分离后,残留现象得到有效的改善。优化色谱流动相时,首先比较了甲醇-水体系与乙腈-水体系的分离效果。结果表明,当使用乙腈-水体系时,化合物峰杂乱,出现拖尾峰,故选择甲醇-水体系作为流动相。

表1 6种抗球虫药物的质谱信息及保留时间
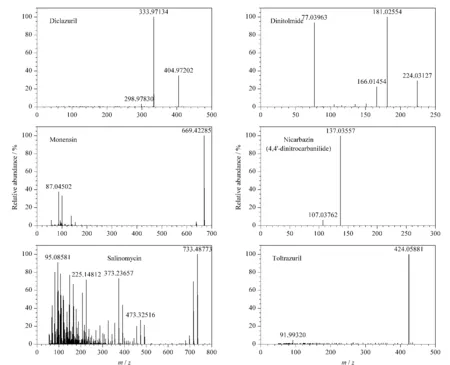
图2 6种抗球虫药物的质谱图Fig.2 Mass spectra of the six anticoccidials
由于采用正、负离子同时扫描的质谱方法,为避免影响负离子扫描模式下的离子化效果,流动相为不含酸体系。为进一步改善峰形,使用5 mmol/L醋酸铵替代纯水。
2.2 质谱条件的选择
在6种化合物中,二硝托胺、尼卡巴嗪、地克珠利和妥曲珠利在负离子扫描模式下有响应,莫能菌素和盐霉素在正、负离子扫描模式下均有响应,其中莫能菌素在负离子扫描模式下的响应更高,盐霉素在正离子扫描模式下的响应值更高,故采用实时正、负切换检测模式进行质谱扫描。通过精确质量数筛查出各目标化合物的母离子后,使用自动触发二级质谱对化合物进行定性确证,采用Step NCE方法,分别设置20、40、60 eV的碰撞能量,得到对应目标化合物的碎片信息,并选取了丰度较高的碎片离子作为第二定性离子(见表1)。如图2所示,使用40 eV的碰撞能量对6种化合物进行裂解,得到化合物子离子信息。其中,妥曲珠利未找到特征子离子,采用三重四极杆串联质谱检测时,由母离子→母离子定量,背景较高,且灵敏度降低。本文中使用高分辨率质谱,提高了对妥曲珠利这类无特征子离子的化合物的选择性,避免了灵敏度的大幅降低,同样采用外标法母离子定量。
2.3 前处理方法优化
2.3.1提取溶剂的选择
分别考察了乙腈-水(3∶7, v/v)、含1%醋酸的乙腈-水(3∶7, v/v)、甲醇-水(3∶7, v/v)、含1%醋酸的甲醇-水(3∶7, v/v)溶液的提取效果。在提取步骤中,甲醇与水相在加入盐后仍难以分层,成混浊状,故放弃使用甲醇。对比乙腈与含1%醋酸的乙腈-水(3∶7, v/v)的提取效果,发现使用含1%醋酸的乙腈-水(3∶7, v/v)时化合物整体表现出更高的回收率。为了增加蛋白结合率高的莫能菌素和盐霉素的回收率,对比了含1%醋酸的乙腈-水(3∶7, v/v)、含1%甲酸的乙腈-水(3∶7, v/v)和含1%三氯乙酸的乙腈-水(3∶7, v/v)溶液的提取效果,发现在使用含1%三氯乙酸的乙腈-水(3∶7, v/v)溶液时,目标化合物的回收率均有较大程度的提升,因此选择含1%三氯乙酸的乙腈-水(3∶7, v/v)溶液作为提取溶剂。
2.3.2净化剂的选择
PSA、C18以及Alumina-N(中性氧化铝)是QuEChERS方法中常用的分散固相净化剂(DSPE)。本文考察了这3类净化剂经不同组合后的净化效果,回收率如图3所示,RSD≤13.80%(n=6)。在分别考察了10组不同的DSPE方案后发现,C18吸附性过强,在吸附杂质的同时也吸附了目标化合物,从而造成目标化合物的回收率大大降低;而采用50 m/L PSA+50 g/L Alumina-N(见图3中第5组)时,基质干扰降低,保证了6个目标化合物均有较高的回收率。

图3 不同DSPE组合下6种球虫药物的回收率Fig.3 Recoveries of the six anticoccidials with different DSPE combination groups Group 1: no DSPE; Group 2: 50 mg C18; Group 3: 50 mg PSA; Group 4: 50 mg Alumina-N; Group 5: 50 mg PSA+50 mg Alumina-N; Group 6: 25 mg C18+25 mg Alumina-N; Group 7: 25 mg C18+25 mg Alumina-N+50 mg Alumina-N; Group 8: 25 mg C18+50 mg PSA; Group 9: 50 mg C18+25 mg Alumina-N; Group 10: 50 mg C18+25 mg PSA; Group 11: 50 mg C18+50 mg PSA+25 mg Alumina-N.

表2 6种球虫药物的线性范围、线性方程、相关系数及定量限
y: peak area;x: mass concentration, μg/L.
2.4 线性关系与定量限
配制不同浓度的混合基质加标工作液,在优化后的实验条件下进行测定,通过对相应化合物在质谱中的响应面积(y)与目标化合物的标记浓度值(x/(μg/L))进行线性拟合,得到6种目标化合物的线性范围及其相应的线性相关系数(R)。本研究中,各化合物的R值均不小于0.998。由于高分辨率质谱仪基线极低,信噪比值不再适用于确定定量限,故本方法中定量限为化合物线性范围中满足回收率值在60%~120%区间内的最低浓度(见表2)。
2.5 方法的精密度与回收率
在空白样品中分别添加低、中、高3个水平的混合标准溶液,在优化的实验条件下目标化合物的回收率在67.7%~126.8%之间,RSD≤10.4%(n=6)(见表3),可满足实际分析的要求。

表3 空白基质中3个添加水平下6种抗球虫药物的回收率及相对标准偏差(n=6)
2.6 实际样品
采用本方法对市场上随机抽取的7份鸡肉样品中的6种抗球虫药物进行检测,未发现阳性样品。
3 结论
为顺应兽药残留检测快速、简便、准确以及高通量的发展趋势[22],本研究将高分辨质谱仪与快速前处理方法相结合,建立了一种用于鸡肉基质中6种抗球虫药物的检测方法。使用UPLC-Q Exactive高分辨质谱仪,通过实时正、负离子切换的模式实现了6种目标化合物的同时检测。同时,通过改进QuEChERS方法建立了鸡肉中6种分析物的快速净化方法。该方法操作简便,灵敏度高,可满足日常检测要求。
[1] Liu X Y, Suo X. Journal of Agricultural Science and Tech-nology (刘贤勇, 索勋. 中国农业科技导报), 2006, 8(5): 31
[2] Zhang J J, Wang L X, Ruan K W, et al. Vet Parasitol, 2013, 191(1): 29
[3] Shirley M W, Smith A L, Tomley F M. Adv Parasit, 2005, 60: 285
[4] Suo X, Cai J P. Poultry Coccidiosis. Beijing: China Agricultural Press (索勋, 蔡建平. 禽球虫病. 北京: 中国农业出版社), 2004
[5] Abbas R Z, Iqbal Z, Blake D, et al. World Poultry Science, 2011, 67(2): 337
[6] Allen P C, Fetterer R H. Clin Microbiol Rev, 2002, 15(1): 58
[7] Zhang Z M, Zeng M H. Chinese Journal of Veterinary Parasitology (张祝明, 曾明华. 中国兽医寄生虫病), 2005, 2(13), 29
[8] GB 29701-2013
[9] SN 0698-1997
[10] SN/T 2318-2009
[11] SN/T 2453-2010
[12] Nie K, Yan Y, Gao J W, et al. Chinese Journal of Veterinary Parasitology (聂奎, 颜焰, 高俊伟, 等. 中国兽医寄生虫病), 2006, 14(1): 124
[13] Anastassiades M, Lehotay S J, Stajinbaher D, et al. J AOAC Int, 2003, 86(2): 412
[14] Lehotay S J. J AOAC Int, 2007, 2(90): 485
[15] CEN Standard Reference EN 15662: 2008. [2008-11-12]. http://www.cen.eu
[16] Usui K, Hayashizaki Y, Minagawa T, et al. Leg Med, 2012, 14(6): 309
[17] Zhu C Y, Wei J, Dong X F, et al. Chinese Journal of Chromatography (朱程云, 魏杰, 董雪芳, 等. 色谱), 2014, 32(4): 419
[18] Hu W Y, Xu L, Yang J, et al. Chinese Journal of Chromatography (胡文彦, 许磊, 杨军, 等. 色谱), 2014, 32(2): 133
[19] Bragança I, Plácido A, Paíga P, et al. Sci Total Environ, 2012: 433: 281
[20] Yan H, Yun H, Liu X, et al. Journal of Instrumental Analysis (严华, 云环, 刘鑫, 等. 分析测试学报), 2013, 32(8): 909
[21] Ministry of Agriculture. No. 235 Bulletin of the Ministry of Agriculture of the People’s Republic of China (农业部. 中华人民共和国农业部公告第235号). (2002-12-24) [2008-06-29]. http://www.moa.gov.cn/zwllm/nybz/200803/t20080304_1028649.htm
[22] Kinsella B, O’Mahony J, Malone E, et al. J Chromatogr A, 2009, 1216(46): 7977
Determination of six anticoccidials in chicken using QuEChERS combined with ultra high liquid chromatography-high resolution mass spectrometry
MUHAREM Muhteber1, YAN Hua2, XU Shan2, FENG Nan3, HAO Jie3, ZHU Chenqi1, GUO Shuang1, ZHANG Zhaohui2, HAN Nanyin1*
(1.SchoolofPharmaceuticalScience,PekingUniversity,Beijing100191,China; 2.InspectionandQuarantineTestingCenter,BeijingEntry-ExitInspectionandQuarantineBureau,Beijing100026,China; 3.BeijingMunicipalCenterforFoodSafetyMonitoringandRiskAssessment,Beijing100041,China)
An ultra high liquid chromatography-Q Exactive orbitrap mass spectrometry multi-residue method has been developed for the determination of six anticoccidials residues (dinitlmide, nicarbazin, diclazuril, toltrazuril, monensin and salinomycin) in chicken tissue. Sample preparation was based on QuEChERS method, using 1% (v/v) trichloroacetic acid/acetonitrile aqueous solution (3∶7, v/v) as the extraction solvent and salting-out with sodium chloride followed by clean-up with 50 mg/mL primary secondary amine (PSA)+50 mg/mL neutral alumina (Alumina-N) dispersive solid phase extraction (DSPE). The separation of the compounds in liquid chromatography was carried out using a Waters Acquity UPLC®BEH C8 column (100 mm×2.1 mm, 1.7 μm) with mobile phases consisting of methanol-5 mmol/L ammonium acetate aqueous solution in gradient elution. The Q Exactive orbitrap mass spectrometric detection was carried out with positive and negative electrospray ionization simultaneously. The results showed the linear ranges of the six target compounds were as follows: dinitolmide, 1.0-30.0 μg/L; nicarbazin, 0.2-6.0 μg/L; diclazuril and toltrazuril, 2.0-60.0 μg/L; monensin and salinomycin, 4.0-120.0 μg/L. The external standard method was used for quantification. The spiked recoveries at three levels for the six anticoccidials ranged from 67.7% to 126.8%. The relative standard deviations (RSDs) were ≤10.4%. The limits of quantification (LOQs) were as follows: dinitolmide, 2.50 μg/kg; nicarbazin, 0.50 μg/kg; diclazuril and toltrazuril, 5.00 μg/kg; monensin and salinomycin, 20.00 μg/kg. The developed method is easy of operation and of high sensitivity. It can meet the requirements of daily inspection.
QuEChERS; ultra high liquid chromatography-high resolution mass spectrometry; anticoccidials; chicken
10.3724/SP.J.1123.2015.06016
北京市科委重大项目(D151100003815002).
2015-06-10
O658
:A
:1000-8713(2015)11-1199-06
*通讯联系人.Tel:(010)82805957,E-mail:nanyin.han@pku.edu.cn.