新疆酸奶中高产蛋白酶与产脂肪酶乳酸菌的筛选
何 捷,曾小群,*,吕鸣春,毛仲瑄,王象林,潘道东
新疆酸奶中高产蛋白酶与产脂肪酶乳酸菌的筛选
何 捷1,曾小群1,*,吕鸣春1,毛仲瑄1,王象林2,潘道东1
(1.宁波大学海洋学院,浙江 宁波 315211;2.宁波大学信息科学与工程学院,浙江 宁波 315211)
从新疆传统酸奶中,利用透明圈法筛选出一株高产蛋白酶的乳酸菌RA3,其蛋白酶活力为38.87 U/mL;利用铜皂法筛选出产脂肪酶的乳酸菌菌株RC4,其酶活力为8.54 U/mL。经API 50CHL生理生化实验和16S rRNA序列比对鉴定RA3为发酵乳杆菌,RC4为植物乳杆菌,为我国发酵食品提供了新的乳酸菌资源。
乳酸菌;筛选;蛋白酶;脂肪酶
乳酸菌是一种具有营养作用、食疗功效、医疗保健功能和安全性的益生菌。乳酸菌的蛋白酶可以分解蛋白质分子产生多肽、氨基酸,提高胃蛋白酶的活性,促进损伤的肠黏膜上皮修复等[1]。乳酸菌蛋白酶活性作为影响乳酸菌益生作用的重要因素,是筛选性质优良、稳定性强的工业生产菌株的主要指标[2]。脂肪酶是一类能够催化酯的水解反应以及在非水相体系中催化脂肪酸和醇类发生酯化反应的酶类。脂肪酶在焙烤食品中可作为绿色生物改良剂;在油脂工业上可促油脂水解、促酯交换和促酯化;在乳品工业中可用于乳酯水解,在食品添加剂中应用可增香改质、提高食品品质[3]。可见,筛选产蛋白酶、产脂肪酶的乳酸菌具有重要的意义。陈超等[4]曾从21A株菌种筛选出一株产蛋白酶活力较高的乳酸乳球菌乳酸亚种并添加到奶牛精饲料中,极显著地提高了牛乳产量、乳脂率、干物质率;黄紫燕等[5]从鱼露发酵液中筛选到一株高产蛋白酶的芽孢杆菌T1。但目前我国产蛋白酶乳酸菌的蛋白酶活性和物种多样性有待增加,产脂肪酶活性的乳酸菌尚鲜有报道。
我国新疆地区环境独特,少数名族牧民采用传统的方法制备酸奶等乳制品,在这些传统发酵食品中,蕴藏着大量的有益乳酸菌,从新疆传统酸奶中筛选出高产蛋白酶和高产脂肪酶的乳酸菌,应用于发酵食品中,可以提高原料的酶解能力,产生许多风味物质的前体物质——游离氨基酸和脂肪酸,进而改善制品的风味,增加产品的功能特性。
本研究分别采用Folin-酚法和铜皂法从新疆传统酸奶中分离高产蛋白酶和脂肪酶的菌株应用与发酵食品,以开发和利用保护我国丰富的乳酸菌资源,为发酵食品业行业提供优良的菌株来源。
1 材料与方法
1.1 菌种、培养基与试剂
1.1.1菌种
菌种:来源于新疆地区牧民家自制传统的发酵酸驼奶、酸牛奶、酸马奶、酸羊奶中分离得出的40株乳酸菌,其中菌株SM7、H1、H2、H3、H4、A1、A3、RA1、RA2、RA3、RA4、RA5、RB1、RB2、RB3、RB4、RB5、RB6、RC1、RC2、RC3、RC4、RC5来源于新疆酸马奶[6]:S1、S2、S3来源于新疆酸羊奶;C1、C4来源于新疆酸骆驼奶;B1、B3、B5、B6新疆酸牛奶;SC1、SC2来源于市售泡菜;F1来源于南京卫岗牛奶厂新鲜牛粪;L2、L3、L5来源未知;1003、Q12来源于市售酸奶,均保存于宁波大学海洋学院实验室中。
1.1.2培养基
产蛋白酶菌株的初筛培养基为酪蛋白液体培养基:酪蛋白10 g、牛肉膏2 g、Na2HPO42 g、NaCl 5 g,蒸馏水1 000 mL。酪蛋白固体培养基在酪蛋白液体培养基相同配制上加琼脂15 g。产脂肪酶乳酸菌的初筛培养基:每升含0.5 g (NH4)2SO4、0.1 g NH4NO3、0.1 g NaCl、0.1 g MgSO4·7H2O、0.5 g K2HPO4、0.1 g FeSO4·7H2O、25 g琼脂,121℃灭菌20 min后,冷却至60℃左右加入含0.2%溴甲酚紫的聚乙烯醇橄榄油乳化液12 mL。用0.1 mol/L NaOH调pH 8.0;复筛培养基为不加琼脂的初筛培养基。
1.1.3试剂
MRS肉汤、MRS固体培养基 上海源叶生物科技有限公司;细菌基因组提取试剂盒 日本TaKaRa公司;溴甲酚紫、甲苯、油酸、吡啶、橄榄油、考马斯亮蓝G-250、Tris、醋酸、琼脂糖、Folin-酚试剂均为国产分析纯。
1.2仪器与设备
TGL-16高速离心机 江苏精达仪器制造有限公司;LDZX-50FAS立式压力蒸汽灭菌器、DNP-9082恒温培养箱 上海精宏实验设备有限公司;SP-722可见分光光度计 上海元析仪器有限公司;PHS-3C型精密pH计杭州普川科技有限公司;GelDoc-It 310 Imaging System凝胶成像系统 美国UVP公司;TY10BG-verMINI电泳仪、Mini-PROTEAN 2-D电泳槽、Ecycler plus PCR仪美国Bio-Rad公司。
1.3方法
1.3.1产蛋白酶乳酸菌的筛选
采用平板划线法将40株乳酸菌活化3代后,分离在固体酪蛋白培养基上,培养24 h后,观察有无透明圈以及透明圈的大小,筛选出10株产生透明圈较大的菌株进行复筛[7]。
将初筛得到的10株菌,在MRS液体培养基中进行增殖培养(37℃),将培养液6 000 r/min离心取上清离心后的上清液用pH值为6.8的磷酸盐缓冲液稀释50倍。利用Folin-酚法[8]测定筛选出的乳酸菌的蛋白酶活力取1 mL稀释液于试管,置于40℃条件下水浴2 min,再加经相同预热条件处理的酪蛋白1 mL,精确保温10 min后加入0.4 mol/L三氯乙酸2 mL终止反应,继续保温20 min,使残余蛋白质沉淀后过滤。另取试管加入滤液1 mL,0.4 mol/L的碳酸钠5 mL,已稀释Folin-酚试剂1 mL,摇匀,保温发色20 min;空白实验测定方法同上,只是在加酪蛋白前加0.4 mol/L三氯乙酸2 mL,使酶失活,再加酪蛋白,在660 nm波长处测吸光度(A600nm)。酪蛋白质量分数梯度为0、20、40、60、80、100 ☒g/mg,方法同上所述酶活力的测定,用吸光度与酪蛋白的质量分数作图,即为蛋白酶的标准曲线。
酶活力定义:在最适条件(25℃)下,每分钟内催化1 ☒mol底物转化为产物所需的酶量定为一个活力单位(U)。

式中:K为吸光常数;V为反应试剂的总体积/mL;t为酶解反应时间/min;n为酶液稀释总倍数。
1.3.2产脂肪酶乳酸菌的筛选
利用平板划线法将40株乳酸菌活化3代后,分离到产脂肪酶乳酸菌的初筛培养基上,在凝胶成像系统的紫外光下筛选出10株荧光圈较大的菌株用于复筛[9]。
无菌条件下将初筛得到的菌株接种于复筛培养基中,37℃振荡培养48 h。发酵液6 000 r/min离心,上清液即为粗酶液。利用铜皂法[10]测定粗酶液酶活力。取3 mL磷酸盐缓冲液(0.05 mol/L,pH 7.0)和1 mL橄榄油混合预热5 min,加1 mL发酵液,于35℃、200 r/min水浴摇床中反应10 min,立即加入8 mL苯,萃取、静置分层后,将溶液转至离心管中,于4 000 r/min离心10 min。取上层有机相4 mL,加1 mL显色剂,充分混合,静置,离心,取上清液,以相同方法制备不含脂肪酶的空白溶液为对照,于710 nm波长处测吸光度。根据脂肪酸吸光度工作曲线,计算各菌株脂肪酶活性,获得产酶能力较高的菌株并保存。标准曲线绘制分别用0、1、2、3、4、的油酸溶液,方法同上所述酶活力的测定,用吸光度与油酸的浓度作图,即为脂肪酸的标准曲线。脂肪酶活力的计算见下式。

式中:X为脂肪酶活力/(U/mL);c为脂肪酶浓度/(☒mol/mL);V为脂肪酸溶液的体积/mL;V’为酶液的用量/mL;t为作用时间/min。
1.3.3高效产蛋白酶和脂肪酶乳酸菌的鉴定
1.3.3.1 16S rRNA序列比对鉴定
用细菌基因组提取试剂盒提取所筛选出的高效产蛋白酶和产脂肪酶乳酸菌菌株的基因组DNA,具体操作按说明书进行。
16S rRNA基因序列:聚合酶链式反应(polymerase chain reaction,PCR)扩增正向引物为K1:5’-AACT GAAGAGTTTGATCCTG-GCTC-3’;反向引物为K2:5’-TACGGTTACCTTGT-TACGACTT-3’。PCR反应体系:dNTP 4 ☒L,引物各1 ☒L,MgCl24 ☒L,Taq酶0.5 ☒L,模板DNA 2 ☒L,用ddH2O补至50 ☒L。PCR扩增条件:94℃预变性5 min;94℃变性1 min,56℃退火45 s,72℃延伸2 min,30个循环;72℃延伸10 min。将PCR扩增产物送往上海英骏生物技术有限公司进行DNA测序。将测序结果在NCBI BLAST上进行DNA序列比对,根据相似性鉴定菌种[11]。
1.3.3.2生理生化鉴定
乳酸菌生理生化鉴定:对革兰氏阳性、接触酶阴性的菌株做硝酸盐还原实验、H2S产生实验、明胶液化实验、吲哚实验,结果均为阴性的杆菌被鉴定为乳杆菌属。将分离到的乳杆菌做糖发酵实验(葡萄糖、麦芽糖、乳糖、蔗糖、果糖、半乳糖、纤维二糖、海藻糖、木糖、阿拉伯糖、鼠李糖、水杨苷、甘露醇、棉子糖、七叶苷、苦杏仁苷、松三糖)。
2 结果与分析
2.1产蛋白酶乳酸菌的筛选结果
从40株菌中筛选得到透明圈直径较大的10株菌为:A5、S2、1003、RC1、RA3、H3、SM7、B2、C4、RA6。10株乳酸菌的蛋白酶活力见图1。根据所得的酪蛋白标准曲线回归方程为:y=0.005 5x+0.345 8(R2=0.988 1),得出RA3的蛋白酶活力最高,达38.87 U/mL;其次为RC4,为33.58 U/mL;最低的菌株是H3,其蛋白酶活力为3.86 U/mL。菌株RA3平板在可见光照射下的透明圈见图2。
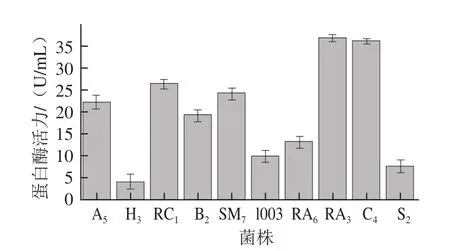
图1 筛选出的10 株乳酸菌的蛋白酶活力Fig.1 Protease activities of 10 strains of lactic acid bacteria

图2 菌株RA3在可见光下的透明圈Fig.2 Transparent circles of strain RA3under visible light irradiation
2.2 产脂肪酶乳酸菌的筛选结果
从40株菌中筛选得到10种荧光圈较大的菌株H1、H2、RC1、RC2、RA3、RA4、RC4、RB2、B6、1003进行复筛。10株乳酸菌酶活力见图3,根据铜皂法得到脂肪酸的吸光度标准曲线方程:y=0.397 2x+0.143 8(R2=0.999 3),测得RC4为脂肪酶活力略高于其他菌种,为8.54 U/mL,筛选出的10株乳酸菌脂肪酶活力均高于4.00 U/mL,其中脂肪酶活力最低的菌株H1,为4.03 U/mL。图4为菌株RC4在紫外光照射下产生的荧光圈。
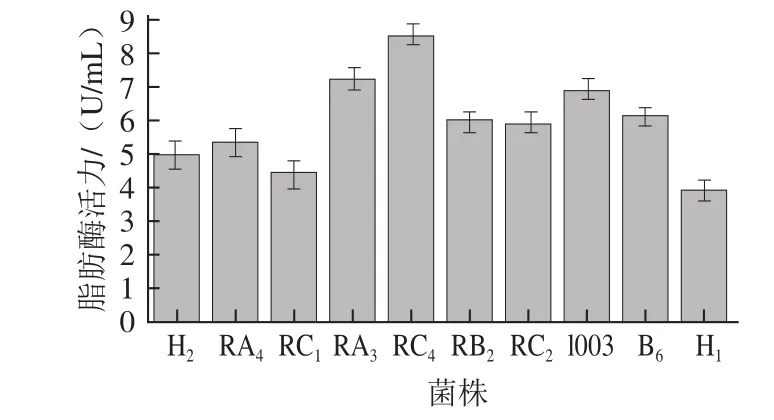
图3 筛选出的10 株乳酸菌的脂肪酶活力Fig.3 Lipase activities of 10 strains of lactic acid bacteria

图4 RC 4 RC4在紫外光下的荧光圈Fig.4 Fluorescent rings of strain RC4under UV light irradiation
2.3菌种鉴定
2.3.1菌株RA3和RC4的16S rRNA序列比对鉴定结果
在NCBI BLAST中进行16S rRNA同源序列比对,结果得出RA3的16S rRNA序列与发酵乳杆菌JCM7776(GenBank登录号为AB911502.1)、M10-5(GenBank登录号为KF030760.1)等菌株相似度为100%,证明RA3发酵乳杆菌;RC4与植物乳杆菌NM178-5(GenBank登录号为HM218736.1)、NM177-2(GenBank登录号为HM218727.1)等植物乳杆菌相似度为99%,表明RC4为植物乳杆菌。
2.3.2菌株RA3和RC4的生理生化鉴定结果
菌株RA3的生理生化实验结果为(+表示阳性,-表示阴性):葡萄糖(+)、麦芽糖(+)、乳糖(+)、蔗糖(+)、果糖(+)、半乳糖(+)、纤维二糖(+)、海藻糖(+)、木糖(+)、阿拉伯糖(+)、鼠李糖(+)、水杨苷(+)、蜜二糖(+)、甘露醇(-)、山梨醇(+)、棉子糖(+)、七叶苷(-)、苦杏仁苷(-)、松三糖(-)、革兰氏(+)、镜鉴(杆状)、接触酶实验(-)、吲哚实验(-)、硝酸盐还原实验(-)、明胶液化实验(-)、H2S产生实验(-)、15℃生长(-)、45℃生长(+)。根据《乳酸菌分类鉴定及实验方法》[12]、《伯杰细菌鉴定手册》[13],鉴定RA3为发酵乳杆菌,与16S rRNA序列比对结果一致。
菌株RC4的生理生化实验结果为(+表示阳性,-表示阴性):葡萄糖(+)、麦芽糖(+)、乳糖(+)、蔗糖(+)、果糖(+)、半乳糖(+)、纤维二糖(+)、海藻糖(+)、木糖(+)、阿拉伯糖(+)、鼠李糖(+)、水杨苷(+)、蜜二糖(+)、甘露醇(+)、山梨醇(+)、棉子糖(+)、七叶苷(+)、苦杏仁苷(+)、松三糖(+)、革兰氏(+)、镜鉴(杆状)、接触酶实验(-)、吲哚实验(-)、硝酸盐还原实验(-)、明胶液化实验(-)、H2S产生实验(-)、15℃生长(+)、45℃生长(+)。根据《乳酸菌分类鉴定及实验方法》[12]、《伯杰细菌鉴定手册》[13],鉴定RC4为植物乳杆菌,与16S rRNA序列比对结果一致。
3 讨 论
本实验从新疆地区传统的发酵酸奶中筛选出高产蛋白酶和产脂肪酶的乳酸菌。其中,高产蛋白酶的发酵乳杆菌RA3的蛋白酶活性为38.87 U/mL,高于方芳等[14]报道的耐热蛋白酶乳酸菌酶活力(13.13 U/mL)及陈超[4]筛选出来的乳酸菌蛋白酶活力(28.82 U/mL),表明本实验筛选出来的乳酸菌产蛋白酶的能力较高。筛选出高效产脂肪酶的植物乳杆菌RC4,其酶活力为8.54 U/mL,虽低于穆文侠等[15]在海洋青霉中测得的脂肪酶活力为17.43 U/mL,韩寒冰等[16]在生物柴油脂肪酶产生菌中测得的脂肪酶活力为19.30 U/mL,但目前已报道的脂肪酶产生菌为霉菌等真菌及其他细菌。
微生物蛋白酶在食品工业中的用途越来越广泛。用微生物蛋白酶代替价格较贵的木瓜蛋白酶,可以使肉产生较好的嫰化效果;运用于啤酒制造以节约麦芽用量;在酱油的酿制中添加微生物蛋白酶,能提高产量和质量;应用于制造水解蛋白胨、酵母浸膏、牛肉膏等。细菌性蛋白酶还常用于日化工业,添加到洗衣剂中,以增强去污效果。蛋白酶也可用于环境治理,它可以降低氮排放量,缓解富营养化以及酸化等环保难题,还可以降低氨排放,提高饲料转化率,改善空气质量等好处[17-19]。微生物脂肪酶也广泛应用于乳制品的增香、鱼片脱脂、食用油加工、洗涤剂添加酶、皮革毛皮绢纺脱脂、制药、化工合成、污水处理、工具酶等多种用途[20-21]。乳酸菌是一种益生菌,加入食品中能丰富食品的口味和营养价值。目前国内以乳酸菌饮料为代表的乳酸菌应用产业开始成为投资热点,高产蛋白酶、脂肪酶的乳酸菌有广阔的应用前景。
[1] 宫春波, 谢丽源, 贺睿非. 酸乳中益生菌活性影响因素的研究概况[J].饮料工业, 2002, 5(3)∶ 32-37.
[2] 张光伟, 王宇建, 钱萍, 等. 酸性蛋白酶高产菌选育的研究[J]. 江苏食品与发酵, 2005, 3(3)∶ 8-13.
[3] 刘海洲, 吴小飞, 牛佰慧, 等. 脂肪酶在食品工业中的应用与研究进展[J]. 粮食加工, 2008, 33(5)∶ 55-57.
[4] 陈超. 产蛋白酶乳酸菌种的筛选及应用研究[D]. 哈尔滨∶ 东北农业大学, 2008∶ 25-32.
[5] 黄紫燕, 刘春花, 罗婷婷, 等. 鱼露发酵液中产蛋白酶乳酸菌的筛选及其添加应用[J]. 食品与发酵工业, 2010, 36(11)∶ 88-92.
[6] 魏艳, 曾小群, 潘道东, 等.新疆地区不同酸奶中优势乳酸菌的分离与鉴定[J]. 中国食品学报, 2012, 12(12)∶ 161-165.
[7] 杨天波. 蛋白酶水解酪蛋白透明圈初筛方法的条件探索与应用效应[J]. 河北大学学报∶ 自然科学版, 1982(2)∶ 16-20.
[8] 高英, 俞玉忠. 福林酚法测定脑蛋白水解物溶液中的多肽含量[J].海峡药学, 2004, 16(6)∶ 57-58.
[9] 李军红, 姜绍通, 童洋洋. 产脂肪酶真菌的筛选及产酶条件优化[J].安徽农业科学, 2011, 39(26)∶ 15840-15842.
[10] 江慧芳, 王雅琴, 刘春国. 三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程, 2007, 24(8)∶ 72-73.
[11] 杨霞, 陈陆, 王川庆. 16S rRNA基因序列分析技术在细菌分类中应用的研究进展[J]. 西北农林科技大学学报∶ 自然科学版, 2008, 36(2)∶ 55-58.
[12] 凌代文, 东秀珠. 乳酸细菌分类鉴定及试验方法[M]. 北京∶ 中国轻工业出版社, 1999∶ 84-127.
[13] 布坎南R E, 吉本斯N E. 伯杰细菌鉴定手册[M]. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译. 8版. 北京∶ 科学出版社, 1984∶ 20-83.
[14] 方芳, 冀林立, 张彦斌, 等. 产耐热蛋白酶乳酸菌的筛选、产酶条件及其酶学性质的研究[J]. 食品科学, 2008, 29(10)∶ 357-379.
[15] 穆文侠, 潘仁瑞, 郑敏, 等. 海洋青霉碱性脂肪酶液态发酵和部分酶学性质研究[J]. 食品与发酵工业, 2007, 33(3)∶ 37-40.
[16] 韩寒冰, 李松佳, 沈伟煌, 等. 生物柴油脂肪酶产生菌的筛选及培养条件研究[J]. 茂名学院学报, 2010, 20(1)∶ 12-14.
[17] CORREA A P F, DAROIT D J, COELHO J, et al. Antioxidant, antihypertensive and antimicrobial properties of ovine milk caseinate hydrolyzed with a microbial protease[J]. Journal of the Science of Food and Agriculture, 2011, 91(12)∶ 2247-2254.
[18] GUPTA R, BEG Q, LORENZ P. Bacterial alkaline proteases∶molecular approaches and industrial applications[J]. Applied Microbiology and Biotechnology, 2002, 59(1)∶ 15-32.
[19] UMEZAWA H. Structures and activities of protease inhibitors of microbial origin[J]. Methods in Enzymology, 1976, 45∶ 678-695.
[20] GANDHI N N. Applications of lipase[J]. Journal of the American Oil Chemists’ Society, 1997, 74(6)∶ 621-634.
[21] LARA P V, PARK E Y. Potential application of waste activated bleaching earth on the production of fatty acid alkyl esters using Candida cylindracea lipase in organic solvent system[J]. Enzyme and Microbial Technology, 2004, 34(3)∶ 270-277.
Screening of Lactic Acid Bacteria with High Protease and Lipase Activities from Xinjiang Traditional Yogurt
HE Jie1, ZENG Xiaoqun1,*,LÜMingchun1, MAO Zhongxuan1, WANG Xianglin2, PAN Daodong1
(1. School of Marine Sciences, Ningbo University, Ningbo 315211, China; 2. Faculty of Electrical Engineering and Computer Science, Ningbo University, Ningbo 315211, China)
This study aimed to screen lactic acid bacteria with high protease and lipase activities from the traditional yogurt in Xinjiang Province, China. Lactic acid bacterial strain RA3with protease activity of 38.87 U/mL was screened by transparent circle method, and a lipase producing-lactic acid bacterial strain RC4with lipase activity of 8.54 U/mL was screened by copper soap method. The strains RA3and RC4were identified asLactobacillus fermentumandLactobacillus plantarum, respectively, using API 50 CHL physiological and biochemical kit and 16S rRNA sequence alignment. Both strains can provide new starter cultures for fermented foods.
lactic acid bacteria; screening; protease activity; lipase activity
TS252.42
1002-6630(2015)17-0130-04
10.7506/spkx1002-6630-201517025
2014-12-03
国家自然科学基金青年科学基金项目(41406165);国家星火计划项目(2013GA701018;2014GA701048);
浙江省大学生科技创新活动计划暨新苗人才计划项目(2014R405045)
何捷(1994—),男,本科生,研究方向为农畜产品加工。E-mail:hjx9527@163.com
*通信作者:曾小群(1982—),女,讲师,博士,研究方向为畜产品加工。E-mail:zxqun3447@126.com

