橙皮甙对根方牙本质耐脱矿作用的研究
王丹杨,汪 鹏,马新扬,李 雪,阮建平(西安医学院口腔医学系口腔修复学教研室,西安 700;西安交通大学口腔医院预防科;通讯作者,E-mail:xiaocha830803@63.com)
根面龋一直是老年人口腔的常见病和多发病,随着我国中老年人口激增,根面龋发病率呈现显著上升趋势。由于根方牙体硬组织的结构及成分异于冠方,硬度较牙冠低,抗龋能力变差,同时位置较隐蔽,经常被忽视,因此更容易出现龋损病症。牙体硬组织不含细胞,缺乏自身修复能力,一旦龋洞形成则无法逆转,只能依靠传统治疗原则去腐充填,并发症严重。如何预防根面龋的形成以及早期医疗干预意义尤为重要[1]。橙皮甙(hesperidin,HPN)是一种柑橘属植物的提取物,属生物黄酮类化合物。最新研究表明,橙皮甙可以保护胶原纤维并促进牙体硬组织再矿化[2]。本实验通过观察橙皮甙预处理对根方牙本质耐脱矿能力的影响,以期为研究天然药物防治根面龋提供参考。
1 材料和方法
1.1 主要材料和仪器
橙皮甙(纯度≥98%,西安开来生物工程有限公司);乙酸、氟化钠、氢氧化钠、磷酸二氢钾(均为分析纯)、戊二醛、无水乙醇(西安化学试剂厂);4-羟乙基哌嗪乙磺酸(hydroxyethyl piperazine ethanesulfonic acid,HEPES)(Sigma 公司,美国);磷酸盐缓冲液(Phosphate Buffered Saline,PBS)(武汉博士德生物工程有限公司);抗酸指甲油(OPI公司,美国);8000目金刚石研磨膏(上海新上砂磨料磨具有限公司);OLS4000激光共聚焦显微镜(OLYMPUS,日本);HXD-1000TM数字式维氏显微硬度计(上海泰明光学仪器有限公司);低速金刚石切割机(沈阳科晶自动化设备制造有限公司)。
1.2 实验用试剂及配制
橙皮甙:将纯度≥98%的橙皮甙溶于1 000 mg/L NaOH溶液中,制成橙皮甙浓度为7 000 mg/L的饱和液,然后取适量饱和液,用1 000 mg/L NaOH将其稀释成3 500 mg/L备用。
脱矿液:50 mmol/L乙酸,1.5 mmol/L磷酸二氢钾,pH=5.0[3]。
中性缓冲液:HEPES 20 mmol/L,1.5 mmol/L 磷酸二氢钾,pH=7.0[3]。
NaF溶液的配制:精确称取分析纯NaF,用双蒸水制成浓度为1 000 mg/L的NaF溶液用于实验。
1.3 牙本质块试件制备
从西安交通大学口腔医院口腔颌面外科门诊收集因阻生而新鲜拔除的第三磨牙30颗(患者均知情同意),刮除表面附着的软组织并彻底清洗后,用慢速切割机在流水冷却下切取牙根,沿长轴方向纵切成厚约1.6 mm的牙本质片;刮除牙髓组织后将其制备成4 mm×3 mm×1.6 mm的牙本质块60个。60个牙本质块分别在流水冷却下用600,1 200,2 000,2 500目碳化硅砂纸依次打磨后,再用8 000目金刚石研磨膏将其表面抛光成镜面;然后在每个试件中央预留3 mm×2 mm的开窗区,其余部位均匀涂布抗酸指甲油。
1.4 实验分组及处理
将60个牙本质块经基线显微硬度(SMH1)测试后,按不同预处理液将其随机分为5组:阴性对照组(双蒸水)、溶剂对照组(1 000 mg/L NaOH溶液)、阳性对照组(1 000 mg/L NaF溶液)以及两个实验组(7 000 mg/L及3 500 mg/L橙皮甙溶液)。然后取各组试件按以下步骤进行pH循环:37℃水浴条件下,先用相应的预处理液浸泡10 min;随后再用1 ml脱矿液浸泡1 h,使牙体硬组织脱矿;最后放入1 ml中性缓冲液中处理5 min。pH循环过程中,每一步骤结束后均用双蒸水彻底冲洗1 min,滤纸吸去多余水分。每天循环2次,连续处理7 d;每天均更换1次各组预处理液及中性缓冲液。循环间期所有试件均浸泡于37℃中性缓冲液中。
1.5 显微硬度测试
pH循环处理结束后,从每组中各随机抽取6个试件,用维氏显微硬度计分别测定各试件开窗区表面的显微硬度值(SMH2)。测定条件为:50 g载荷下维持15 s形成压痕;每个试件测5个点(各点相距100 μm),取其平均值作为该试件该次的硬度值。然后计算各组脱矿前后显微硬度的差值:ΔSMH=SMH1-SMH2。
1.6 脱矿体积测试
取各组所余的pH循环结束后的6个试件,去除封闭指甲油后用2.5%戊二醛固定4 h;PBS溶液冲洗15 min×3 次,25,50,75,95,100 mL/L 的乙醇溶液梯度脱水(每种浓度各浸泡20 min);然后在环境温度下,以开窗区边缘为基线,用激光共聚焦显微镜观察各试件的脱矿深度,计算脱矿体积。每个试件开窗区的每条边各选2个点(各点相距300 μm)进行脱矿深度测量,扫描区域均为256 μm2,取平均值作为该试件该次的脱矿深度,脱矿体积=3 000 μm ×2 000 μm ×脱矿深度。
1.7 统计学分析
应用SPSS 18.0统计软件对SMH1、ΔSMH 及脱矿体积±s进行单因素方差分析,两两比较用Student-Newman-Keuls检验,检测水准 α=0.05(双侧)。
2 结果
2.1 脱矿前后各预处理组样本SMH的变化
pH循环处理前,各组牙本质的表面显微硬度(SMH1)差异无统计学意义(P>0.05);分别用相应的预处理液处理后,再用脱矿液处理1 h,各组牙本质的表面显微硬度(SMH2)均较基线硬度值(SMH1)降低,差异有统计学意义(P<0.05),说明脱矿液导致牙本质脱矿;各组显微硬度的降低程度(ΔSMH)以7 000 mg/L HPN预处理组最低,依次为:7 000 mg/L HPN组<1 000 mg/L NaF组<1 000 mg/L NaOH组<3500 mg/L HPN组<双蒸水(阴性对照)组,组间两两相比,7 000 mg/L HPN和1 000 mg/L NaF两组间无统计学差异(P>0.05),但两者分别与其他各组相比差异均有统计学意义(P<0.05),而3 500 mg/L HPN、1 000 mg/L NaOH、双蒸水三组间两两相比差异均无统计学意义(P>0.05,见表1)。
2.2 脱矿后各预处理组脱矿体积比较
不同预处理液处理后的各组牙本质试件经脱矿液处理1 h后,其脱矿体积以1 000 mg/L NaF组最小,依次为:1 000 mg/L NaF组<7 000 mg/L HPN组<3 500 mg/L HPN组<1 000 mg/L NaOH组<双蒸水组;各组间两两相比,7 000 mg/L HPN和1 000 mg/LNaF两组间差异无统计学意义(P>0.05),但两者分别与其他各组相比差异均有统计学意义(P<0.05),而3 500 mg/L HPN、1 000 mg/L NaOH、双蒸水三组间两两相比差异均无显著性意义(P>0.05,见表2)。各组脱矿后表面形貌见图1,扫描面积相同,1 000 mg/L NaF组和7 000 mg/L HPN组的脱矿区域较其他各组表浅。
表1 各处理组pH循环前后SMH比较(n=6,±s)Table 1 Changes of SMH before and after pH cycling in five groups(n=6,±s)
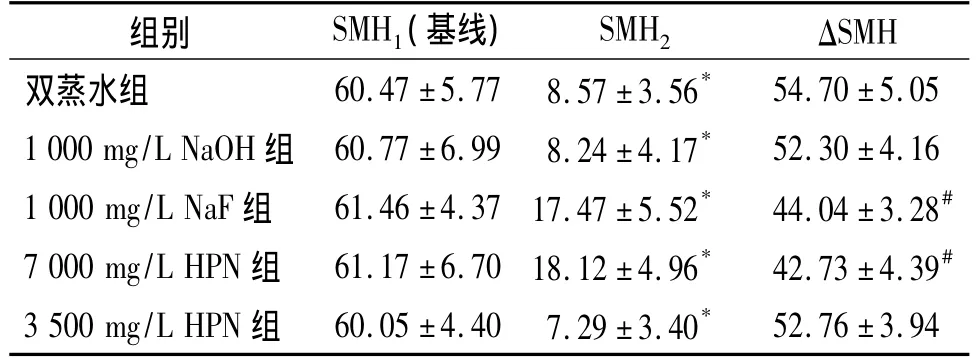
表1 各处理组pH循环前后SMH比较(n=6,±s)Table 1 Changes of SMH before and after pH cycling in five groups(n=6,±s)
与基线SMH1比较,*P <0.05;与双蒸水组、1 000 mg/L NaOH、3 500 mg/L HPN 组 ΔSMH比较,#P<0.05
组别 SMH1(基线) SMH2 ΔSMH双蒸水组 60.47 ±5.77 8.57 ±3.56*52.76 ±3.94 54.70 ±5.05 1 000 mg/L NaOH 组 60.77 ±6.99 8.24 ±4.17* 52.30 ±4.16 1 000 mg/L NaF 组 61.46 ±4.37 17.47 ±5.52* 44.04 ±3.28#7 000 mg/L HPN 组 61.17 ±6.70 18.12 ±4.96* 42.73 ±4.39#3 500 mg/L HPN 组 60.05 ±4.40 7.29 ±3.40*
表2 各处理组脱矿体积比较(n=6,±s)Table 2 Comparison of mineral loss among five groups(n=6,±s)

表2 各处理组脱矿体积比较(n=6,±s)Table 2 Comparison of mineral loss among five groups(n=6,±s)
与其双蒸水组、1 000 mg/L NaOH组、3500 mg/L HPN组比较,*P <0.05
矿体积(μm3)×108±2.834×107×108±0.969 ×107×108±0.315 ×107*×108±0.330 ×107*3 500 mg/L HPN 组 0.978 ×108±1.187 ×107

图1 各组脱矿后表面形貌(激光共聚焦显微镜,×1 000)Figure 1 Surface of root dentin after demineralization under laser scanning confocal microscope(×1000)
3 讨论
根面龋的进展过程包括两个阶段:①附着于根面的菌斑生物膜内特定的细菌(变形链球菌及放线菌)与食物成分相互作用,细菌代谢唾液或食物来源的碳水化合物产生毒力因子,导致菌斑生物膜酸化,这种持续的酸性环境最终引起牙体硬组织脱矿,并导致胶原纤维暴露形成浅碟样损害[4];②宿主来源的基质金属蛋白酶(matrix metalloproteinases,MMPs)可水解脱矿后暴露的胶原纤维,造成有机质崩解,加速龋病进展[5]。传统的充填术可以恢复病变部位的缺损,但仅针对已经出现的龋洞,而且根面龋的形态不易形成良好的固位形,充填效果不佳,治疗及维护费用昂贵。自20世纪中期始,越来越多的口腔学者强调促进龋病的预防以及早期医疗干预的重要性,可以同时满足微创牙科(minimal invasive dentistry,microdentistry,MI)和节约保健费用的需求。
利用天然产物防治龋病的有效性、低毒性及不产生耐药性已为循证医学证明,近年来成为龋病防治领域关注的焦点。橙皮甙是柑桔果实中提取的生物黄酮类化合物[7],属于多酚类化合物,具有抗癌、抗氧化、免疫调节、抗菌消炎、防止动脉硬化和心肌梗死等多种生物学活性[7-11]。近年来有学者将橙皮甙应用于口腔领域,发现橙皮甙能稳定胶原纤维,可有效促进牙本质的再矿化过程[2];橙皮甙结合黏接剂处理牙本质表面,可提高牙面的硬度及弹性模量[12]。以上研究结果提示,橙皮甙的这种特性对根面龋具有预防和治疗作用,值得研究。
本实验结果显示,根方牙本质样本经脱矿液处理后,其表面显微硬度值显著降低,脱矿体积显著增加;提示脱矿液具有溶解羟基磷灰石,使根方牙本质脱矿的作用。脱矿液浸泡前分别用1 000 mg/L NaF溶液或7 000 mg/L HPN溶液对样本进行预处理,则可使其SMH值的降低程度(ΔSMH)和脱矿体积显著减轻,与阴性对照组相比差异有统计学意义(P<0.05),说明使用 1 000 mg/L NaF 和 7 000 mg/L HPN预处理能明显抑制脱矿液对根方牙本质的酸蚀脱矿作用,从而提高其耐脱矿能力。溶剂对照组ΔSMH和脱矿体积与阴性对照组相比无显著性差异(P>0.05),排除了以NaOH作为溶剂对HPN耐脱矿作用的影响。研究表明,NaF具有抑制牙体硬组织脱矿并促进其再矿化的作用[13,14],这是由于羟基磷灰石溶解后释放的离子与氟离子反应形成氟磷灰石,其抗酸溶解能力较强[15],阻止了牙体硬组织进一步脱矿;同时氟离子还可与解离出的钙离子结合形成氟化钙,从而阻止钙的继续丧失[16]。
7 000 mg/L HPN预处理后,其牙本质的SMH值降低程度(ΔSMH)及脱矿体积均与阳性对照组无显著差异,提示HPN饱和液预处理也可以降低羟基磷灰石的溶解度,增强根方牙本质对脱矿液酸蚀作用的抵抗能力,其效果与NaF预处理相当。但是,HPN预处理提高根方牙本质抗酸能力的机制与NaF不尽相同,这可能与HPN能够稳定裸露的胶原纤维有关。当牙本质表层的羟基磷灰石溶解后,如果裸露的有机基质完整性能得以保持,就可以阻止脱矿区钙离子和磷酸根离子进一步扩散,从而阻碍脱矿进展[2]。因此,龋损脱矿部位牙本质有机质层的相对完整性,对限制早期龋损区域的进展,以及防止病损区域进一步脱矿具有极为重要的意义[17]。牙本质基质的主要成分和支架是Ⅰ型胶原纤维[18]。研究表明HPN可能具有交联性[2],能促进胶原纤维的交联来增韧胶原,从而稳定了牙本质的支架结构并形成机械屏障,该屏障可阻止矿物质继续扩散,最终提高牙本质的耐脱矿能力。目前关于HPN的具体交联机制尚不明确,但学者们推测可能与葡萄籽提取物——原花青素(一种天然交联剂)的作用近似;HPN和原花青素均为酚类黄酮化合物,基本结构单元相近,都具有一个苯并二氢吡喃环[12]。大量研究已证实,采用原花青素作为牙本质交联剂,能够显著地增加牙本质有机质的机械性能[19,20]。这是由于原花青素能与胶原形成多种结合键,如共价键、离子键、氢键等,并形成疏水的微环境,从而起到增强胶原的机械性能、提高牙本质耐脱矿能力的作用[21]。同时胶原的进一步交联,可减少基质金属蛋白酶的作用位点,进而提升了胶原的耐酶解能力,进一步稳定胶原[22]。然而关于HPN具体的交联机制仍有待进一步实验研究证实。
3 500 mg/L HPN预处理组的ΔSMH值和脱矿体积均显著低于阳性对照组和7 000 mg/L HPN组,与阴性对照组间无显著差异,说明浓度为3 500 mg/L的HPN预处理在提高根方牙本质耐脱矿能力方面作用甚微。提示,在本实验条件下,使用HPN饱和液预处理,根方牙本质耐酸蚀脱矿的作用最好。
增强牙体硬组织的抗酸能力以及促进早期龋损脱矿部位再矿化,一直是龋病预防及治疗的重点。本研究结果显示,橙皮甙饱和溶液可显著降低脱矿液的酸蚀脱矿作用,提高根方牙本质的耐脱矿能力,提示橙皮甙在预防根面龋方面有较好的应用前景。但是,其具体的耐脱矿机制,是否具有促进根面龋再矿化的作用,生物安全性如何,能否作为添加剂用于牙膏、护牙素或漱口水等商品中,目前尚不明确,仍有待进一步实验研究证明。
[1]Pavan S,Xie Q,Hara AT,et al.Biomimetic approach for root caries prevention using a proanthocyanidin-rich agent[J].Caries Res,2011,45(5):443-447.
[2]Hiraishi N,Sono R,Islam MS,et al.Effect of hesperidin in vitro on root dentine collagen and demineralization[J].J Dent,2011,39(5):391-396.
[3]Huang X,Cheng L,Exterkate RA,et al.Effect of pH on Galla chinensis extract’s stability and anti-caries properties in vitro[J].Arch Oral Biol,2012,57(8):1093-1099.
[4]Jeon JG,Rosalen PL,Falsetta ML,et al.Natural products in caries research:current(limited)knowledge,challenges and future perspective[J].Caries Res,2011,45(3):243-263.
[5]Toledano M,Nieto-Aguilar R,Osorio R,et al.Differential expression of matrix metalloproteinase-2 in human coronal and radicular sound and carious dentine[J].J Dent,2010,38(8):635-640.
[6]Hamdan DI,Mahmoud MF,Wink M,et al.Effect of hesperidin and neohesperidin from bittersweet orange(Citrus aurantium var.bigaradia)peel on indomethacin-induced peptic ulcers in rats[J].Environ Toxicol Pharmacol,2014,37(3):907-915.
[7]Truchado P,Gimenez-Bastida JA,Larrosa M,et al.Inhibition of quorum sensing(QS)in Yersinia enterocolitica by an orange extract rich in glycosylated flavanones[J].J Agric Food Chem,2012,60(36):8885-8894.
[8]Kamboh AA,Zhu WY.Effect of increasing levels of bioflavonoids in broiler feed on plasma anti-oxidative potential,lipid metabolites,and fatty acid composition of meat[J].Poult Sci,2013,92(2):454-461.
[9]Zhang B,Chen T,Chen Z,et al.Synthesis and anti-hyperglycemic activity of hesperidin derivatives[J].Bioorg Med Chem Lett,2012,22(23):7194-7197.
[10]Meiyanto E,Hermawan A,Anindyajati.Natural products for cancer-targeted therapy:citrus flavonoids as potent chemopreventive agents[J].Asian Pac J Cancer Prev,2012,13(2):427-436.
[11]Li G,Chen MJ,Wang C,et al.Protective effects of hesperidin on concanavalin A-induced hepatic injury in mice[J].Int Immunopharmacol,2014,21(2):406-411.
[12]Islam S,Hiraishi N,Nassar M,et al.Effect of natural cross-linkers incorporation in a self-etching primer on dentine bond strength[J].J Dent,2012,40(12):1052-1059.
[13]Songsiripradubboon S,Hamba H,Trairatvorakul C,et al.Sodium fluoride mouthrinse used twice daily increased incipient caries lesion remineralization in an in situ model[J].J Dent,2014,42(3):271-278.
[14]Takeuchi K,Nakagaki H,Toyama Y,et al.Fluoride concentrations and distribution in premolars of children from low and optimal fluoride areas[J].Caries Res,1996,30(1):76-82.
[15]Kimoto K,Okudera T,Okudera H,et al.PartⅠ:crystalline fluorapatite-coated hydroxyapatite,physical properties[J].J Oral Implantol,2011,37(1):27-33.
[16]ten Cate JM.Review on fluoride,with special emphasis on calcium fluoride mechanisms in caries prevention[J].Eur J Oral Sci,1997,105(5 Pt 2):461-465.
[17]Hara AT,Ando M,Cury JA,et al.Influence of the organic matrix on root dentine erosion by citric acid[J].Caries Res,2005,39(2):134-138.
[18]Chaussain-Miller C,Fioretti F,Goldberg M,et al.The role of matrix metalloproteinases(MMPs)in human caries[J].J Dent Res,2006,85(1):22-32.
[19]Liu RR,Fang M,Zhang L,et al.Anti-proteolytic capacity and bonding durability of proanthocyanidin-biomodified demineralized dentin matrix[J].Int J Oral Sci,2014,6(3):168-174.
[20]Bedran-Russo AK,Pashley DH,Agee K,et al.Changes in stiffness of demineralized dentin following application of collagen crosslinkers[J].J Biomed Mater Res B Appl Biomater,2008,86(2):330-334.
[21]Rizzi GP.Formation of strecker aldehydes from polyphenol-derived quinones and alpha-amino acids in a nonenzymic model system[J].J Agric Food Chem,2006,54(5):1893-1897.
[22]Han B,Jaurequi J,Tang BW,et al.Proanthocyanidin-a natural crosslinking reagent for stabilizing collagen matrices[J].J Biomed Mater Res,2003,65(1):118-124.

