去势更年期雌性大鼠瘦素抵抗的机制研究
梁园园,宋 博,康 白(青岛滨海学院医学院基础医学教研室,青岛 266555;通讯作者,E-mail:baik615@126.com)
更年期女性肥胖已成为临床上一种常见病、多发病,与女性乳腺癌、糖尿病等疾病的发生密切相关[1]。研究发现,瘦素抵抗是更年期女性产生肥胖的重要原因[2]。然而,瘦素抵抗确切的发生机制目前仍未阐明。新近研究发现,细胞因子信号转导抑制因子 -3(suppressor of cytokine sighting-3,SOCS-3)是瘦素信号转导中的主要抑制因子,在瘦素抵抗发生过程中起着重要作用[3]。另有研究表明,TNF-α和IL-6能够诱导SOCS-3基因表达升高,从而抑制瘦素信号转导,诱导产生瘦素抵抗。本研究采用RIA、ELISA、RT-PCR等方法,从功能和基因的角度,观察去势更年期雌性大鼠瘦素抵抗与TNF-α和IL-6水平及SOCS-3基因表达的影响,探讨去势后雌性肥胖大鼠瘦素抵抗的发生机制,为更年期女性肥胖起相关疾病的防治提供重要的理论依据。
1 材料与方法
1.1 实验动物
健康成年雌性未孕SD大鼠20只,10周龄,体引质量180-220 g,由山东鲁抗实验动物中心提供,实验动物质量合格证号:SCXK鲁20080002。
1.2 实验试剂与仪器
瘦素放免试剂盒(北京普尔伟业生物科技有限公司),IL-6 ELISA试剂盒(济南凯晨生物科技有限公司),TNF-α ELISA检测试剂盒(上海丽臣生物科技有限公司),UNIQ-10柱式总RNA抽提试剂盒、MMuLV第一链cDNA合成试剂盒均为上海生工生物工程有限公司产品,PCR扩增试剂盒(大连宝生物)。iMARK酶标仪(美国 Bio-Rad公司),5804R台式高速低温离心机(德国Eppendor公司),凝胶电泳成像分析系统(美国Alpha Innotech公司),梯度PCR仪(德国Eppendor公司)。
1.3 引物
SOCS-3引物和 β-actin引物采用软件 Primer Express 5.0设计,引物序列信息如下,由上海生工生物工程有限公司合成。β-actin上游引物序列:5'-TTGTAACCAACTGGGACGATATGG-3',下游引物序列:5'-GATCTTGATCTTC ATGGTGCTAGG-3',扩增片段总长度为764 bp;SOCS-3上游引物序列:5'-TCACCCACAGCAAGTTTCC-3',下游引物序列:5'-GGATGCGT AGGTTCTTGGTC-3',扩增片段总长度为282 bp。
1.4 去势大鼠更年期模型的建立
选健康成年雌性未孕SD大鼠20只,随机分为两组:空白对照组(sham组)和摘卵巢去势组(OVX组)。去势更年期组大鼠按经典大鼠去势法进行去势手术。术前禁食12 h,腹腔注射麻醉大鼠,达到麻醉效果后,消毒处理手术区域。在大腿附近沿背脊后正中线向头部作一长为10 cm左右的纵形切口。用钝性分离的方法将组织与表皮分离,向右侧牵拉切口至大腿附近的骶脊肌,用止血钳固定。于骶脊肌处通过钝性分离剪采用钝性分离的方法分离,为扩大手术视野用拉钩向右拉开覆盖的肌肉,即可见一些颜色发白的脂肪组织,用无齿镊轻轻将脂肪组织夹出,同时寻找红色颗粒状的组织即卵巢。用止血钳夹住卵巢,并用丝线结扎,然后用组织剪剪除右侧卵巢。将脂肪组织轻轻送回腹腔内,用丝线缝合钝性分离口。向左侧牵拉切口,用同样的方法取出左侧卵巢。双侧卵巢均摘除后,在表皮与肌肉间撒青霉素粉,以防感染。然后用5号丝线缝合皮肤切口,用酒精擦拭切口进行常规消毒,并在手术部位覆盖一层无菌纱布。手术完毕后,将大鼠置于烤灯下保温至完全清醒。术后3 d分别通过肌肉注射的方法给予5万U/只的青霉素,防止感染。另10只大鼠,采用同样的方法,在卵巢周围取出与卵巢等体积的脂肪组织,为sham组。术后常规喂养30 d,由颈总动脉取血约5 ml,用放射免疫分析法(RIA)测定正常大鼠和去势大鼠血清(E2)、孕酮(P)水平,以确定大鼠更年期模型的建立。
1.5 去势对雌性大鼠血清 LEP、TNF-α和 IL-6水平的影响
按上述方法取血,用RIA测定两组大鼠血清瘦素(LEP)含量,用ELISA法分析各组大鼠血清中IL-6及TNF-α的水平。操作步骤均按试剂盒说明书进行。同时每周称重一次,观察大鼠体重的变化。
1.6 去势对雌性大鼠脂肪组织SOCS-3 mRNA表达的影响
mRNA提取:取大鼠脂肪组织约35 mg,迅速置于液氮中研磨匀浆,操作步骤严格按照试剂盒说明书进行,提取脂肪组织mRNA。逆转录RT反应按试剂盒合成第一链cDNA,PCR扩增SOCS-3基因和β-actin基因。RT-PCR产物经电泳后用计算机图像分析仪扫描,经凝胶图像分析系统,对产物的电泳条带进行灰度分析,并比较目的片段和内参照灰度比值(平均灰度值)。
1.7 统计学处理
采用SPSS 17.0系统软件对数据进行处理分析,各组结果分别以±s表示,采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 去势对雌性大鼠血清瘦素、TNF-α、IL-6水平的影响
与sham组比较,OVX组大鼠血清E2和P的含量均显著降低(P<0.01),血清瘦素、TNF-α和IL-6的水平则明显升高(P<0.01,见表1)。
表1 去势对雌性大鼠血清E2、P、瘦素、TNF-α和IL-6水平的影响(±s,n=10)Table 1The serum levels of E2,progesterone,leptin,TNF-α and IL-6 in OVX rats(±s,n=10)

表1 去势对雌性大鼠血清E2、P、瘦素、TNF-α和IL-6水平的影响(±s,n=10)Table 1The serum levels of E2,progesterone,leptin,TNF-α and IL-6 in OVX rats(±s,n=10)
与 sham 组相比,*P <0.05,**P <0.01
组别 体质量(g) E2(ng/L) P(ng/L) LEP(μg/ml) TNF-α(pg/ml) IL-6(pg/ml)sham 组 236.1 ±25.4 20.1 ±8.02 12.5 ±4.1 2.53 ±1.70 0.068 4 ±0.013 5 32.913 ±10.622 OVX 组 264.3 ±40.5* 10.2 ±1.39** 4.1 ±2.9** 6.40 ±2.02** 0.090 2 ±0.016 2** 54.832 ±9.203*
2.2 去势对雌性大鼠脂肪组织SOCS-3 mRNA的影响
琼脂糖凝胶电泳结果显示,OVX组PCR产物浓度明显大于sham组(见图1),灰度值分析结果表明,去势组大鼠脂肪组织SOCS-3 mRNA表达显著升高(P <0.01,见表2)。
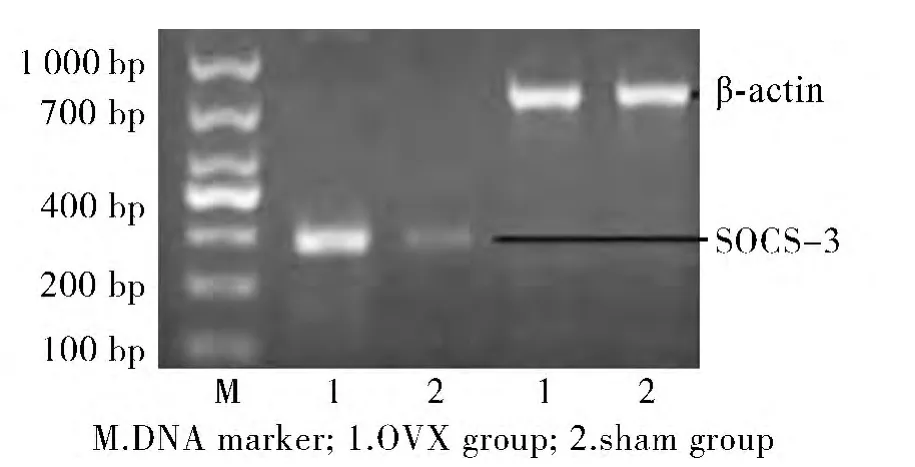
图1 两组大鼠脂肪组织SOCS-3 mRNA的表达Figure 1 SOCS-3 mRNA expression in adipose of ovariectormized rats
表2 去势对雌性大鼠脂肪组织SOCS-3 mRNA的影响(±s)Table 2 The levels of SOCS-3 in adipose of OVX rats by PCR(±s)

表2 去势对雌性大鼠脂肪组织SOCS-3 mRNA的影响(±s)Table 2 The levels of SOCS-3 in adipose of OVX rats by PCR(±s)
与sham组相比,*P<0.05
组别 n SOCS-3(%)sham组10 0.43 ±0.125 OVX 组 10 0.76 ±0.094*
3 讨论
肥胖严重威胁着更年期女性的身心健康。更年期肥胖是女性卵巢功能衰退、雌激素减少、下丘脑-垂体-卵巢轴平衡失调所引起的机体内分泌系统异常和脂质代谢紊乱性疾病。本实验结果表明,大鼠摘除卵巢去势后,血清E2和P的含量均较空白对照组明显降低,而体重却显著升高。这与人类更年期女性肥胖的表现和内分泌改变相一致。
瘦素(leptin)是由脂肪细胞分泌的一种由肥胖基因编码的和167个氨基酸组成的分泌型蛋白质。大量研究表明,肥胖者体内血清leptin水平增高提示肥胖症常存在着瘦素抵抗现象。瘦素抵抗是指机体组织对瘦素的调节作用不敏感或无反应。目前认为,瘦素抵抗是导致肥胖的主要原因[2]。本实验中,摘卵巢去势后的更年期大鼠血清leptin水平较空白对照组显著升高,出现瘦素抵抗现象。SOCS-3作为瘦素信号传导通路中的主要反馈抑制因子参与瘦素抵抗的发生[3-5]。SOCS-3升高是瘦素抵抗的标志[6,7],SOCS-3 能够通过SH2 结构域与JAK 分子磷酸化的酪氨酸残基结合,抑制JAK分子的自身酪氨酸磷酸化作用,导致JAK蛋白不能活化为JAK酪氨酸激酶,抑制了leptin的JAK/STAT通路的传导过程,最终导致瘦素抵抗,进而导致肥胖的发生。有研究证实leptin、TNF-α、IL-6等可诱导SOCS-3的基因表达,SOCS-3的表达产物又可以阻碍这些细胞因子的信号传导[8,9]。又有研究表明[3],瘦素抵抗常伴有TNF-α、IL-6等炎症因子水平增高。本实验中,摘卵巢去势更年期组大鼠血清TNF-α和IL-6的水平较空白对照组明显升高,同时摘卵巢去势后更年期大鼠脂肪组织SOCS-3 mRNA表达显著升高。因此,去势后更年期雌性大鼠发生肥胖的瘦素抵抗机制可能与TNF-α、IL-6水平升高从而进一步诱导脂肪组织SOCS-3基因表达升高有关。
综上所述,通过观察去势后更年期雌性大鼠血清中leptin、TNF-α和IL-6含量及脂肪组织SOCS-3基因表达的改变,从分子生物学的水平探究更年期女性肥胖的发生机制,为临床更年期女性肥胖病及相关疾病的防治提供重要的理论依据。
[1]Maccio A,Madeddu C.Obesity,inflammation,and postmenopausal breast cancer:therapeutic implications[J].Sci World J,2011,1:2020-2036.
[2]Power ML,Schulkin J.Sex differences in fat storage,fat metabolism,and the health risks from obesity:possible evolutionary origins[J].Br J Nutr,2008,99(5):931-940.
[3]Cheng L,Yu Y,Szabo A,et al.Palmitic acid induces central leptin resistance and impairs hepatic glucose and lipid metabolism in male mice[J].J Nutr Biochem,2015,26(5):541-548.
[4]Bjorbaek C,Elmquist JK,Frantz JD,et al.Identification of SOCS-3 as a potential mediator of central leptin resistance[J].Mol Cell,1998,1(4):619-625.
[5]Dunn SL,Bjornholm M,Bates SH,et al.Feedback inhibition of leptin receptor/Jak2 signaling via Tyr1138 of the leptin receptor and suppressor of cytokine signaling 3[J].Mol Endocrinol,2005,9(4):925-938.
[6]Wang Z,Zhou YT,Kakuma T,et al.Leptin resistance of adipocytes in obesity:role of suppressors of cytokine signaling[J].Biochem Biophys Res Commun,2000,277(1):20-26.
[7]Bjorbaek C,El-Haschimi K,Frantz JD,et al.The role of SOCS-3 in leptin signaling and leptin resistance[J].J Biol Chem,1999,274(42):30059-30065.
[8]Emanuelli B,Peraldi P,Filloux C,et al.SOCS-3 is an insulin-induced negative regulator of insulin signaling[J].J Biol Chem,2000,275(21):15985-15991.
[9]Dey BR,Furlanetto RW,Nissley P.Suppressor of cytokine signaling(SOCS)-3 protein interacts with the insulin-like growth factor-Ⅰreceptor[J].Biochem Biophys Res Commun,2000,278(1):38-43.

