血管紧张素Ⅱ及贝那普利对肝星状细胞ACE2和Ang-(1-7)/Mas受体的影响
王丽华,申凤俊,许小妹(山西医科大学第一临床医学院消化内科,太原 030001;通讯作者,E-mail:sfj919016603@126.com)
局部肾素-血管紧张素系统(renin angiotensin system,RAS)与肝纤维化密切相关,经典的血管紧张素转换酶(ACE)-AngⅡ-血管紧张素Ⅱ1型受体(AT1R)轴可促进肝纤维化的发展,血管紧张素Ⅱ(AngⅡ)是该轴的核心效应分子[1]。近来发现体内RAS系统存在经典途径以外的第二条代谢通路,即由血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)、血管紧张素 1-7(angiotensin 1-7,Ang1-7)、Mas受体组成的ACE2-Ang-(1-7)-Mas受体轴,此条通路通过 ACE2生成 Ang-(1-7),Ang-(1-7)作用于Mas受体发挥抗肝纤维化的生物学效应[2]。本实验通过AngⅡ及血管紧张素转换酶抑制剂贝那普利对体外培养的肝星状细胞中ACE2、Mas受体的表达以及细胞上清液中Ang-(1-7)影响的研究,有望对临床肝纤维化的治疗提供实验依据。
1 材料与方法
1.1 细胞株及主要试剂
大鼠肝星状细胞株(HSC-T6)引自中国医学科学院肿瘤细胞库。Ang-(1-7)酶联免疫测定试剂盒购自上海西唐生物科技有限公司;ACE2即用型SABC免疫组化试剂盒、ACE2兔抗大鼠多克隆抗体、随机引物、dNTP、ROX(FastStart Universal SYBR Green Master)、引物、Buffer、RNA 酶抑制剂、逆转录酶均购自上海生工生物科技有限公司;AngⅡ为吉尔生化上海有限公司产品;贝那普利由北京诺华制药有限公司提供。
1.2 细胞培养方法及实验分组
在37℃,5%CO2条件下将大鼠肝星状细胞株(HSC-T6)培养于含10%胎牛牛血清,100 U/ml青霉素/链霉素的1640培养基中,每周传代2-3次,选取处于对数生长期的HSC-T6接种于6孔板盖玻片上,融合75%左右弃旧培养液,换成不含血清和抗生素的培养基再培养24 h后进行细胞干预实验。实验分组为:正常对照组(不添加试剂)、AngⅡ处理组(加1 μmol/L AngⅡ)、AngⅡ +贝那普利组(提前1 h加入 1 μmol/L 贝那普利,再加 1 μmol/L AngⅡ)、贝那普利组(加1 μmol/L贝那普利),分组处理后在培养箱中继续培养24 h,然后收集细胞、细胞爬片,并提取细胞上清液。
1.3 免疫细胞化学染色检测ACE2的表达
按照ACE2即用型SABC免疫组化试剂盒的说明进行。固定细胞爬片、灭活内源性酶、热修复抗原、滴加封闭液。滴加一抗(浓度为 1∶100的ACE2),4℃冰箱中过夜,PBS液冲洗。滴加生物素化二抗工作液(山羊抗兔IgG),37℃冰箱中孵育20 min,PBS液冲洗。滴加SABC试剂,温度为37℃冰箱中放置20 min,PBS液冲洗。DAB显色剂显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树脂封片,光镜下观察染色结果。
1.4 上清液中Ang-(1-7)含量的测定
双抗夹心ELISA法检测细胞培养上清液中Ang-(1-7)含量。按照Ang-(1-7)ELISA试剂盒说明书测出吸光值,应用软件根据样品吸光值计算出相应Ang-(1-7)含量。
1.5 RT-PCR检测肝星状细胞ACE2和Mas受体mRNA的表达
用Trizol法抽提HSC细胞总RNA,测定A260和A280,保证比值在1.8-2.0之间,然后进行逆转录。内参beta-actin上游:5'-GTCAGGTCATCACTATCGGCAAT-3';下游:5'-AGAGGTCTTTACGGATGTCAACGT-3',产物长度为147 bp。ACE2 上游:5'-GCTAAACATGATGG CCCA CT-3';下游:5'-CCC ACAGTCGAATTCCTGTT-3',产物长度为 218 bp。Mas受体上游:5'-CTCTCGGCTTTGTGGAGAAC-3';下游 5'-GGCCTGTGT TGTAGCCA AAT-3',产物长度为228 bp。RT-PCR检测反应系统依据上海生工生物科技有限公司说明步骤进行。
1.6 统计学分析
2 结果
2.1 ACE2的免疫细胞化学染色结果
各组细胞均可见细胞胞质内棕黄色颗粒沉积,呈ACE2阳性表达,但程度有所不同。采用标准型全自动医学图像彩色分析系统进行图像半定量分析,测定肝组织中棕黄色阳性表达颗粒的平均灰度值,该值越低表达越强。分析结果显示:与对照组相比,AngⅡ处理组细胞胞质内有较强的阳性染色。贝那普利+AngⅡ处理组ACE2的表达较单独AngⅡ处理组进一步增加(P<0.05,见表1)。
表1 ACE2的免疫细胞化学染色图像分析结果(±s)Table 1 Results of immunohistochemical staining of ACE2(±s)

表1 ACE2的免疫细胞化学染色图像分析结果(±s)Table 1 Results of immunohistochemical staining of ACE2(±s)
与对照组比较,△P <0.05;与 AngⅡ组比较,*P <0.05
组别 n ACE2对照组3 176.611 ±5.744 AngⅡ组 3 146.722 ±8.649△AngⅡ +贝那普利组 3 135.972 ±9.838*贝那普利组3 172.583 ±6.104
2.2 贝那普利对大鼠肝星状细胞合成分泌Ang-(1-7)的影响
细胞培养上清液中Ang-(1-7)的含量,单独AngⅡ处理组高于对照组(P<0.05),贝那普利+AngⅡ处理组较单独AngⅡ处理组Ang-(1-7)增加(P <0.05,见表 2)。
表2 细胞培养上清液中Ang-(1-7)的含量(±s)Table 2 Levels of Ang-(1-7)in cell culture supernatant(±s)

表2 细胞培养上清液中Ang-(1-7)的含量(±s)Table 2 Levels of Ang-(1-7)in cell culture supernatant(±s)
与对照组比较,△P <0.05;与 AngⅡ组比较,*P <0.05
组别 n Ang-(1-7)(ng/mL)3 6.56 ±1.34 AngⅡ组 3 14.23 ±2.25△AngⅡ +贝那普利组 3 23.43 ±3.25*贝那普利组对照组3 10.31 ±2.94
2.3 贝那普利对大鼠肝星状细胞ACE2、Mas受体mRNA的影响
各组细胞均有ACE2、Mas受体mRNA的表达,但程度有所不同。采用RT-PCR的方法进行荧光定量分析。结果显示:AngⅡ处理组与正常对照组相比较,其表达ACE2、Mas受体mRNA的表达升高(P <0.05),贝那普利 +AngⅡ处理组 ACE2、Mas受体mRNA的表达较单独AngⅡ处理组进一步增加(P <0.05,见表 3)。
表3 肝星状细胞中ACE2、MasmRNA的含量(±s)Table 3 Levels of ACE2 and Mas mRNA in hepatic stellate cells(±s)
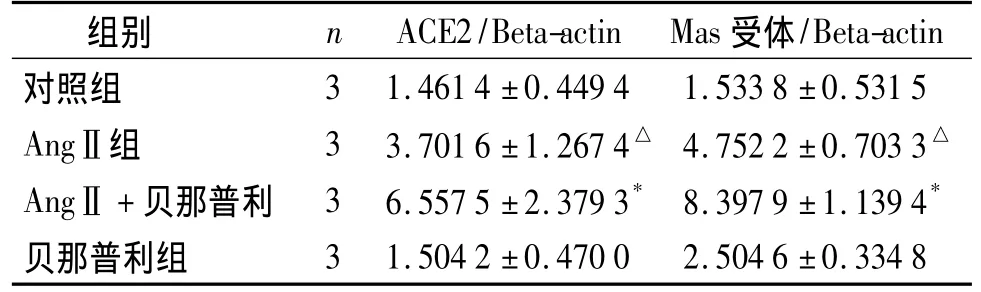
表3 肝星状细胞中ACE2、MasmRNA的含量(±s)Table 3 Levels of ACE2 and Mas mRNA in hepatic stellate cells(±s)
与对照组比较,△P <0.05;与 AngⅡ组比较,*P <0.05
组别 n ACE2/Beta-actin Mas受体/Beta-actin对照组3 1.461 4 ±0.449 4 1.533 8 ±0.531 5 AngⅡ组 3 3.701 6 ±1.267 4△ 4.752 2 ±0.703 3△AngⅡ +贝那普利 3 6.557 5 ±2.379 3* 8.397 9 ±1.139 4*贝那普利组3 1.504 2 ±0.470 0 2.504 6 ±0.334 8
3 讨论
正常情况下肝星状细胞处于静止状态,在病毒、酒精、免疫等致病因素作用下肝脏受损,肝星状细胞被激活,活化后的肝星状细胞能产生多种细胞因子,使肝脏内弥漫性细胞外基质(特别是胶原物质)过度沉积,使细胞外基质的合成大于降解[3]。因此,肝星状细胞的激活是肝纤维化发生过程中的重要事件。
近几十年来,随着对RAS系统的研究,人们意识到肝脏局部存在RAS系统,并且其与肝纤维化形成密切相关。经典的ACE-AngⅡ-AT1R轴可促进肝纤维化的发展,AngⅡ是该轴的核心效应分子,它能刺激肝星状细胞增殖与活化,并能释放炎症因子以及促纤维化因子[4],同时能诱导肝星状细胞合成细胞外基质及抑制细胞外基质降解,导致细胞外基质在肝内过度沉积,促使肝纤维化发生发展。
近来发现体内RAS系统存在经典途径以外的第二条代谢通路,此条通路通过ACE2生成Ang-(1-7),后者与其特异性受体Mas结合,形成ACE2-Ang-(1-7)-Mas轴。由于Ang-(1-7)在体内外有着与AngⅡ相拮抗的生物学效应,具有舒张血管、降低血压、利尿、抑制肥大、抑制成纤维细胞增殖等作用。所以它被理解为是一种内源性的AngⅡ阻断剂[5,6],因此新的代谢通路与传统的 RAS通路在功能上相拮抗。
既往我们在四氯化碳诱导的大鼠肝纤维化模型研究中证实,随着大鼠肝纤维化的加重,模型组ACE2表达增加,血浆Ang(1-7)升高,而在应用ACEI(贝那普利)治疗组肝脏ACE2表达增加,血浆Ang(1-7)水平明显升高,从而证实贝那普利可激活ACE2-Ang(1-7)-Mas受体轴,促进Ang(1-7)生成增多[7],而发挥其抗纤维化的作用。同时体外培养肝星状细胞,实验证实AngⅡ可引起肝星状细胞的增殖及胶原和转化生长因子-β1mRNA表达,而ARB(缬沙坦)可抑制AngⅡ引起的细胞增殖,同时可明显降低AngⅡ引起的肝星状细胞内钙浓度的增加,进一步说明AngⅡ参与了肝纤维化的过程[8]。但体外探究ACE2-Ang(1-7)-Mas受体轴与肝星状细胞的关系的研究较少,本实验通过体外培养肝星状细胞,检测其ACE2表达及其上清液中Ang-(1-7)的合成,并从基因水平探索肝星状细胞是否有ACE2和Mas受体mRNA的表达及贝那普利对它们的影响,进一步探究ACE2-Ang(1-7)-Mas轴与肝纤维化的关系。结果发现,在静止的肝星状细胞中存在ACE2的表达,同时肝星状细胞合成并分泌Ang-(1-7),并且均有ACE2和Mas受体mRNA的表达,但量均较少。加入AngⅡ处理后能够促使肝星状细胞激活,活化后的肝星状细胞中ACE2、Ang-(1-7)的合成及ACE2和Mas受体mRNA的表达均较对照组增加,而在加入ACEI类药物贝那普利后表达进一步增加,与此前Huang等[9]的研究一致。ACE2表达增多伴随着Ang-(1-7)合成也增加,提示ACE2过量表达促进了Ang-(1-7)的形成,而Ang-(1-7)通过与受体Mas结合后,发挥对肝纤维化的保护作用。
本实验表明,AngⅡ促使肝星状细胞激活,活化的肝星状细胞对Ang-(1-7)的合成增加,而ACEI类药促使激活的肝星状细胞Ang-(1-7)含量进一步增加,原因为ACE2的过量表达促进了Ang-(1-7)形成,与此同时Ang-(1-7)可被ACE降解为无活性的Ang-(1-5),而贝那普利可抑制ACE,进而阻止Ang-(1-7)的降解,从而增加其浓度[10]。既往四氯化碳诱导的大鼠肝纤维化模型研究证实血管紧张素转换酶抑制剂贝那普利可使大鼠肝纤维化程度明显减轻[11],本实验体外培养细胞,得出贝那普利可使激活的肝星状细胞ACE2、ACE2mRNA、MasmRNA及细胞上清液中的Ang-(1-7)表达增加,进一步证实上调的ACE2-Ang-(1-7)-Mas轴对肝纤维化有保护作用。因此,研究上调ACE2-Ang-(1-7)-Mas轴各组分的药物可能成为肝纤维化以及肝硬化治疗的重要思路。
[1]申凤俊,阴赪宏,王宝恩.肾素血管紧张素系统与肝纤维化、肝硬化[J].中华肝脏病杂志,2003,11(7):447-448.
[2]Pereira RM,dos Santos RA,da Costa Dias FL,et al.Renin-angiotensin system in the pathogenesis of liver fibrosis[J].World J Gastroenterol,2009,15(21):2579-86.
[3]周明玉,程明亮,TGFβ1刺激肝星状细胞的活化与肝纤维化的研究进展[J].贵州医药,2008,32(8):751-753.
[4]Wamer FJ,Lube JS,McCaughan GW,et al.Liver fibrosis:a balance of ACEs?[J].Clin Sci(Lond),2007,113(3):109-118.
[5]Ferrario CM.All angiotensin converting enzyme 2 and angiotensin-(l-7):an evolving story in cardiovascular regulation[J].Hypertension,2006,47(3):515-521.
[6]Ferreira AJ,Santos RA.Cardiovascular actions of angiotensin-(l-7)[J].Braz J Med Biol Res,2005,38(4):499-507.
[7]申凤俊,史媛媛,杨芳.贝那普利对肝纤维化大鼠血管紧张素转化酶2 表达的影响[J].中华肝脏病杂志,2011,19(8):621-622.
[8]申凤俊,唐淑珍,王平,等.缬沙坦对肝星状细胞的增殖及胶原合成的影响[J].中华肝脏病杂志,2004,12(9):561-562.
[9]Huang ML,Li X,Meng Y,et al.Upregulation of angiotensin-conver ting enzyme(ACE)2 in hepatic fibrosis by ACE inhibitors[J].Clin Exp Pharmacol Physiol,2010,37(1):e1-6.
[10]Lubel JS,Herath CB,Tchongue J,et al.Angiotensin-(1-7),an alternative metabolite of the renin-angiotensin system,is up-regulated in human liver disease and has antifibrotic activity in the bile-ductligated rat[J].Clin Sci(Lond),2009,117(11):375-386.
[11]史媛媛,申凤俊,杨芳.贝那普利对肝纤维化大鼠ACE2和Ang-(1-7)的影响[J].临床肝胆病杂志,2011,27(3):258-260.

