围手术期输血对胃癌患者术后生存的影响
李苏亮,叶 芸(西安医学院第一附属医院中心实验室,西安 710077;通讯作者,E-mail:yeyun236@163.com)
胃癌是常见的恶性肿瘤之一,死亡率在全球癌症死亡中居第2位,胃癌患者常因出血、营养不良及合并慢性病等多种因素导致贫血以及部分患者在围手术期必须接受输血[1]。但是,输血存在风险,尤其是对于肿瘤患者,输血会导致肿瘤患者免疫抑制从而影响其预后[2]。围手术期是围绕手术的一个全过程,从病人决定接受手术治疗开始,到手术治疗直至基本康复,包含手术前、手术中及手术后的一段时间,具体是指从确定手术治疗时起,直到与这次手术有关的治疗基本结束为止,时间约在术前5-7 d至术后7-12 d[3]。近年研究发现,围手术期输血与肺癌、肝癌、乳腺癌等疾病的术后不良预后存在一定的相关性[4]。有关围手术期输血对胃癌患者术后复发及预后影响的报道结果不尽一致[5]。因此,围手术期的胃癌患者是否输血,如何权衡输血利弊是困扰临床的一大问题。本研究采用生存分析,探讨围手术期输血对胃癌术后复发及预后的影响,以期为肿瘤患者的临床用血策略的制订提供参考依据。
1 材料与方法
1.1 研究对象
选取2006-06~2008-12西安医学院第一附属医院肿瘤科收治的217例行胃癌根治术的患者,除外资料不完整以及术前合并感染患者,共186例纳入研究。其中男性122例,女性64例,年龄64(25-81)岁。所有患者术后均经病理确诊为原发性胃癌。收集资料包括患者年龄、性别、体重指数、术前有无贫血、术中出血量、肿瘤大小、位置、浸润深度、淋巴结转移、TNM分期、有无输血和输血量。TNM分期参考美国癌症联合会(AJCC)第7版标准[6]。本研究经伦理委员批准,并按照知情同意原则,签署知情同意书。
1.2 分组
根据在围手术期是否接受输注红细胞以及输血量分为<2 U输血组(n=65)、>2 U输血组(n=43)和未输血组(n=78)。输血指征为血红蛋白<90 g/L,红细胞压积 <30.0%[6]。
1.3 随访
对所有患者进行随访,随访方式主要包括:电话随访、信件随访及再次就诊等。随访结果以生存月数表示,直至患者死亡或至满60个月。共成功随访了162例患者,随访率为87.1%。
1.4 统计学方法
用SPSS18.0统计软件录入数据,各组间发生率的比较采用卡方检验或Fisher确切概率法。单因素生存分析采用Kaplan-Meier法,Log Rank法检验三组差异的显著性。采用多因素Cox回归分析判断影响预后的独立因素。P<0.05为差异有统计学意义
2 结果
2.1 围手术期输血发生率
186例胃癌患者中,有108例接受围手术期输血。围手术期输血发生率58.06%,其中输血量>2 U发生率23.12%。
2.2 一般资料的比较
三组患者中,肿瘤大小、组织学分级、肿瘤侵袭程度、淋巴结切除数目增多、TNM分期、术中失血量、术前有无贫血差异有统计学意义(P<0.05);三组患者年龄、性别、BMI和肿瘤位置、手术类型均无统计学差异(P >0.05,见表1)。
2.3 各组生存时间及组间比较
162例成功随访患者中,有98例接受围手术期输血,其中输血量<2 U 58例,输血量>2 U患者40例,64例未行输血。有113例患者死亡,其中输血量<2 U患者死亡44例,输血量>2 U患者死亡32例,未输血组死亡37例。三组的中位生存时间为 20,12,27 d,中位生存时间的 95%CI为16-24 d,10-14 d,25-28 d。采用 Log Rank 法检验三组生存时间差异的显著性,三组整体水平比较差异有统计学意义(χ2=12.797,P=0.002);两两比较结果显示各组间差异有统计学意义(P<0.05,见表 2)
2.4 围手术期输血与术后生存的关系
把输血分组、肿瘤大小、TNM分级、侵袭程度、术中失血量、淋巴结切除数目及术前有无贫血纳入Cox回归模型进行分析,结果显示肿瘤大小与围手术期输血是影响胃癌患者术后生存的重要因素,对胃癌患者术后生存的影响差异有统计学意义(P<0.05)。肿瘤体积>5 cm的患者死亡风险相对于肿瘤体积<5 cm 的 HR为2.427(95%CI为1.083-5.989);围手术期输血量>2 U的患者死亡风险相对于未输血患者的HR为3.282(95%CI为2.131-24.886),围手术期输血量>2 U的患者死亡风险相对于围手术期输血量<2 U的HR为2.130(95%CI为 1.194-3.797,见表 3)。
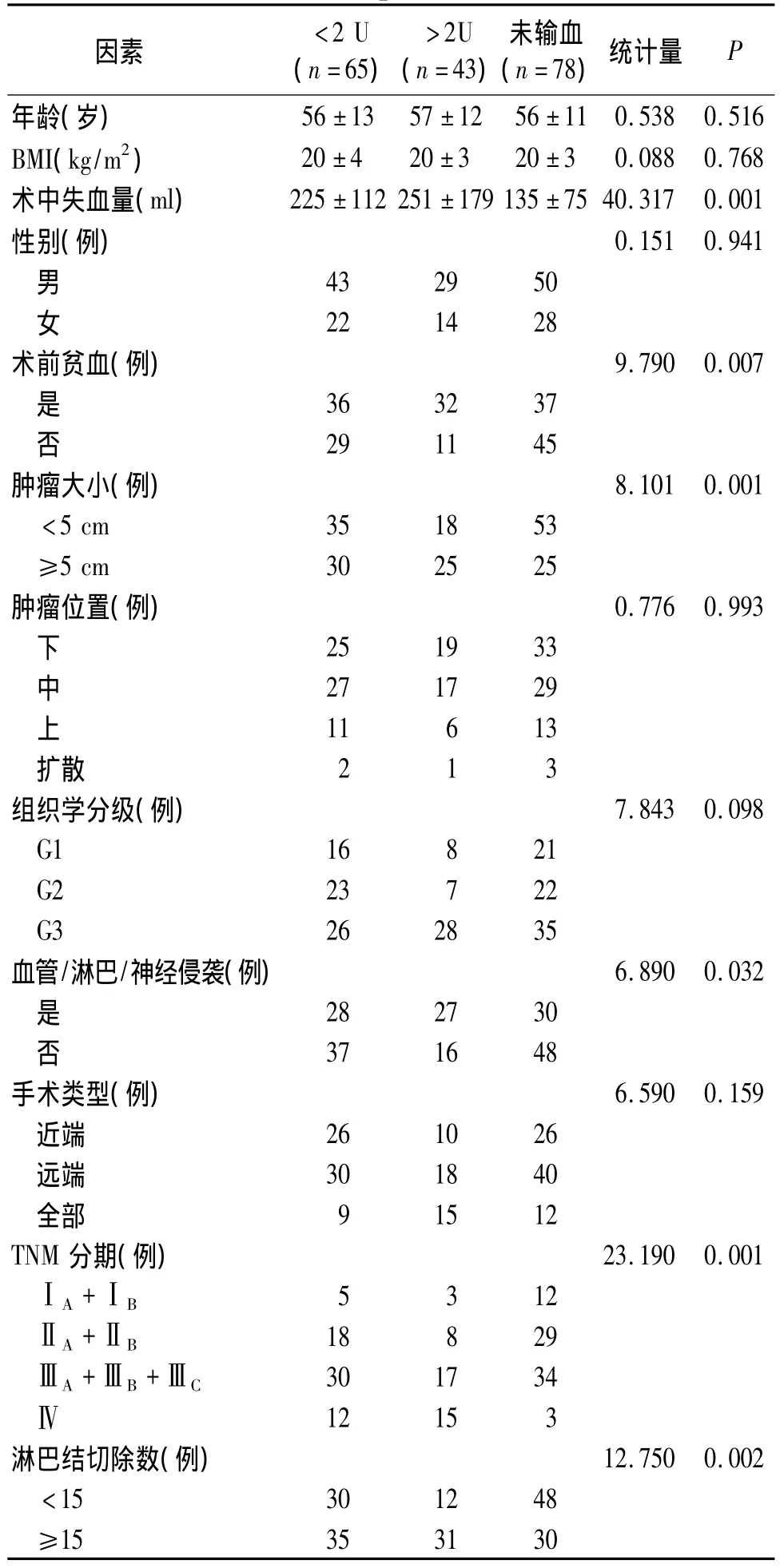
表1 患者一般资料的比较Table 1 Baseline data of patients

表2 三组生存时间中位数比较Table 2 Comparison of medians of survival time between groups

表3 多变量Cox回归分析的结果Table 3 The results of multivariable Cox regression analysis
3 讨论
胃癌是最常见的消化道肿瘤,其首选治疗方法为胃切除术[7]。胃癌手术中,为提高手术的安全性,输血有时是必不可少的[9]。但是,围手术期输血除了可引起血源性疾病传播、输血反应和溶血反应等并发症外,还可能会对胃癌患者术后生存率产生影响[10,11]。
我们的研究结果显示,随着肿瘤直径增大、组织学分级、肿瘤侵袭程度增加、淋巴结切除数目增多和TNM分期增加,围手术期输血发生率及输血量显著升高。这可能是由于中晚期患者手术范围较大、手术时间较长和术中失血较多所致。另外,中晚期患者确诊时间相对较晚,可能在手术之前已存在一定程度贫血也是输血的潜在因素。
Kim等[12]研究结果显示,相对未输血者而言,输血胃癌患者术后预后较差。有研究还显示输血量与患者预后存在负相关,输血量越大预后越差。本研究进一步表明,胃癌患者术后生存率与围手术期输血及输血量明显相关[13]。
Cox多元回归分析表明,结果显示肿瘤大小和围手术期输血是影响胃癌患者术后生存的重要因素。而围手术期输血量对胃癌患者术后生存有显著影响,围手术期输血量>2 U的患者死亡风险是围手术期输血量<2 U的2.130倍。
输血治疗虽然改善了贫血肿瘤患者的症状和生活质量,但影响了患者的预后[14]。究其原因是由于输入的异体血液导致患者的免疫功能受到抑制,并因此导致肿瘤复发率升高和生存率下降,免疫抑制作用主要包括降低辅助性T细胞和NK细胞的活性,单核-巨噬细胞免疫功能下降,增加抑制性T细胞的活性以及产生对抗T细胞抗原特殊受体的抗基因抗体[15]。因此,输血对于肿瘤患者而言,在多数情况下是弊大于利,这就提醒临床输血工作者和临床医生,由于肿瘤患者输血的特殊性,对其输血应更加审慎对待,应制定更好输血策略,减少不必要的输血。
[1]Japanese Gastric Cancer Association.Japanese classification of gastric carcinoma:3rd English edition[J].Gastric Cancer,2011,14(2):101-112.
[2]Guo JR,Xu F,Jin XJ,et al.Impact of allogenic and autologous transfusion on immune function in patients with tumors[J].Asian Pac J Cancer Prev,2014,15(1):467-474.
[3]徐国梅,周亚昭.美国围手术期护理流程管理见闻与启迪[J].护士进修杂志,2011,26(16):1502-1503.
[4]Luan H,Ye F,Wu L,et al.Perioperative blood transfusion adversely affects prognosis after resection of lung cancer:a systematic review and a meta-analysis[J].BMC Surg,2014,23(5):14-34.
[5]Ojima T,Iwahashi M,Nakamori M,et al.Association of allogeneic blood transfusions and long-term survival of patients with gastric cancer after curative gastrectomy[J].J Gastrointest Surg,2009,13(10):1821-1830.
[6]Edge SB,Compton CC.The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J].Ann Surg Oncol,2010,17(6):1471-1474.
[7]肖华,欧阳永忠,汤明,等.围手术期输血与胃癌根治术后并发症的关系[J].中华医学杂志,2014,94(10):751-754
[8]Hallinan JT,Venkatesh SK.Gastric carcinoma:imaging diagnosis,staging and assessment of treatment response[J].Cancer Imaging,2013,30(5);13:212-227.
[9]Rausei S,Ruspi L,Galli F,et al.Peri-operative blood transfusion in gastric cancer surgery:prognostic or confounding factor[J].Int J Surg,2013,11(1):100-103.
[10]Sahu S,Hemlata,Verma A.Adverse events related to blood transfusion[J].Indian J Anaesth,2014,58(5):543-551.
[11]Isbister JP,Shander A,Spahn DR,et al.Adverse blood transfusion outcomes:establishing causation[J].Transfus Med Rev,2011,25(2):89-101.
[12]Kim SH,Lee SI,Noh SM.Prognostic significance of preoperative blood transfusion in stomach cancer[J].J Gastric Cancer,2010,10(4):196-205.
[13]Hyung WJ,Noh SH,Shin DW,et al.Adverse effects of perioperative transfusion on patients with stageⅢ and Ⅳ gastric cancer[J].Ann Surg Oncol,2002,9(1):5-12.
[14]Bortul M,Calligaris L,Roseano M,et al.Blood transfusions and results after curative resection for gastric cancer[J].Suppl Tumori,2003,2(5):27-30.
[15]Chen G,Zhang FJ,Gong M,et al.Effect of perioperative autologous versus allogeneic blood transfusion on the immune system in gastric cancer patients[J].J Zhejiang Univ Sci B,2007,8(8):560-565.

