中国主要鸭茅品种农艺性状变异研究
蒋林峰,张新全,付玉凤,蒙芬,黄琳凯
(1.四川农业大学动物科技学院草业科学系,四川 雅安625014;2.重庆市垫江县畜牧生产站,重庆408300)
鸭茅(Dactylisglomerata)又名鸡脚草、果园草[1],系禾本科鸭茅属多年生疏丛禾草[2],原产欧洲[3],因叶量丰富、草质柔嫩、抗寒性好等优点,在英国、德国、芬兰等欧洲国家的饲草栽培中占有重要地位[4],同时在北美有200余年种植历史,是目前美国大面积栽培牧草之一。近年被大量用于我国草地畜牧业及生态建设,是西部退耕还草,粮-草、草-草、林-草复合植被等生态工程的重要草种[5]。
农艺性状是人类认识、区分种或类型,选育植物新品种的重要标记,有助于植物品种间表型变异及亲缘关系的分析[6-7]。Amirouche和Misset[8]对鸭茅30个亚种表型研究表明,不同亚种间差异明显,证明表型性状是区别鸭茅亚种的有效方法;Sugiyama[9]对位于不同纬度和海拔的26个鸭茅亚种研究表明,鸭茅的发芽速度、叶片宽度和再生能力呈现出地域上的阶梯差异;Lindner等[10]对鸭茅4个生态型39个亚种研究表明,不同生态型间开花期、旗叶长度、生长习性等差异显著,且亚种间存在较高程度的季节性互补生长;Jochner等[11]对随海拔梯度变化的鸭茅资源研究表明,鸭茅的开花期严重依赖于海拔和地域,并随之变动;Casler等[12]通过对42份早、中、晚熟鸭茅品种研究证明,北美过去40年的育种工作使鸭茅的生产性能有所提高;彭燕等[13]对鸭茅种质植物学特征研究表明,不同种源鸭茅的形态学特征间变异丰富;钟声等[14]研究表明,我国横断山区的2个鸭茅亚种在外形特征和生长发育上存在明显差异,尤其是花序和小穗被毛特征;徐倩等[15]对16份国外引进的鸭茅物候期和表型观测分析表明,鸭茅的旗叶长度、节间长度等变异系数大;钟声[16]对野生鸭茅杂交后代农艺性状研究表明,杂交后代具有双亲的形态学特征,分蘖和物候发育介于双亲,易于识别,且苗期生长速度、繁殖特性、抗性等均强于双亲,有较大育种价值。
截至目前,我国已审定登记的鸭茅品种为8个,而美国和欧盟已选育获得近500个鸭茅品种。国内鸭茅品种遗传基础较为狭窄,且引进品种普遍暴露出在我国适应性差等问题,难以满足我国生态建设或畜牧业发展。如何更好地结合我国鸭茅品种,开展针对不同需求的育种工作,综合选育出更多的鸭茅品种已刻不容缓。但系统地开展我国鸭茅品种的农艺性状变异研究,截至目前,还未见有报道。了解我国现有鸭茅品种的表型变异基础,有助于正确指导我国鸭茅品种育种工作的开展和促进我国野生鸭茅种质的合理利用。
本研究采用国际植物新品种保护联盟(international union for the protection of new varieties of plants,UPOV)鸭茅(http://www.upov.int/edocs/tgdocs/fr/tg031.pdf)品种三性(distinctness,uniformity,stability,DUS)测试方法,综合评价我国已审定登记的鸭茅品种,比较不同鸭茅品种在表型水平上的多态性及变异规律,以期为加快我国鸭茅育种进程和鸭茅品种知识产权保护提供理论依据。
1 材料与方法
1.1 研究区概况
本研究在四川农业大学草学系农场科研基地进行,地理坐标N 30°08′,E 103°14′,海拔600m,北亚热带湿润季风气候区。年均气温16.2℃,最热月(7月)均温25.3℃,最冷月(1月)均温6.1℃,极端高温37.7℃,极端低温-3℃,年降水量1774.3mm,年蒸发量1011.2mm,年相对湿度79%,年日照时数1039.6h,无霜期304d,≥5℃年积温5770.2℃,≥10℃年积温5231℃。试验地土壤系白垩纪灌口组紫色砂页岩风化堆积物形成的紫色土,土壤pH 5.6,有机质含量1.46%,土壤速效 N、P、K含量分别为100.63,4.73,338.24mg/kg,该地气候温和,雨量充沛,适于多种牧草生长,在四川盆地丘陵平原气候中具代表性。
1.2 试验材料
供试材料为我国鸭茅8个审定登记品种和1个新品系,均为四川农业大学草业科学系从品种(系)申报单位收集而来(表1)。
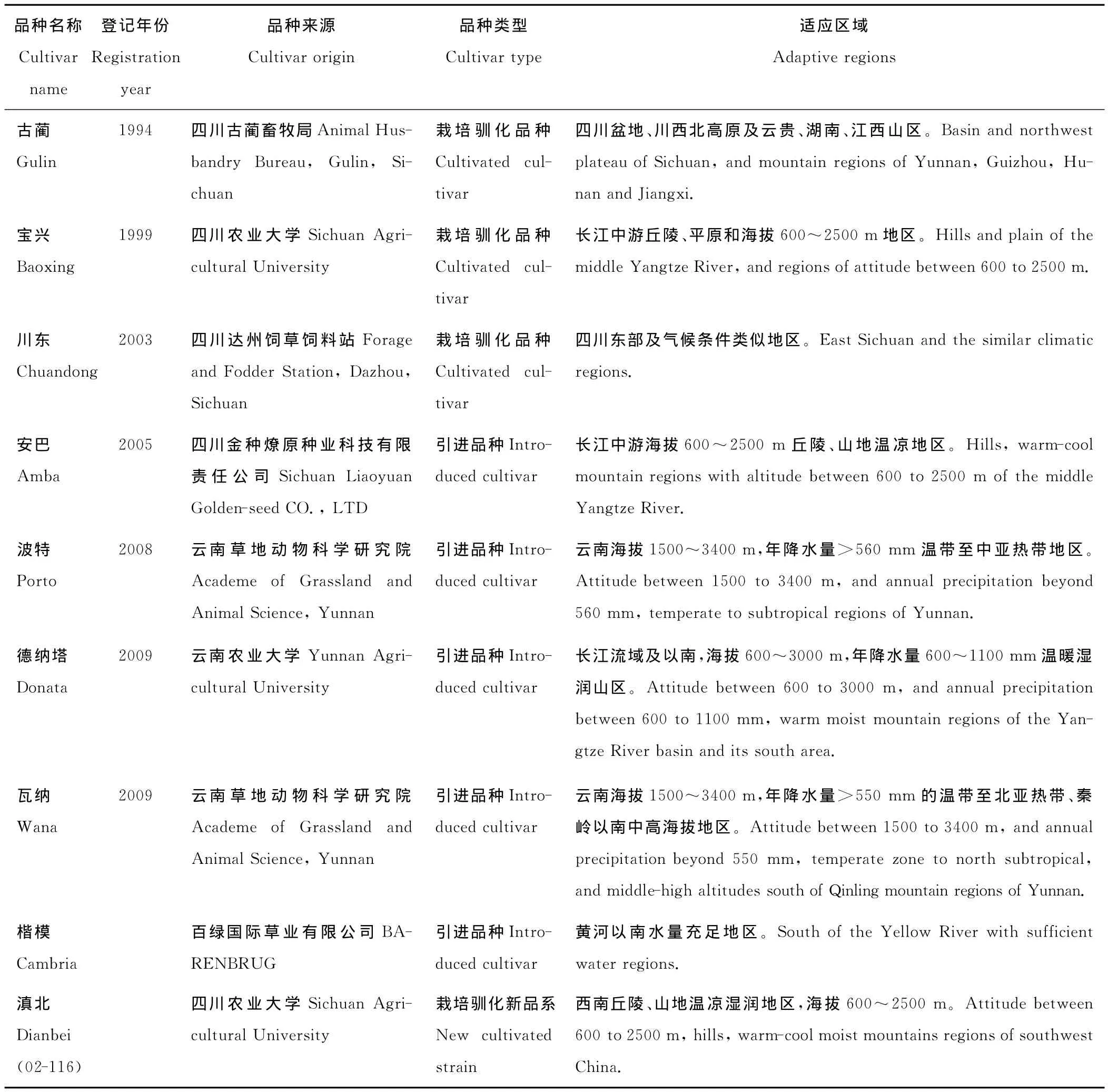
表1 供试鸭茅品种信息Table 1 Information of D.glomeratacultivars used in this study
1.3 试验地管理
对供试鸭茅品种培养皿发芽,之后盆钵育苗,待幼苗长到3片叶龄,移栽到试验基地。移栽前人工除杂,清除石块、铁屑等杂物。土地翻耕深度25~30cm,耕后耙平,土块细碎,土块直径≤1.5cm,地面平整,墒情好。移栽前施基肥,基肥为人畜粪尿,充分腐熟。本研究采用单因素随机区组,重复6次,每个重复10个单株,株行距50 cm×1m,播后覆土1~2cm,四周种植单株保护行‘宝兴’,与试验小区设计一致。试验地行间以排水沟间隔,实行统一管理。
1.4 观测指标
本研究所有观测指标均以品种单株为单位,在2012—2013年整个生育期观测的指标包括:物候期、抗锈病能力、越夏率、生长速度、单株鲜草产量、干草产量、鲜草茎叶比、干草茎叶比、鲜干比、分蘖数、植物学表型性状及DUS性状。其中,表型性状每个品种180个重复,DUS性状每个品种6个重复,其余测定指标每个品种60个重复。
1)物候期观测:主要记录对鸭茅品种生产性能起决定性作用的3个时期(抽穗期、开花期、完熟期),各品种物候期均以单株进入该时期为准[17]。
2)抗锈病能力观测:对每个自然发病的鸭茅品种单株进行病情分级[18],标准如下:
0:无病状;
1:叶片上只有少数几个孢子堆;
3:孢子堆面积占叶面积10%以下;
5:孢子堆面积占叶面积10%~25%;
7:孢子堆面积占叶面积25%~50%;
9:孢子堆面积占叶面积50%以上。
病情指数(disease index,DI)计算公式为:DI=∑(si×ni)×100/9N,其中:si为发病级别;ni为相应发病级的植株数;i为病情分级的各个级别;N为调查总株数。
品种群体对锈病的抗性依据病情指数分为6级:
6:高抗(highly resistance,HR)(0≤DI<15);
5:抗病(resistance,R)(15≤DI<30);
4:中抗(moderate resistance,MR)(30≤DI<50);
3:中感(moderate susceptibility,MS)(50≤DI<70);
2:感病(susceptibility,S)(70≤DI<80);
1:高感(highly susceptibility,HS)(DI≥80)[18]。
3)越夏率(summering rate,SR)观测:盛夏结束后,统计供试鸭茅品种单株存活株数,计算越夏率。公式为:SR(%)=(存活植株数/总株数)×100[19]。
4)生长速度测定:对每个鸭茅品种所有单株挂牌标记,测定分两个时期,即移栽后至冬季和春季返青后至抽穗期。
5)单株生物量、茎叶比、鲜干比、分蘖数测定:每次在盛夏时刈割,留茬高度5cm,用感量0.1kg的秤称重,称取后将茎、叶(含花序)分开,编号称重,计算鲜茎叶比,茎叶比=总茎质量/总叶质量,然后置于烘箱中,先105℃杀青30min,再65℃烘干12h,取出放置室内冷却24h后称重,再放入烘箱65℃烘干8h,取出放置室内冷却回潮24h后称重,直至两次称重之差不超过2.5g为止。计算干茎叶比、干生物量和鲜干比。每次刈割后就地测定所有单株分蘖数。
6)表型性状测定:于抽穗期测定,每个单株随机选取3枝,对株高、株幅、旗叶长度、倒二叶长度、节间长度、穗叶距、旗叶宽度、倒二叶宽度和茎粗、茎上部节间长度、花序长度、花序宽度12个指标进行测定,利用游标卡尺和直尺等工具。
7)DUS性状观测:主要包括叶片细密程度、叶片绿色程度、植株生长习性、花序抽出度、形成花序趋势、小穗密度、颖片花青甙显色7个性状,测定方式为重复间群体目测(http://www.upov.int/edocs/tgdocs/fr/tg031.pdf)。
1.5 数据分析
利用Excel 2007和SPSS 19.0软件对观测性状的变异程度、规律及性状间相关关系进行统计和分析,利用隶属函数法对供试鸭茅品种的农艺性状进行综合排序[20-21]。
2 结果与分析
2.1 鸭茅品种物候期观测
本研究采用培养皿发芽移栽,各鸭茅品种生育期计算始于9月1日,对各个品种单株物候期观测后统计分析的结果表明,供试鸭茅品种主要分为早、中和晚熟3个类型(表2)。其中,‘古蔺’、‘宝兴’、‘川东’、‘波特’、‘02-116’属早熟型,3月中旬左右抽穗,4月上旬开花,5月中旬左右完熟,生育期260d左右,植株较为高大;‘安巴’、‘瓦纳’和‘楷模’为中熟型,4月上旬抽穗,中旬开花,5月下旬完熟,生育期270d左右;‘德纳塔’为晚熟型,5月上旬抽穗,中旬开花,6月下旬完熟,生育期301d。中、晚熟型鸭茅品种植株较为低矮,株型多为半直立或平卧型。各品种生育期排序为:宝兴<川东<古蔺<波特<02-116<楷模<瓦纳<安巴<德纳塔(表2)。

表2 供试鸭茅品种生育期记录Table 2 The record of growth period for D.glomeratacultivars
2.2 鸭茅品种抗锈病能力和越夏能力分析
鸭茅为锈病多发植物,对锈病的了解和有效掌控有助于提高鸭茅品种产量和品质[18]。根据曾兵等[18]的统计分析方法,对供试各鸭茅品种的抗锈病能力分析的结果表明,品种‘德纳塔’抗锈病能力最强(DI=30.4,MR),其次为‘02-116’(DI=35.6,MR),而品种‘安巴’(DI=67.4,MS)和‘瓦纳’(DI=68.9,MS)抗锈病能力较差,各品种的抗锈病能力排序为:瓦纳<安巴<宝兴<川东<楷模<波特<古蔺<02-116<德纳塔。
我国南方多为高温高湿气候,充分了解鸭茅各品种的越夏情况,有助于选育出适合我国生长的耐热高产鸭茅品种[19]。盛夏结束后,对各鸭茅品种单株越夏率统计分析的结果表明,品种‘波特’越夏率较高(SR=80.00%),其次为‘02-116’(SR=75.00%),品种‘安巴’(SR=36.67%)越夏率较差,各品种越夏率排序为:安巴<瓦纳<古蔺<宝兴<德纳塔=楷模<川东<02-116<波特(图1)。
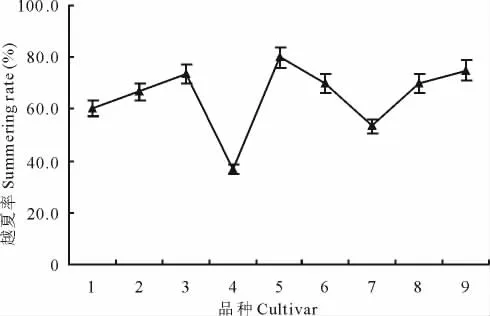
图1 鸭茅品种的越夏率Fig.1 The result of summering rate for D.glomeratacultivars
2.3 鸭茅品种生产性能分析
对供试各鸭茅品种的生长动态分析表明,鸭茅品种在秋季入冬前生长均较为缓慢,各品种间差异较小,在春季返青后,鸭茅品种生长变化较为迅速,品种间差异较为明显(图2)。在所有供试9个鸭茅品种(系)中,新品系‘02-116’生长速度变化最快,拉伸高度最大,株型为直立型;而品种‘德纳塔’、‘安巴’、‘瓦纳’等生长较为缓慢,植株拉伸高度小,株型为平卧型。各品种生长速度排序为:德纳塔<瓦纳<安巴<楷模<波特<古蔺<川东<宝兴<02-116(图2)。
对供试各鸭茅品种草产量结果分析表明,无论是鲜草产量或干草产量,品系‘02-116’均位居第一,高于其他鸭茅品种,表现出较为优异的生产潜能和推广价值,与其他鸭茅差异较为明显,品种‘安巴’和‘瓦纳’鲜草产量较低,‘安巴’干草产量较低(图3)。总体来说,各品种鲜草产量变幅大于干草产量。各品种鲜草产量排序为:安巴<瓦纳<古蔺<楷模<川东<宝兴<波特<德纳塔<02-116(图3),干草产量排序为:安巴<瓦纳<楷模<古蔺<德纳塔<川东<波特<宝兴<02-116(图3)。

图2 鸭茅品种生长速度变化动态Fig.2 The dynamic change of growth speed for D.glomeratacultivars
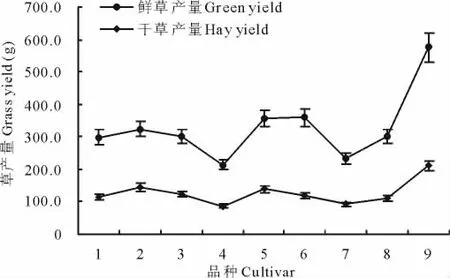
图3 鸭茅品种草产量分布Fig.3 The distribution of grass yield for D.glomeratacultivars
对鸭茅品种鲜干比的正确把握,有助于提高鸭茅品种的利用效率,有力推动我国畜牧业发展。对本研究供试鸭茅品种鲜干比、鲜茎叶比、干茎叶比的结果分析表明,各鸭茅品种鲜干比差异明显,‘02-116’和‘德纳塔’鲜干比值较为突出,表明其柔嫩多汁,‘宝兴’和‘川东’鲜干比值较低,各品种鲜干比排序为:宝兴<川东<古蔺<瓦纳<楷模<波特<安巴<德纳塔<02-116(图4)。同时,各品种间鲜、干茎叶比排序一致,差异明显。其中,‘宝兴’、‘波特’、‘川东’等鲜干茎叶比值较大,表明其茎含量较大,适口性较其他几个品种可能相对较差,以‘宝兴’表现最差,而‘安巴’、‘德纳塔’鲜干茎叶比值较低,表明其草质柔嫩,适口性可能较好,各品种鲜、干茎叶比排序为:安巴<德纳塔<瓦纳<楷模<02-116<古蔺<川东<波特<宝兴(图4),这将有助于我们在未来的鸭茅品种选育工作中,有针对性地改良鸭茅品种适口性。
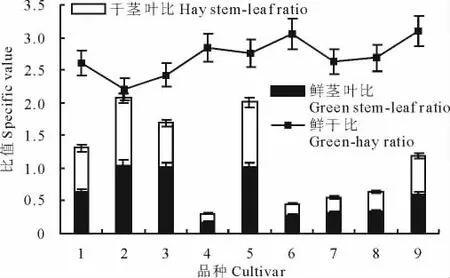
图4 鸭茅品种茎叶比和鲜干比Fig.4 The result of stem-leaf ratio,green-hay ratio for D.glomeratacultivars

图5 鸭茅品种的分蘖数Fig.5 The tiller numbers of D.glomeratacultivars
各品种分蘖数与其再生性和生产性能息息相关。对各鸭茅品种刈割后测得的分蘖数统计分析表明,‘02-116’分蘖较高,其次为‘德纳塔’,表明上述2个品种再生性好,生长能力强,而品种‘瓦纳’和‘安巴’分蘖较少,分蘖能力相对较差,产量较低,各品种分蘖数排序为:瓦纳<安巴<川东<古蔺<宝兴<波特<楷模<德纳塔<02-116(图5)。
2.4 鸭茅品种表型性状变异分析
2.4.1 鸭茅品种表型性状方差分析 采用SPSS 19.0对不同鸭茅品种各性状进行单因素方差分析,在方差齐性检验显示各样本所在总体方差齐的前提下,F检验表明,测定的12个表型性状在品种间差异均达极显著(P<0.01)。通过比较,发现株高在12个性状指标中F值最大(51.785),倒二叶长度F值最小(2.986),各性状指标差异度为:倒二叶长度<株幅<旗叶长度<节间长度<茎粗<花序宽度<花序长度<旗叶宽度<倒二叶宽度<茎上部节间长度<穗叶距<株高(表3)。

表3 供试鸭茅品种各性状的平均值、标准差和F值Table 3 Mean,standard deviation(SD),and F-value in morphological characters of D.glomeratacultivars cm
采用Excel 2007计算不同鸭茅品种各性状变异系数,结果表明,在测得的12个表型性状中,穗叶距、花序宽度和节间长度在所有鸭茅品种间变异幅度最大,变异系数分别为106.20%,44.10%,43.52%,其次为茎上部节间长度、花序长度、茎粗、旗叶长度、旗叶宽度和倒二叶宽度,变异系数分别为36.92%,28.34%,28.22%,25.09%,24.47%,24.04%,变异幅度最小的为株高、株幅和倒二叶长度,变异系数分别为23.24%,23.06%,21.64%(表4)。对不同鸭茅品种内部表型性状变异分析表明,12个性状平均变异系数为0.2768(宝兴)~0.6146(德纳塔),排序为:宝兴<波特<川东<02-116<古蔺<楷模<瓦纳<安巴<德纳塔,其值在鸭茅品种内各不相同,表明在不同鸭茅品种的不同单株内存在大小各异的变异,这与鸭茅为异花授粉植物的特性密不可分[22],同时为鸭茅新品种选育提供了较为丰富的优异亲本材料(表4)。
2.4.2 鸭茅品种表型性状相关分析 对供试鸭茅品种各个表型性状相关分析表明,供试品种性状间存在明显的相关性(表5)。其中,株高与株幅、节间长度、穗叶距、旗叶宽度、倒二叶宽度、茎上部节间长度呈显著正相关;株幅与倒二叶宽度、茎上部节间长度呈显著正相关;旗叶长度与倒二叶长度、花序长度呈显著正相关;节间长度与穗叶距、倒二叶宽度、茎上部节间长度呈显著正相关;穗叶距与旗叶宽度、倒二叶宽度、茎上部节间长度呈显著正相关;旗叶宽度与倒二叶宽度、茎粗、茎上部节间长度、花序宽度呈显著正相关;倒二叶宽度与茎粗、茎上部节间长度呈显著正相关;花序长度与花序宽度呈显著正相关。数据表明,叶片长又宽的鸭茅,植株高大,节间长,穗叶距长,花序长,反之亦然。综合各营养器官来看,对鸭茅产量影响较大的性状依次为穗叶距(0.480**)、株高(0.397**)、茎上部节间长度(0.313*)、倒二叶宽度(0.243*)、株幅(-0.266*),对分蘖影响较大的性状依次为草产量(0.743**)、穗叶距(0.423**)、倒二叶宽度(0.329**)、株高(0.318**)、茎粗(0.259*)、节间长度(0.291*),表明植株高大且叶片宽大的植株,草产量相对较高(表5)。
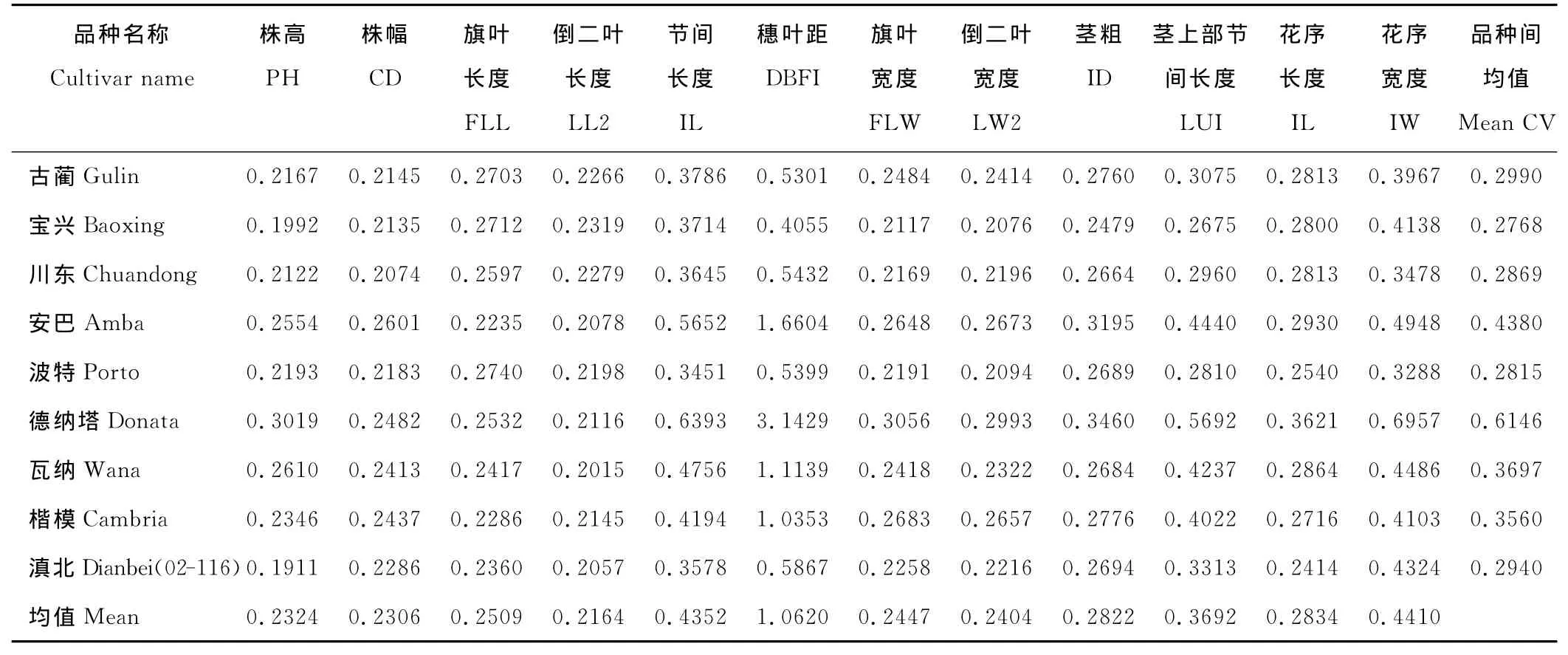
表4 供试鸭茅不同品种各性状的变异系数Table 4 The coefficients of variation(CV)of agronomic characters among D.glomeratacultivars
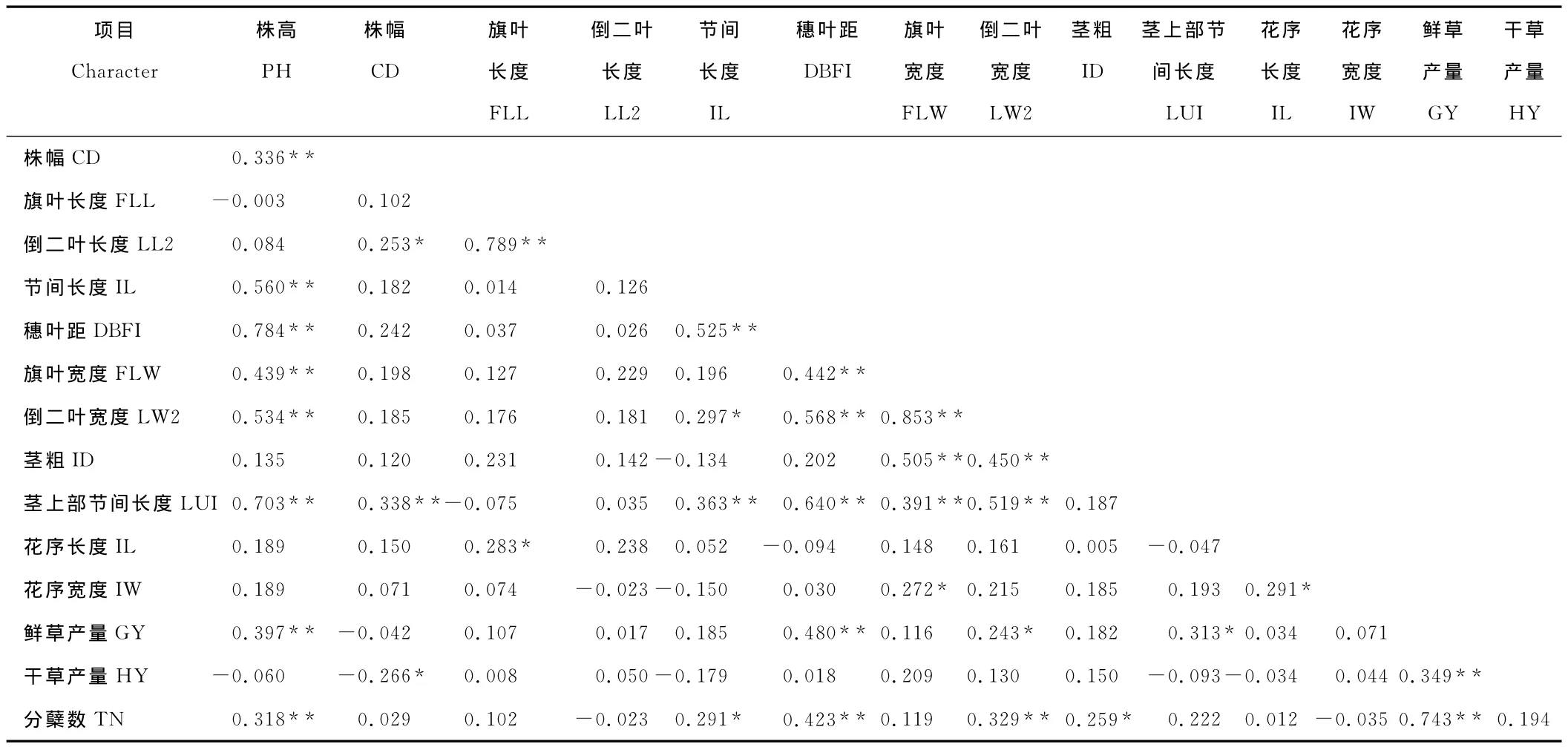
表5 供试鸭茅品种不同性状的相关关系Table 5 The coefficient among different agronomic characters for D.glomeratacultivars
2.4.3 鸭茅品种表型性状主成分分析 对鸭茅品种12个表型性状的主成分分析结果表明,在12个考察因子中,特征值大于1的为前4个主成分,累计贡献率达68.225%,反映了总体数据的大部分信息。其中,第1主成分占比30.594%,株高、穗叶距、倒二叶宽度、旗叶宽度对其作用较大,反映了决定鸭茅植株株型的大部分因素;第2主成分占比16.947%,旗叶长度、倒二叶长度对其作用较大,反映了决定株高的部分因素;第3主成分占比11.108%,倒二叶长度、节间长度对其作用较大(表6,表7)。

表6 鸭茅品种12个形态指标主成分的特征值、贡献率和累积贡献率Table 6 Eigenvalue,contribution rate and accumulative contribution rate of D.glomeratacultivars
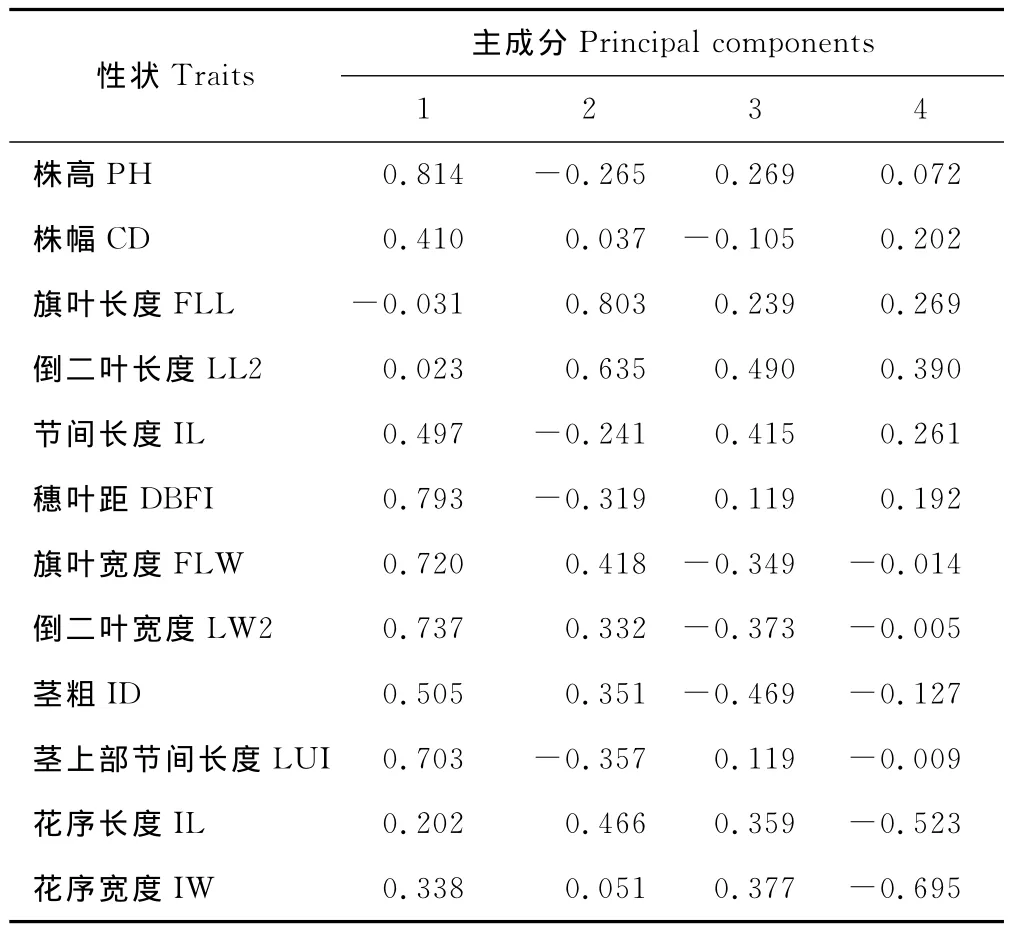
表7 鸭茅品种12个形态指标对前4个主成分的因子负荷矩阵Table 7 Component matrix among D.glomeratacultivars
2.5 鸭茅品种DUS性状变异分析
对各供试鸭茅品种DUS性状群体目测后的结果分析表明,各鸭茅品种在7个DUS性状上均表现出不同程度的群体差异,其中,叶片细密程度、叶片绿色程度、颖片花青甙显色差异较小,以‘02-116’特征表现较为明显,其叶片颜色较深,且存在较深的颖片花青甙显色,而品种‘古蔺’的颖片花青甙显色较浅;其余4个DUS性状在各品种间差异相对较大,‘安巴’、‘德纳塔’、‘瓦纳’株型为中间到半平卧,‘楷模’为半直立,其余品种均为直立型;品种‘瓦纳’、‘德纳塔’、‘安巴’在花序抽出度、形成花序趋势、小穗密度3个性状表现较差,较其余品种相对较弱。综上,品系‘02-116’植株高大,株型为直立型,叶色深,花序抽出度良好且小穗密度高,形成花序趋势强,颖片有花青甙显色,可区别于其他已登记鸭茅品种(表8)。
2.6 ‘02-116’新品系与品种‘川东’、‘古蔺’主要形态差异分析
综合本研究结果发现,新品系‘02-116’可有效区别于其他已登记的鸭茅品种,且其与鸭茅品种‘川东’、‘古蔺’主要形态差异有:1)从分蘖看,‘02-116’(159个)高于‘川东’(99个)、‘古蔺’(102个);从生长速度看,‘02-116’前期生长较快,分蘖等主要表型性状研究表明品种间差异达到显著水平(表3,表9);2)‘02-116’与‘川东’、‘古蔺’相比,基生叶叶量更丰富,叶片宽大;3)从抗锈病能力看,‘02-116’与‘川东’、‘古蔺’相比,表现较抗;‘02-116’株高高于‘川东’、‘古蔺’,抽穗开花期时平均约高10cm;4)从抽穗期看,‘02-116’比‘川东’、‘古蔺’约晚5~7d;5)‘02-116’较“川东”、‘古蔺’有较深的叶色和较明显的颖片花青甙显色。9分制研究结果表明,‘02-116’较深(8)、‘古蔺’较浅(4)、‘川东’极浅(1)(表9)。

表8 鸭茅品种DUS性状Table 8 The distinctness,uniformity and stability characters of D.glomeratacultivars
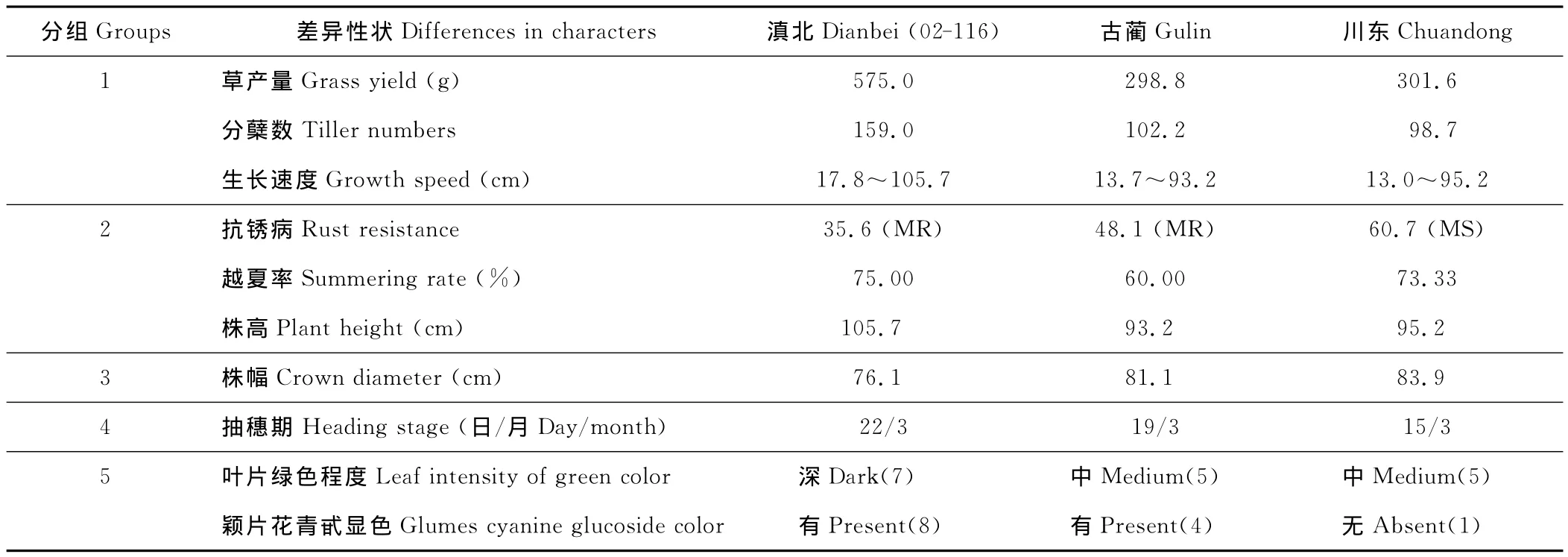
表9 鸭茅新品系‘02-116’与品种‘古蔺’、‘川东’主要差异Table 9 The differences of new D.glomeratastrain 02-116between cultivars Gulin and Chuandong
2.7 鸭茅品种综合评价
在本研究中,采用隶属函数统计法[20-21],对与鸭茅品种产量相关指标结果进行统计,主要包括生育期、抗锈病能力、越夏率、生长速度、鲜草产量、干草产量、鲜干比、鲜茎叶比、干茎叶比、分蘖数、株高、株幅、穗叶距、倒二叶宽度、茎上部节间长度等,各供试鸭茅品种关于生产性能、抗性、牧草质量等的综合排序表明,新品系‘02-116’表现较为优异,具有潜在的生产能力和推广价值。
3 讨论
3.1 供试鸭茅品种农艺性状总体评价
优良牧草在畜牧发展中必不可少。将牧区优良牧草与农区优良家畜互作耦合系统,可促进生产力和系统循环效率的提高,保障食物安全[23];另外,以优良牧草为基础,发展禾-豆混播草地,建立优质高产人工草地,对遏制全球气候变化有积极作用[24]。本研究中,供试鸭茅品种(系)在物候期、抗锈病能力、越夏率、生长动态、草产量、鲜干比、茎叶比、分蘖数等性状差异明显,可主要划分为早、中和晚熟3个类型,在生产应用上,可根据不同的市场需求和畜牧业发展状况选取不同的鸭茅品种。同时,各供试鸭茅品种(系)关于抗性、越夏率、牧草质量、分蘖等的综合排序表明,新品系‘02-116’表现较优,其具有较高的抗锈病能力和越夏率,植株拉伸高度增幅大,分蘖多,鲜草产量和干草产量均较高,草质较为柔嫩,且品种特征较为明显,这与蒋林峰等[25]的研究结果较为一致,证明我国鸭茅新品系‘02-116’较之前的栽培驯化品种有更为丰富的遗传变异度,可作为优质多年生牧草用于我国西南地区的草地生态建设。
3.2 供试鸭茅品种表型性状比较分析
表型多样性是遗传多样性的基础[26],可进一步为鸭茅种质资源的遗传育种提供参考。本研究中,供试鸭茅不同品种(系)间存在丰富的遗传变异,且不同性状指标在材料间差异不平衡,即各性状对相同生境因子影响的反应不同,各性状间相关性强。其中,穗叶距变异最大,茎上部节间长度和花序长度次之,而株高、株幅和倒二叶长度变异较小。同时,不同品种间变异幅度也各有差异。另外,在营养器官各性状间,株高与株幅、节间长度、穗叶距、旗叶宽度、倒二叶宽度、茎上部节间长度显著正相关,叶片长又宽的鸭茅,植株高大,节间长,穗叶距长,花序长,这与彭燕等[13]对25份鸭茅种质形态变异研究的结果相似。因而,在具体育种时,可结合不同表型性状,有目的地进行目标性状早期选育,并对每个亲本材料的综合指标优劣进行具体分析与评价,依据鸭茅育种目标,结合DUS性状,合理选配组合,以便更快选育出不同类型鸭茅新品种。
3.3 鸭茅品种综合利用和新品种选育
主成分分析可将多个变量化为少数,从而达到简化分析,更好描述总变异构成特征的目的[27]。本研究对鸭茅品种的12个表型性状做主成分分析,前4个主成分累计贡献率达68.225%,是鸭茅品种变异的主要因素,且其达到了降维的目的,从而降低了对不同鸭茅品种性状考察的难度,如不同主成分在不同程度上决定了鸭茅植株株型、株高及生长速度动态变化等。另外,主成分的排序对于育种的亲本材料选配具有积极作用[28],在今后鸭茅品种选育中,应以提高抗性等为出发点带动鸭茅品种产量提高和品质改良[29],挖掘具有更多表型变异的鸭茅种质资源,选用更多表型变异指标(营养器官、生殖器官等),借鉴国外品种选育思路,集中于抗寒、抗病、耐雾及抗热[30],采用核型分析、分子标记、基因工程等多样化育种手段,培育出能适应我国生境的特色品种(耐热、耐瘠薄、抗旱、抗病等),及不同生长模式的鸭茅品种(早熟、中熟、晚熟),以解决我国草畜矛盾突出,饲草供应不平衡,西部退耕还林还草工程中优良牧草种源匮乏等问题。
4 结论
本研究通过对我国鸭茅品种(系)物候期、抗锈病能力、越夏率、生长速度、生产性能、表型性状和DUS性状的系统研究得出,各鸭茅品种(系)在表型水平遗传变异丰富,品种(系)间性状差异较为明显,综合排序表明,新品系‘02-116’在生产性能、抗性等表现均较为优越,可有效区别于其他已登记的鸭茅品种,是有潜力的鸭茅新品系。
Reference:
[1]Lindner R,Garcia A.Geographic distribution and genetic resources ofDactylisin Galicia(northwest Spain).Genetic Resources and Crop Evolution,1997,44:499-507.
[2]Bushman B S,Larson S R,Tuna M,etal.Orchardgrass(DactylisglomerataL.)EST and SSR marker development,annotation,and transferability.Theoretical and Applied Genetics,2011,123:119-129.
[3]Peng Y,Zhang X Q.Progress in studies on genetic diversity ofDactylisglomerataL.Journal of Plant Genetic Resources,2003,4(2):179-183.
[4]Zeng B,Zhang X Q,Lan Y.Optimal of ISSR marker inDactylisglomerataL.Acta Agrestia Sinica,2007,15(3):290-292.
[5]Gao Y,Zhang X Q,Xie W G.Evaluation of nutritive value of new lines ofDactylisglomerataL.Acta Agrestia Sinica,2009,17(2):222-226.
[6]Atienza S G,Satovic Z,Petersen K K,etal.Identification of QTLs influencing agronomic traits inMiscanthussinensisAnderss.I.total height,flag-leaf height and stem diameter.Theoretical and Applied Genetics,2003,107(1):123-129.
[7]Liu C J.Geographical distribution of genetic variation inStylosanthesscabrarevealed by RAPD analysis.Euphytica,1997,98(1-2):21-27.
[8]Amirouche N,Misset M T.Morphological variation and distribution of cytotypes in the diploid-tetraploid complex of the genusDactylisL.(Poaceae)from Algeria.Plant Systematics and Evolution,2007,264(3-4):157-174.
[9]Sugiyama S.Geographical distribution and phenotypic differentiation in populations ofDactylisglomerataL.in Japan.Plant Ecology,2002,169(2):295-305.
[10]Lindner R,Lema M,Garcia A.Ecotypic differences and performance of the genetic resources of cocksfoot(DactylisglomerataL.)in northwest Spain.Grass and Forage Science,1999,54(4):336-346.
[11]Jochner S,Ziello C,Böck A,etal.Spatio-temporal investigation of flowering dates and pollen counts in the topographically complex Zugspitze area on the German-Austrian border.Aerobiologia,2012,28(4):541-556.
[12]Casler M D,Fales S L,McElroy A R,etal.Genetic progress from 40years of orchardgrass breeding in North America measured under hay management.Crop Science,2000,40(4):1019-1025.
[13]Peng Y,Zhang X Q,Zeng B.A study on variations of morphologic features ofDactylisglomerata.Acta Prataculturae Sinica,2007,16(2):69-75.
[14]Zhong S,Huang M F,Duan X H.The wildDactylisglomeratagermplasm resources of Hengduan Mountains in southwest China.Journal of Plant Genetic Resources,2010,11(1):1-4.
[15]Xu Q,Cai H W,Liu Y S,etal.Introduction and primarily evaluation on 16cooksfoot accessions collected from abroad.Pratacultural Science,2011,28(4):597-602.
[16]Zhong S.The agronomic characters of the hybrid progeny of wildDactylisglomerata.Acta Prataculturae Sinica,2007,16(1):69-74.
[17]Xie W,Robins J G,Bushman B S.A genetic linkage map of tetraploid orchardgrass(DactylisglomerataL.)and quantitative trait loci for heading date.Genome,2012,55(5):360-369.
[18]Zeng B,Lan Y,Wu L.The rust resistance research of Chinese natural orchardgrass germplasm.Journal of Plant Genetic Resources,2010,11:278-283.
[19]Yan H D,Zhang X Q,Zeng B,etal.Evaluating rust resistance and field investigating over-summer conditions of orchardgrass(Dactylis glomerataL.)germplasms.Acta Agrestia Sinica,2013,21(4):720-728.
[20]Han R H,Lu X S,Gao G J,etal.Analysis of the principal components and the subordinate function of alfalfa drought resistance.Acta Agrestia Sinica,2006,14(2):142-146.
[21]Shi Y H,Wan L Q,Liu J N,etal.Analysis of the principal components and the subordinate function ofLoliumperennedrought resistance.Acta Agrestia Sinica,2010,18(5):669-672.
[22]Xie W G,Zhang X Q,Cai H W,etal.Genetic diversity analysis and transferability of cereal EST-SSR markers to orchardgrass(Dactylis glomerataL.).Biochemical Systematics and Ecology,2010,38(4):740-749.
[23]Tang J,Lin H L.Analysis of characteristics of the circular economy of grassland farming.Acta Prataculturae Sinica,2013,22(1):167-175.
[24]Xie K Y,Zhao Y,Li X L,etal.Relationships between grasses and legumes in mixed grassland:a review.Acta Prataculturae Sinica,2013,22(3):284-296.
[25]Jiang L F,Zhang X Q,Huang L K,etal.Analysis of genetic diversity in a cocksfoot(Dactylisglomerata)variety using SCoT markers.Acta Prataculturae Sinica,2014,23(1):229-238.
[26]Yu W L,Zhang B.A study on morphological variation of pods and seeds ofMedicagofalcatecollected from Zhaosu,Xinjiang.Acta Prataculturae Sinica,2012,21(2):249-255.
[27]Yan X B,Zhou H,Wang K,etal.Morphological diversities of the different species ofElymusspp and their principal component analysis.Acta Agrestia Sinica,2005,13(2):111-116.
[28]Liang X Y,Zhang X Q,Bai S Q,etal.Multiple statistical analysis of the phenotypic characters ofCichoriumintybus.Acta Prataculturae Sinica,2013,22(6):257-267.
[29]Miller T L.Evaluation of material selected for rust resistance in orchardgrass,Dactylisglomerata.Dissertation Abstracts International,1976,36(7):3159.
[30]Peng Y,Zhang X Q.Progress on physiology,ecology and reproduction ofDactylisglomerata.Acta Prataculturae Sinica,2005,14(4):8-14.
[1]彭燕,张新全.鸭茅种质资源多样性研究进展.植物遗传资源学报,2003,4(2):179-183.
[4]曾兵,张新全,兰英.鸭茅ISSR反应体系的建立与优化(简报).草地学报,2007,15(3):290-292.
[5]高杨,张新全,谢文刚.鸭茅的营养价值评定.草地学报,2009,17(2):222-226.
[13]彭燕,张新全,曾兵.野生鸭茅植物学形态特征变异研究.草业学报,2007,16(2):69-75.
[14]钟声,黄梅芬,段新慧.中国两南横断山区的野生鸭茅资源.植物遗传资源学报,2010,11(1):1-4.
[15]徐倩,才宏伟,刘艺杉,等.16个国外鸭茅种质材料引种与初步评价.草业科学,2011,28(4):597-602.
[16]钟声.野生鸭茅杂交后代农艺性状的初步研究.草业学报,2007,16(1):69-74.
[18]曾兵,兰英,伍莲.中国野生鸭茅种质资源锈病抗性研究.植物遗传资源学报,2010,11:278-283.
[19]严海东,张新全,曾兵,等.鸭茅种质资源对锈病的抗性评价及越夏情况的田间调查.草地学报,2013,21(4):720-728.
[20]韩瑞宏,卢欣石,高桂娟,等.紫花苜蓿抗旱性主成分及隶属函数分析.草地学报,2006,14(2):142-146.
[21]石永红,万里强,刘建宁,等.多年生黑麦草抗旱性主成分及隶属函数分析.草地学报,2010,18(5):669-672.
[23]唐静,林慧龙.草地农业的循环经济特征分析.草业学报,2013,22(1):167-175.
[24]谢开云,赵云,李向林,等.豆-禾混播草地种间关系研究进展.草业学报,2013,22(3):284-296.
[25]蒋林峰,张新全,黄琳凯,等.鸭茅品种的SCoT遗传变异分析.草业学报,2014,23(1):229-238.
[26]于万里,张博.新疆昭苏野生黄花苜蓿果实形态变异研究.草业学报,2012,21(2):249-255.
[27]严学兵,周禾,王堃,等.披碱草属植物形态多样性及其主成分分析.草地学报,2005,13(2):111-116.
[28]梁小玉,张新全,白史且,等.菊苣主要表型性状的多元统计分析.草业学报,2013,22(6):257-267.
[30]彭燕,张新全.鸭茅生理生态及育种学研究进展.草业学报,2005,14(4):8-14.

