BNIP3表达载体转染对胃癌细胞株SGC-7901生物学行为的影响
李能莲,张立,张秋菊,李长天,舍雅莉,骆亚莉
(甘肃中医学院,甘肃兰州730000)
BNIP3表达载体转染对胃癌细胞株SGC-7901生物学行为的影响
李能莲,张立,张秋菊,李长天,舍雅莉,骆亚莉
(甘肃中医学院,甘肃兰州730000)
目的观察BcL-2与腺病毒E1B 19KDa相互作用蛋白3(BNIP3)高表达对胃癌细胞SGC-7901的增殖以及对化疗药物敏感性的影响。方法免疫细胞化学法筛选BNIP3表达阴性或表达相对较低的胃癌细胞株;BNIP3真核表达载体pcDNA3.1-BNIP3-FLAG通过脂质体转染胃癌细胞;Western blot进行鉴定;MTT法和克隆形成实验检测转染细胞的增殖情况;MTT法检测转染细胞对常规化疗药5-氟尿嘧啶(5-Fu)的敏感性。结果SGC-7901和BGC-823细胞均有BNIP3表达,表达水平SGC-7901低于BGC-823(P<0.05);与未转染组和转染空载体pcDNA3.1组比较,转染pcDNA3.1-BNIP3-FLAG组BNIP3相对表达量显著增高(P<0.05),转染pcDNA3.1-BNIP3-FLAG组5-Fu的IC50值显著降低(P<0.05),细胞克隆形成率显著降低(P<0.05),细胞增殖速度减慢。结论BNIP3在胃癌细胞中高表达可抑制胃癌细胞SGC-7901增殖,增强细胞对化疗药物5-Fu的敏感性。
BNIP3;胃癌;SGC-7901;转染
分子靶向治疗已成为当前肿瘤治疗研究的热点。Bcl-2与腺病毒E1B 19kDa相互作用蛋白3(bc1-2/adenovirus E1B 19kDa interacting protein3,BNIP3)是Bcl-2家族促凋亡蛋白。许多研究发现在胰腺癌[1]和一些造血系统[2]、结肠直肠[3]、胃[4]部恶性肿瘤中BNIP3表达下调,且与肿瘤的不良预后有关。我们在前期研究中也已经证实,BNIP3在胃癌组织中表达下调,致使瘤细胞得以生存[5,6],提示BNIP3低表达或失活在恶性肿瘤的发生发展中发挥了重要作用。如果BNIP3恢复表达或使其过表达,则有可能促进肿瘤细胞凋亡,还可能逆转肿瘤耐药。本实验拟通过筛选BNIP3表达相对较低的胃癌细胞株,应用BNIP3表达载体转染以增强BNIP3的表达,观察肿瘤细胞生物学行为的变化(如增殖、凋亡等),探讨以BNIP3为靶点治疗胃癌的可行性。
1 材料和方法
1.1 材料
人胃癌细胞株SGC-7901,BGC-823(甘肃中医学院实验中心提供),RPMI1640细胞培养基(美国Gibco公司),小牛血清(杭州四季清公司),BCA蛋白浓度试剂盒(上海碧云天公司),BNIP3鼠抗人单克隆抗体(英国Abcam公司),羊抗鼠IgG、鼠单抗β-actin(美国Sigma公司),二甲基四氮唑蓝(MTT,美国Sigma公司),5-氟尿嘧啶(5-Fu,天津金耀氨基酸公司),SP-免疫细胞化学试剂盒(北京中杉金桥公司),G418(德国Merk公司),阳离子脂质体LipofectamineTM2000(美国Invitrogen公司),BNIP3表达载体pcDNA3.1-BNIP3-FLAG(美国匹兹堡大学艾军魁博士构建并惠赠,pcDNA3.1质粒具有新霉素抗性基因)。
1.2 方法
1.2.1 细胞培养分别将人胃癌细胞株SGC-7901、BGC-823培养于RPMI1640细胞培养液,常规37℃、5%CO2培养箱中培养。取对数生长期的细胞用于实验。
1.2.2 免疫细胞化学将对数生长期的SGC-7901、BGC-823细胞分别接种12孔板进行细胞爬片,按免疫细胞化学试剂盒说明书常规检测BNIP3在两种细胞中的表达。染色结果用计算机图像分析系统分析,选取BNIP3表达水平相对较低的细胞株进行下一步实验。
1.2.3 G418筛选浓度的确定将SGC-7901单细胞悬液接种于24孔板,G418按0、100~1 100 μg/ml的终浓度依次加入各孔中,各浓度设复孔,观察细胞的生长状况,以第10天细胞全部死亡的最低浓度为G418的筛选浓度。
1.2.4 基因转染实验分3组:BNIP3表达载体pcDNA3.1-BNIP3-FLAG转染组、空载体pcDNA3.1转染组和非转染组。按LipofectamineTM2000试剂盒中的说明书进行转染。稳定转染后的各组细胞分别命名为SGC-7901-BNIP3+、SGC-7901-neo、SGC-7901。
1.2.5 Western blot检测BNIP3的表达蛋白提取和蛋白浓度测定按试剂盒说明书进行,Western blot检测按常规操作程序进行,转膜后用5%脱脂奶粉封闭,一抗为鼠抗人BNIP3单克隆抗体(1∶800),二抗为辣根酶标记山羊抗兔IgG(1∶5 000),DAB显色,β-actin为内参照。晾干的NC膜用Mcrotec scanMaker E6系统扫描,Quantity One4.1图像分析软件测定各显色条带的积分吸光度D值,以目的蛋白/β-actin吸光度值表示。
1.2.6 MTT法检测细胞增殖将制成单细胞悬液的各组细胞,接种于96孔板,每组设6个复孔,培养至24 h、48 h、72 h、96 h、120 h时,MTT法常规染色,酶标仪检测波长490 nm处的光密度D(490)值,以培养时间为横坐标,每组平均D(490)值为纵坐标,绘制细胞生长曲线。
1.2.7 平板克隆形成试验检测细胞增殖将生长旺盛的各组细胞分别接种于直径为60 mm的培养皿,每组设3个平行皿,每皿依次含50、100、200个细胞,常规培养两周,培养皿中出现肉眼可见的细胞克隆时终止培养。乙醇固定,姬姆萨染色。将干燥后的培养皿倒置并叠加一张带网格的透明胶片,肉眼直接计数克隆数,计算克隆形成率:克隆形成率(%)=克隆数÷接种细胞数×100%。
1.2.8 MTT法检测各组细胞对5-Fu的敏感性SGC-7901细胞转染空质粒pcDNA3.1或重组质粒pcDNA3.1-BNIP3-FLAG 48 h后,接种于96孔板继续培养48 h,每组加入不同浓度(0、10、20、40、80、160、320 μg/ml)的5-Fu,每个浓度设3个复孔,并设空白对照孔。继续培养48 h后MTT法染色,酶标仪检测D(490)值。计算药物的细胞增殖抑制率,采用LOGIT法计算化疗药物IC50值。抑制率=[1-实验孔平均D(490)值÷对照孔平均D(490)值]×100%。
1.2.9 统计学处理采用SPSS 13.0统计软件进行t检验,实验数据以(±s)表示,P<0.05为差异有显著性。

图1 BNIP3在不同细胞质中的表达
2.1 免疫细胞化学
胃癌细胞SGC-7901、BGC-823的细胞质中均可见BNIP3表达,表达水平(A值)SGC-7901(0.164±0.233)明显低于BGC-823(0.392±0.163),P<0.05,见图1。
2.2 细胞转染结果
各组细胞经G418(筛选最低浓度为600 μg/ml)加压筛选8周后,BINP3表达载体pcDNA3.1-BNIP3-FLAG转染组和空载体pcDNA3.1转染组可见细胞克隆生长,而非转染组细胞全部死亡,细胞转染成功。
2.3 Western blot检测各组细胞中BNIP3表达
Western blot检测结果显示,SGC-7901、SGC-7901-neo、SGC-7901-BNIP3+组的BNIP3相对表达量分别为:(0.216± 0.067)、(0.279±0.012)、(0.974±0.005)。后者较前两组显著升高(P<0.05),前两组之间差异无显著性(P>0.05)。
2.4 MTT检测5-Fu敏感性
SGC-7901、SGC-7901-neo、SGC-7901-BNIP3+各组细胞5-Fu的IC50值分别为(60.13±3.44)、(53.40±3.71)、(26.08±1.68)μg/ml。与前两组比较,SGC-7901-BNIP3+组细胞5-Fu的IC50值显著降低(P<0.05)。
2.5 MTT法绘制细胞生长曲线
MTT法连续5 d检测各组细胞增殖情况,结果表明,SGC-7901-BNIP3+组细胞增殖能力明显低于SGC-7901-neo组和SGC-7901组(P<0.05)。后两组间细胞增殖能力差异无显著性(P>0.05),见图2。
2.6 平板克隆形成
SGC-7901、SGC-7901-neo、SGC-7901-BNIP3+组的克隆形成率分别为(29.20±2.48)%、(17.90±1.83)%、(10.07±1.33)%,前两组明显高于第三组(P<0.05),前两组间差异无显著性(P>0.05),见图3。
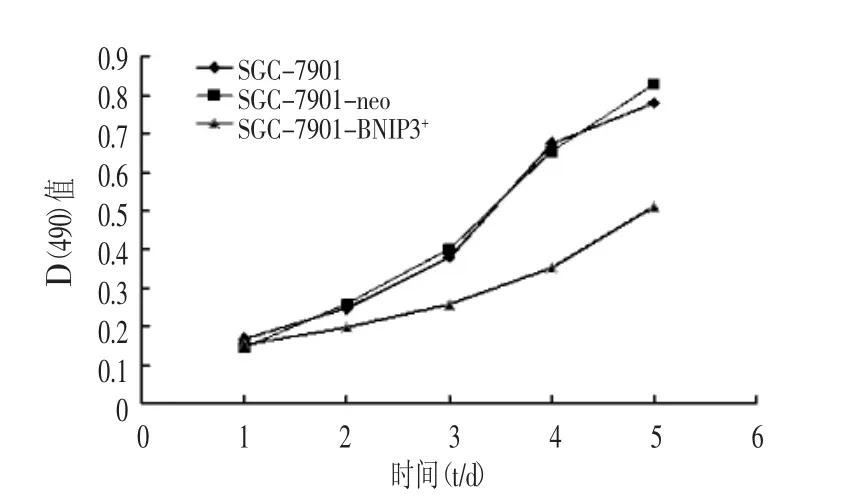
图2 各组细胞生长曲线

图3 各组克隆形成观察(接种细胞数:200个/皿)
2 结果
3 讨论
BNIP3是在酵母蛋白双杂交筛选中被发现的能与腺病毒E1B19kDa(一个Bcl-2的同系物)相互作用的促凋亡蛋白。在生理条件下,BNIP3低水平表达在骨骼肌和脑组织中[7],但在低氧条件下,BNIP3可以通过HIF信号通路被诱导表达,导致线粒体膜通透性转换孔(mitochondrial permeability transition pore,PTP)开放,消除质子电化学梯度,引起染色质凝聚,DNA损伤[8],从而诱导细胞凋亡。我们在前期研究中已经证实,BNIP3是HIF-1α的靶基因,而且在胃癌的发生过程中,BNIP3诱导表达属早期事件,一旦肿瘤发生,BNIP3在癌组织中的表达就会受到抑制(如被EGF、IGF等抑制[9])。
本实验通过转基因法,使低表达BNIP3的胃癌SGC-7901细胞恢复BNIP3表达或过表达,则SGC-7901细胞增殖能力显著降低,BNIP3高表达可以增加癌细胞对5-Fu的敏感性,说明化疗药物的增敏与BNIP3促进SGC-7901细胞的凋亡、抑制细胞增殖有关。这些结果提示,BNIP3表达下调致使胃癌细胞逃避低氧诱导的凋亡反应,可能是胃癌发生发展过程中的重要事件之一,BNIP3有可能成为靶向性药物攻击的重要环节。因此,对BNIP3在肿瘤中作用机制的进一步研究,将有助于建立个性化的肿瘤治疗方法。
[1]Erkan M,Kleeff J,Esposito I,et al.Loss of BNIP3 expression is alate event inpancreatic cancer contributing to chemoresistance and worsened prognosis[J].Oncogene,2005,24(27):4421-4432.
[2]Valdez B C,Murray D,Ramdas L,et al.Altered gene expression in busulfan-resistant human myeloid leukemia[J].Leuk Res,2008,32(11):1684-1697.
[3]Tang H,Liu Y J,Liu M,et al.Establishment and gene analysis of an oxaliplatin-resistant colon cancer cell line THC8307/L-OHP[J].Anticancer Drugs,2007,18(6):633-639.
[4]Murai M,Toyota M,Suzuki H,et al.Aberrant methylation and silencing of the BNIP3 gene in colorectal and gastric cancer[J].ClinCancerRes,2005,11(3):1021-1027.
[5]李能莲,张煦,樊平,等.BNip3在胃癌中的表达及意义[J].兰州大学学报:医学版,2007,33(1):40-42.
[6]李能莲,张煦.缺氧诱导因子及其应答基因BNIP3和血管内皮生长因子在胃腺癌中的表达及临床意义[J].中华肿瘤杂志,2008,30(1):44-47.
[7]Teralee R,Burton,Elizabeth S,et al.The pro-cell death Bcl-2 family member,BNIP3,is localized to the nucleus of human glial cells:Implications for glioblastoma multiforme tumor cell survival under hypoxia Int[J]. Cancer,2006(118):1660-1669.
[8]Masanori Akada.Intrinsic chemoresistance to gemcitabine is associated with decreased expression of BNIP3 in pancreatic cancer[J].Clin Cancer Res,2005,11(8):3094-3101.
[9]Shilpa Kothari,Jeannick Cizeau,Eileen McMillan-Ward,et al.BNIP3 plays a role in hypoxic cell death in human epithelial cells that is inhibited by growth factors EGF and IGF[J].Oncogene,2003(22):4734-4744.
R730.23
B
1671-1246(2015)05-0105-03
注:本文系2010年甘肃省教育厅第二批科研计划项目(1006B-09);2011年兰州市科技局第二批计划项目(BH2011-082)

