干旱及复水对山西野生草地早熟禾幼苗生长与生理特性的影响
朱慧森,王保平,董晓燕,董宽虎*,李存福
(1.山西农业大学动物科技学院,山西 太谷030801;2.全国畜牧总站,北京100125)
草地早熟禾(Poapratensis)是禾本科羊茅亚科早熟禾属根茎丛生型禾草,具有整齐均一、色泽优美、绿期长;耐践踏、再生力强,易用于商品化生产草皮等特点,是世界上应用最为广泛的冷季型草坪草之一。目前针对草地早熟禾的研究主要集中在引种适应性[1-2]、遗传多样性[3-4]、草坪质量[5]、外源物质对其生长 的影响[6-7]以及抗逆性[8-10]等几方面。
水分在草坪建植和维持较高的草坪质量中起着至关重要的作用。水资源的匮乏降低草坪的生态功能和观赏性能,严重地影响草坪草的大面积推广和应用,进而限制了草坪业的发展。水分亏缺下草地早熟禾的相关研究较多,于善伟[11]就草地早熟禾品种兰肯(Kenblue)、午夜(Midnight)和黑龙江乡土早熟禾(Blacktiger)的光合及水分代谢生理研究表明乡土草地早熟禾的抗旱性较强。Xu等[12]研究证实在10d的干旱胁迫及旱后复水过程中抗旱性较强的Midnight净光合速率显著增高,二磷酸核酮糖羧化酶活性及转录水平与磷酸甘油醛脱氢酶活性均较高。郭郁频等[13]在PEG-6000模拟干旱条件下,结合叶绿素、脯氨酸、丙二醛(malondialdehyde,MDA)等生理生化指标测定,采用隶属函数法就14个草地早熟禾品种的抗旱性进行比较研究。200和300mg/L的多效唑可有效增强2个草地早熟禾品种肯塔基(Kentucky)和优异(Merit)的抗旱能力[14]。富含生物活性物质的污泥和硝酸铵溶液组合施用可改善干旱条件下草地早熟禾品种Midnight的草坪外观质量[15]。硅肥的施用降低了干旱胁迫下草地早熟禾品种优异的蒸散量、叶片相对电导率和MDA含量,而叶片相对含水量提高[16]。上述报道主要侧重于草地早熟禾的引进品种,就本土野生资源的抗旱适应性研究较少。
山西地处黄土高原的东缘,干旱少雨,属暖温带大陆性气候,草地早熟禾是当地应用最为广泛的草坪草种。然而,建植草坪的草种完全依赖从国外购进,生长过程中表现出抗旱性差、易感病害等问题。野生种质资源是经过长期的自然选择和生物进化而保存下来的,对当地特有的生境具有较强的适应性。同时,从本土优良草坪种质野生草地早熟禾资源中选育抗旱性强的野生草坪草品种,是我国北方水资源匮乏地区建植草坪的有效途径之一。为此,本文选取采自山西境内表现优良的15份野生草地早熟禾种质资源进行干旱胁迫及复水试验,旨在为野生草地早熟禾种质资源的驯化选育和合理利用提供科学依据。同时,此项研究工作的开展对缓解水资源匮乏与草坪灌溉需水量之间的矛盾有重要现实意义。
1 材料与方法
1.1 试验材料
试验材料为山西省15份不同居群野生草地早熟禾,各采集地信息如表1所示。
1.2 试验设计
本试验于2013年8月在山西农业大学草业科学实验室日光能温室内进行,平均温度15~25℃,相对湿度为65%~75%。将15份不同居群的野生草地早熟禾种植在上口径25cm、高20cm的聚乙烯塑料盆中,基质为沙与土(1∶4)的混合物,pH 7.5,播种量8g/m2。每日称重法定量浇水,保持每盆土壤含水量一致。苗齐后每盆定苗50株,待叶片长到4~5片真叶时进行干旱处理。干旱胁迫前一次性浇水,盆中土壤含水量保持在田间持水量的80%,连续干旱胁迫21d(土壤含水量实测值为3%~5%),第22天复水,复水7d,具体参照杜建雄等[17]的方法;其中以田间土壤含水量的80%为对照,每处理重复3次,同一时间取样并对各指标进行测定。
1.3 测定指标与方法
1.3.1 生长性能指标 1)植株存活率(survival rate,SR):存活率(%)=(存活植株数/总植株数)×100
2)相对生长率(relative growth rate,RGR):处理日均生长率与对照日均生长率的比值。每盆随机选取5株测定其绝对高度,每5d测定1次。
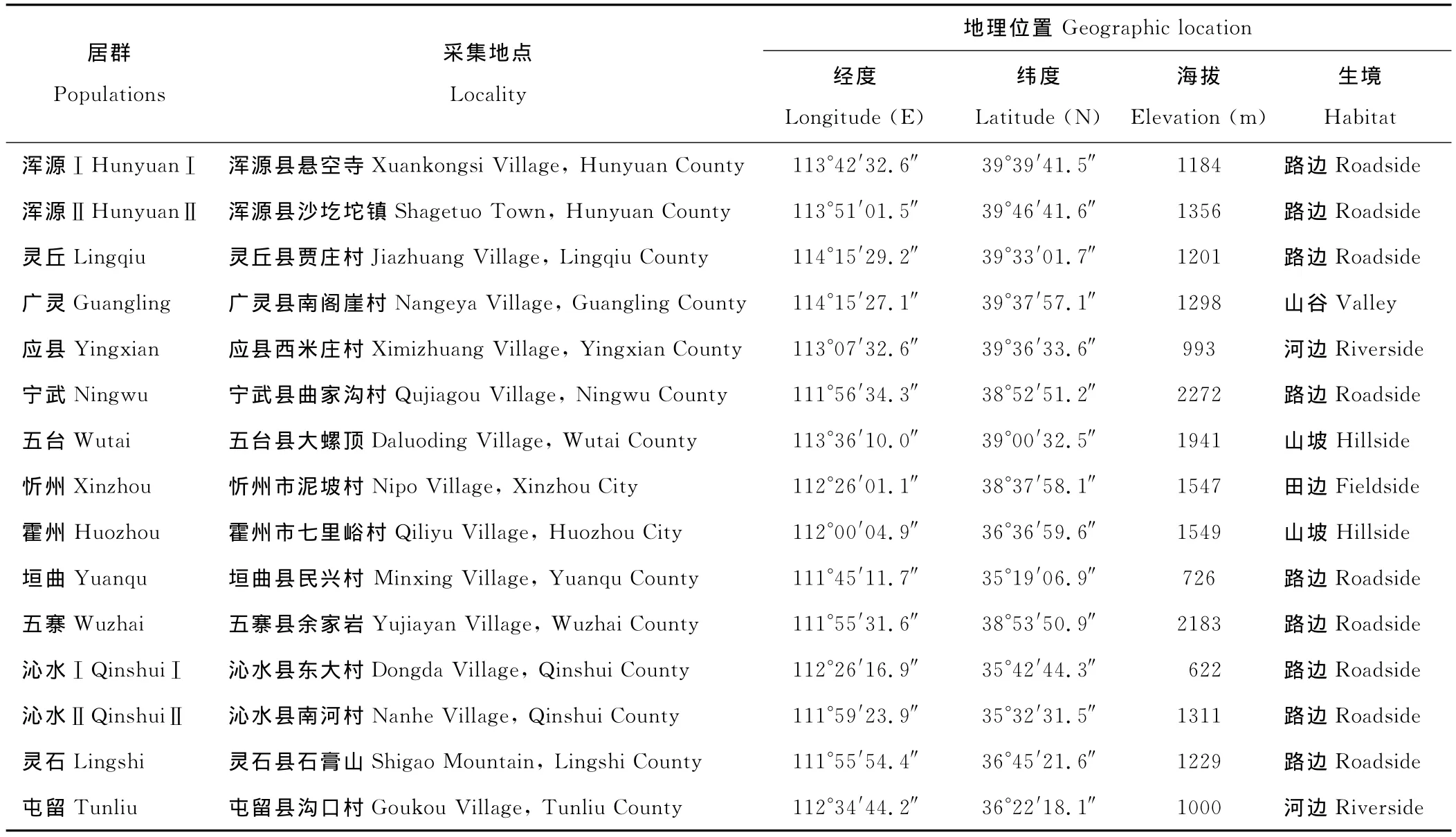
表1 草地早熟禾采集地信息Table 1 Informations of the collected P.pratensis populations
1.3.2 生理生化指标 叶片相对含水量(relative water content,RWC)的测定采用称重法[18];丙二醛(malondialdehyde,MDA)含量、脯氨酸(proline,Pro)含量和超氧化物歧化酶(superoxide dismutase,SOD)活性的测定参照李合生[19]的方法进行。
1.3.3 抗旱性综合评价 采用数学分析法——隶属函数法对不同居群野生草地早熟禾进行综合评定,利用下列公式分别对6个指标的测定值进行标准化处理[20]。
1)与抗旱性正相关的指标用隶属函数:

2)与抗旱性负相关的指标用反隶属函数:
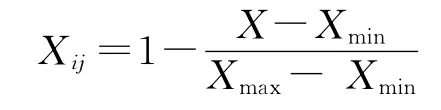
式中,Xij表示第i个居群第j个指标的隶属函数值;X为某一指标的实际测定值;Xmax,Xmin分别表示所有居群中该指标的最大值和最小值。
将某一居群野生草地早熟禾所有指标的隶属函数值叠加,并取平均值,平均值越大,说明其抗旱性越强。根据平均隶属值将其分为4个等级:当Xi≥0.800为Ⅰ级(强抗旱);0.500≤Xi<0.800为Ⅱ级(中等抗旱);0.300≤Xi<0.500为Ⅲ级(弱抗旱);Xi<0.300为Ⅳ级(不抗旱)[21]。
1.4 数据处理
采用Excel 2003对原始数据进行处理,SAS 9.0统计软件对数据进行单因素方差分析和LSD多重比较。
2 结果与分析
2.1 干旱及复水对不同居群野生草地早熟禾幼苗生长性能的影响
不同居群野生草地早熟禾在干旱胁迫及复水处理下,其存活率和相对生长率表现不同(表2)。在水分充足的情况下,各居群野生草地早熟禾均能正常生长。在干旱胁迫21d后,除浑源Ⅰ和沁水Ⅱ居群外,其他居群幼苗均出现了不同程度的枯黄;灵石居群的存活率显著低于浑源Ⅰ和沁水Ⅱ居群(P<0.05),而与其他居群之间无显著差异。复水后,除忻州、霍州、五寨和沁水Ⅰ居群外,其他居群的存活率均有所提高,垣曲居群草地早熟禾幼苗的存活率显著低于浑源Ⅰ、沁水Ⅱ和灵石居群(P<0.05),而与其他居群之间差异不显著。
干旱及复水对各居群野生草地早熟禾相对生长率有显著影响(P<0.05)。干旱胁迫21d时,广灵和屯留居群的相对生长率变化最大,显著低于除霍州居群外的其他各居群(P<0.05);浑源Ⅰ居群的相对生长率最高,达到52.94%,显著高于其他各居群(P<0.05)。复水后,除广灵居群外,其他各居群的相对生长率均有不同程度提高。沁水Ⅱ和浑源Ⅰ居群的变化最大,分别比干旱胁迫21d时提高72.83%和60.07%,且这两个居群的相对生长率显著最高(P<0.05)。
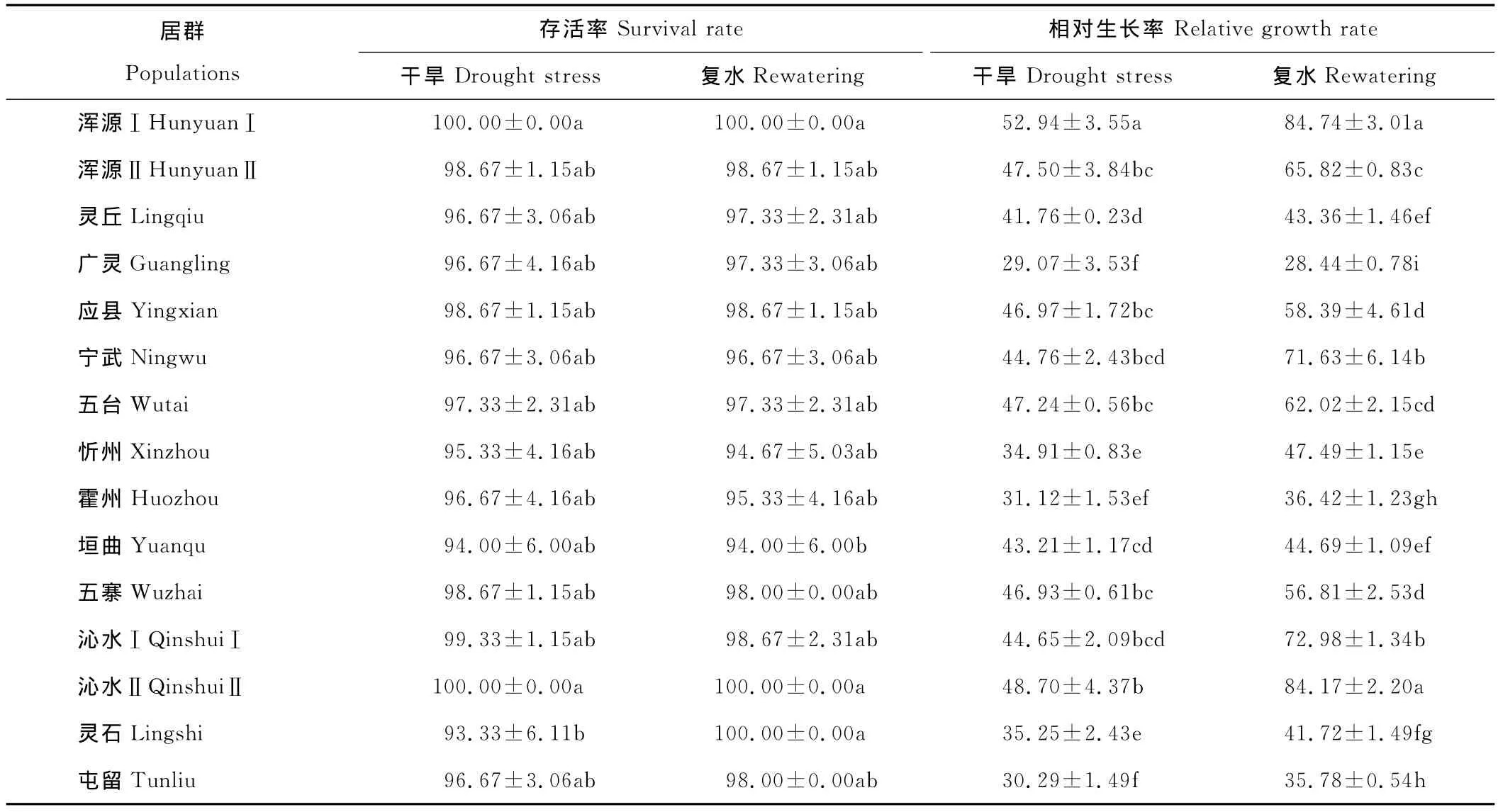
表2 干旱胁迫及复水下各居群野生草地早熟禾的存活率和相对生长率Table 2 Survival and relative growth rate of different populations of wild P.pratensis under drought stress and rewatering%
2.2 干旱及复水对不同居群野生草地早熟禾幼苗生理特性的影响
2.2.1 干旱及复水对草地早熟禾叶片相对含水量的影响 干旱及复水对不同居群野生草地早熟禾叶片相对含水量(RWC)有显著影响(P<0.05)(表3)。正常水分条件下,各居群野生草地早熟禾的RWC均较高;广灵居群和应县居群野生草地早熟禾的RWC显著高于其他居群(P<0.05),但二居群间无显著差异。经21d干旱胁迫,浑源Ⅱ、沁水Ⅰ和沁水Ⅱ居群野生草地早熟禾的RWC显著高于其他居群(P<0.05)。
复水7d后,各居群野生草地早熟禾的RWC有较大程度恢复,但各居群均未恢复至对照水平,说明干旱对各居群的部分植株造成了永久性的伤害,霍州居群的RWC显著最低(P<0.05),仅为33.84%,说明其受干旱危害程度最大。
2.2.2 干旱及复水对草地早熟禾脯氨酸含量的影响 如表4,在正常水分条件下,山西不同居群野生草地早熟禾幼苗中Pro含量相差较大,其中五寨居群最高,显著高于除灵丘居群外的其余各居群(P<0.05),沁水Ⅱ居群Pro含量则显著低于其他居群。干旱胁迫21d的不同居群野生草地早熟禾Pro含量均高于对照,其中沁水Ⅱ居群Pro的积累量最大,为正常水分处理的17.27倍,而忻州居群的积累量最小,仅为对照的3.44倍。干旱胁迫下Pro的绝对含量以沁水Ⅰ居群最高,显著高于除广灵和沁水Ⅱ居群外的其他居群(P<0.05)。
复水后,不同居群野生草地早熟禾的Pro含量均未恢复至对照水平。在草地早熟禾幼苗中,五台居群显著高于其他居群,其含量是对照的4.96倍,而浑源Ⅱ居群野生草地早熟禾的Pro含量显著低于其他居群,为231.98 μg/g FW,是对照的3.55倍(P<0.05)。
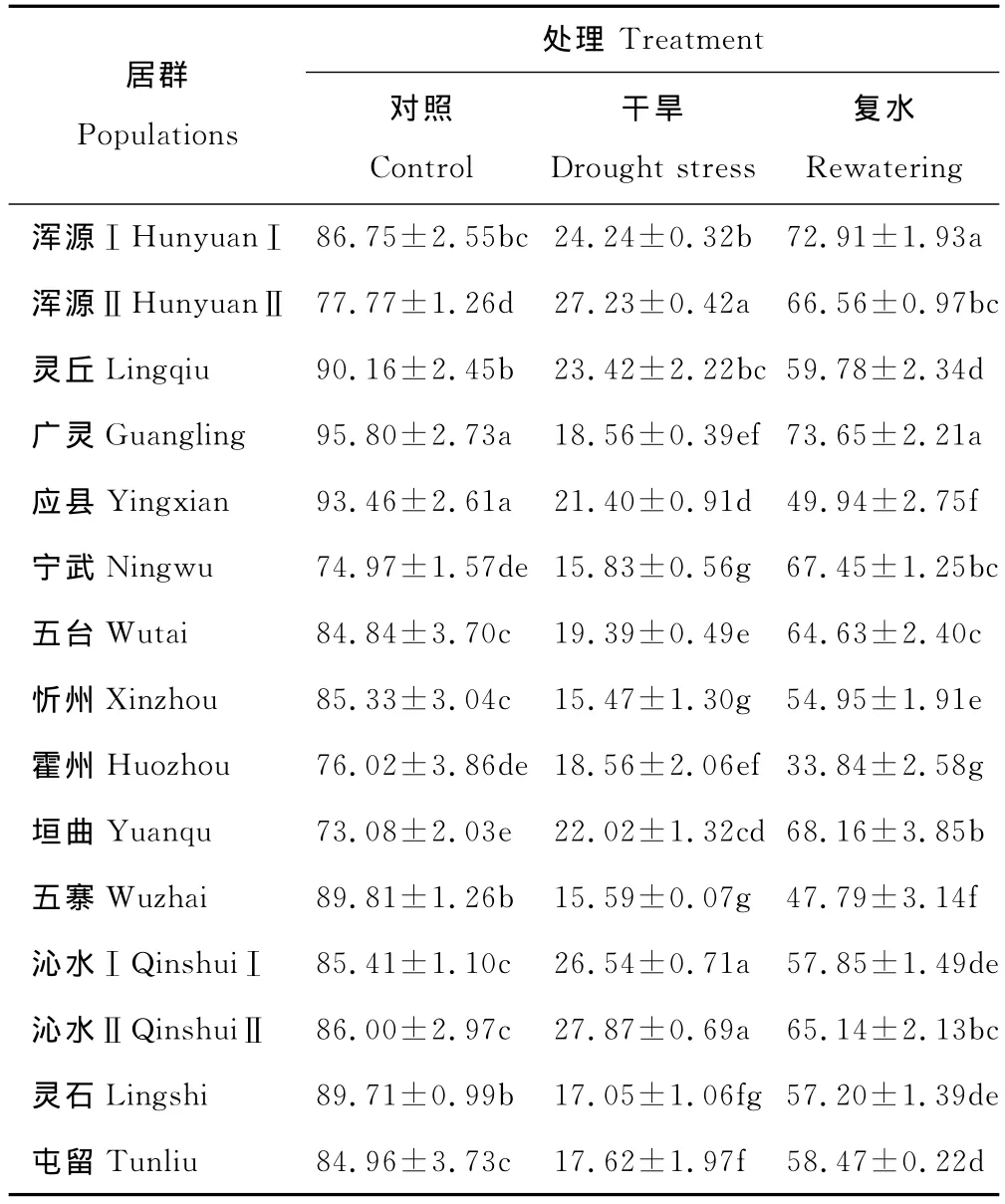
表3 干旱及复水对野生草地早熟禾叶片相对含水量的影响Table 3 Effects of drought stress and rewatering on the leaf relative water contents of different populations of wild P.pratensis %

表4 干旱及复水对野生草地早熟禾脯氨酸含量的影响Table 4 Effects of drought stress and rewatering on the proline contents of different populations of wild P.pratensis μg/g FW
2.2.3 干旱及复水对草地早熟禾超氧化物歧化酶活性的影响 在正常、干旱及复水条件下,不同居群野生草地早熟禾幼苗中超氧化物歧化酶(SOD)活性表现出一定差异(表5)。在正常水分条件下,灵石居群野生草地早熟禾幼苗中SOD活性最低,与其余各居群存在显著差异(P<0.05),浑源Ⅱ、灵丘、浑源Ⅰ、应县和广灵居群间SOD活性差异不显著,但显著高于其他居群(P<0.05)。干旱胁迫与正常水分相比均降低了野生草地早熟禾幼苗的SOD活性。受干旱的影响,霍州居群的SOD活性最高,且显著高于其他居群(P<0.05)。宁武居群野生草地早熟禾的SOD活性显著低于其他居群,与对照相比,降低47.61%(P<0.05)。
复水7d,各居群野生草地早熟禾幼苗中SOD活性均有增强,但都未能恢复到对照水平,15份材料中SOD活性最大、最小的居群分别为霍州和宁武居群,二者均分别与其他各居群差异显著(P<0.05)。
2.2.4 干旱及复水对草地早熟禾丙二醛含量的影响 由表6可知,山西不同居群野生草地早熟禾幼苗中丙二醛(MDA)含量均表现出干旱胁迫下上升复水后又下降的趋势。在正常水分条件下,浑源Ⅰ居群野生草地早熟禾幼苗中的MDA含量最高,与浑源Ⅱ、沁水Ⅱ和沁水Ⅰ无显著差异,但显著高于其他居群(P<0.05)。垣曲居群MDA含量仅为2.50μmol/g FW,显著最低。经21d干旱胁迫,五寨居群野生草地早熟禾幼苗中MDA含量显著高于其他居群,是对照的3.60倍(P<0.05);灵石居群野生草地早熟禾幼苗中MDA含量显著低于其他居群,仅为对照的1.94倍(P<0.05),其他居群介于二者之间。
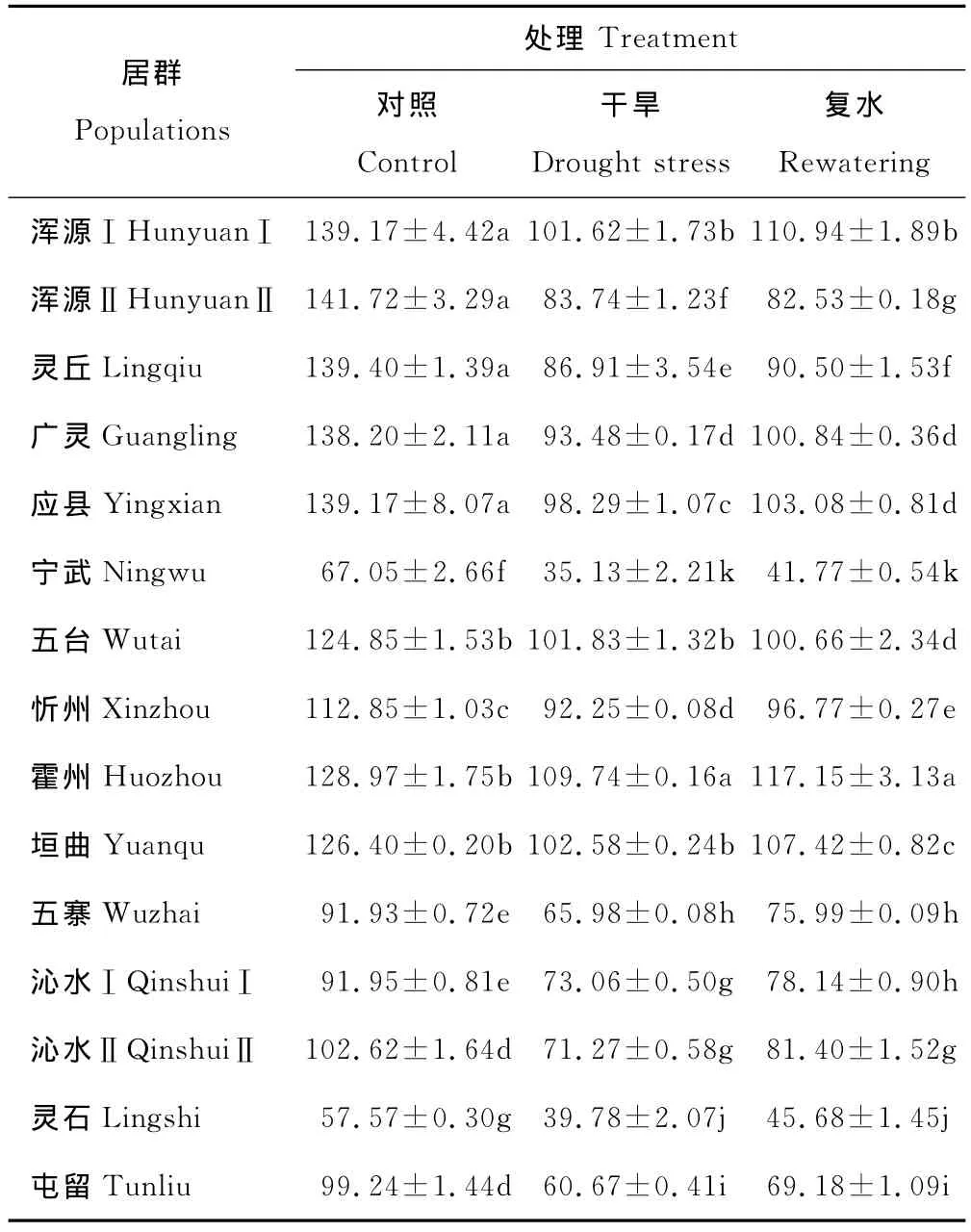
表5 干旱及复水对野生草地早熟禾SOD活性的影响Table 5 Effects of drought stress and rewatering on SOD activity of different populations of wild P.pratensis U/g FW
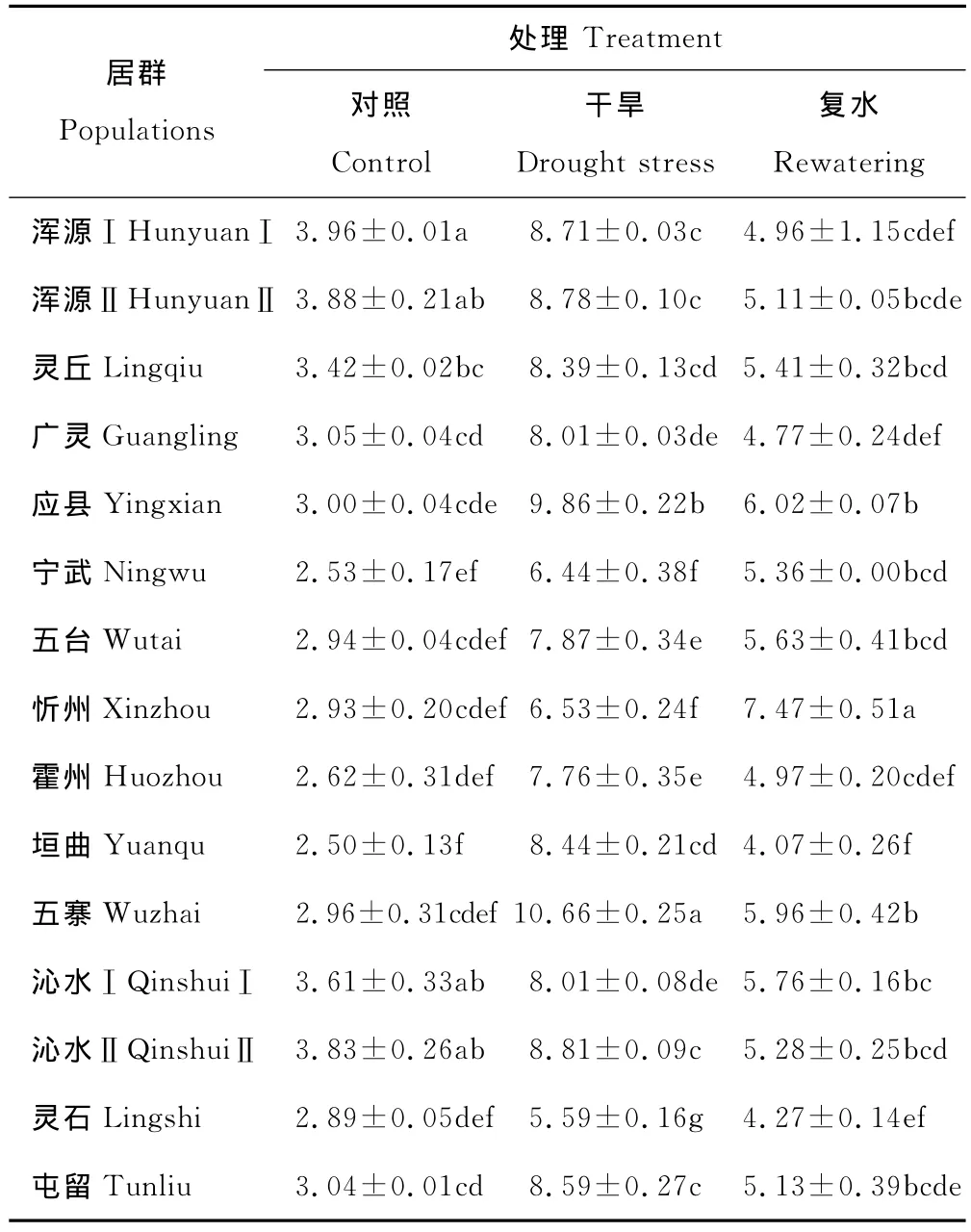
表6 干旱及复水对野生草地早熟禾丙二醛含量的影响Table 6 Effects of drought stress and rewatering on the MDA contents of different populations of wild P.pratensis μmol/g FW
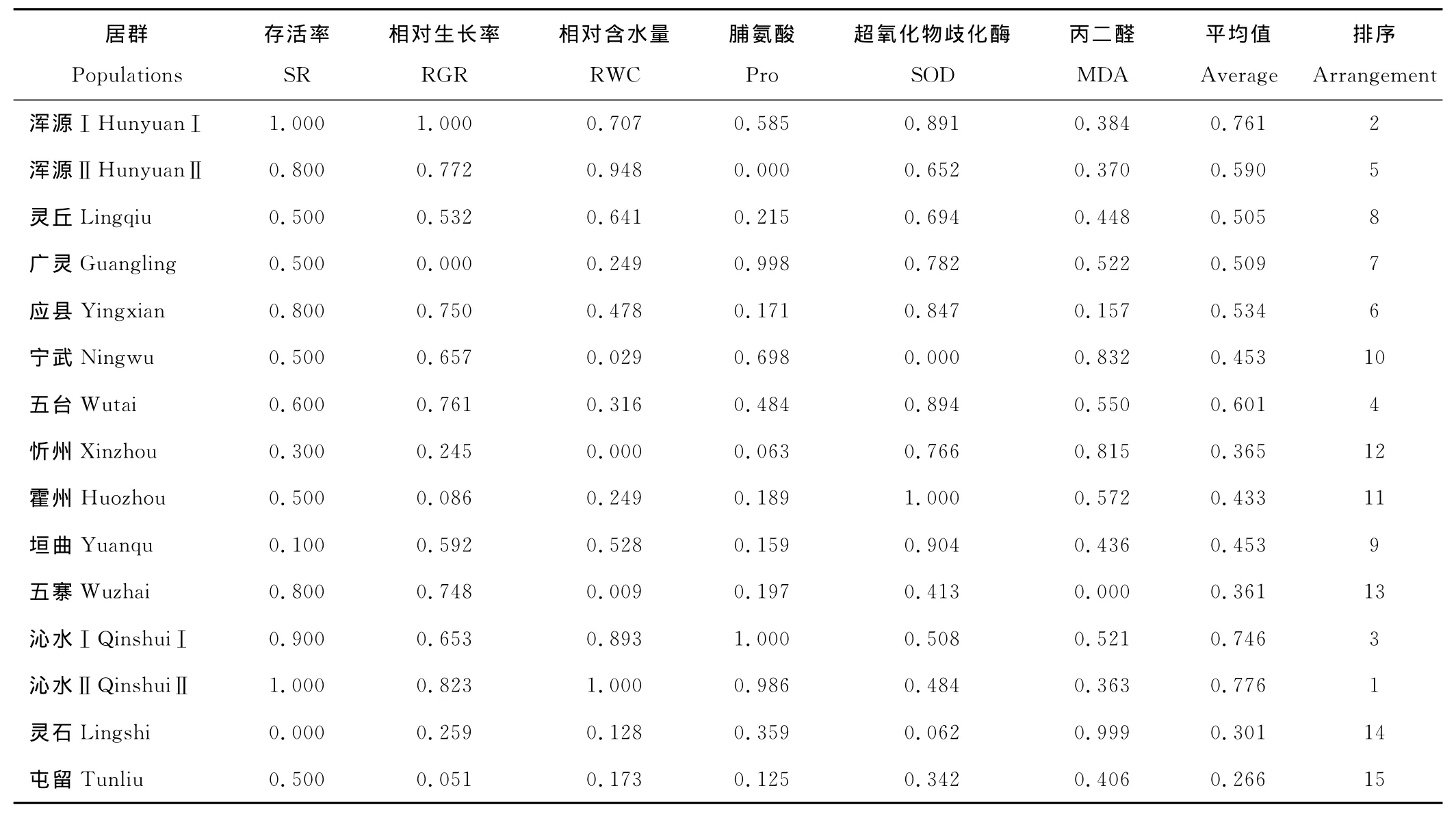
表7 不同居群野生草地早熟禾抗旱隶属函数值比较Table 7 Comparison of subordinate function value of different populations of wild P.pratensis
复水7d后,除忻州居群外,其他各居群野生草地早熟禾幼苗中的MDA含量较复水前均有所降低,但仍未能恢复到对照水平。忻州居群野生草地早熟禾幼苗中的MDA含量显著高于其他各居群(P<0.05),且在干旱及复水处理过程中的变化幅度最大,为正常水分条件草地早熟禾植株的2.55倍。浑源Ⅰ居群野生草地早熟禾幼苗中MDA含量与正常水分条件相差最小,为对照的1.25倍。
2.3 不同居群野生草地早熟禾抗旱性综合评价
将山西15个居群野生草地早熟禾的6个抗旱性相关指标进行综合分析,计算不同居群各指标隶属度值,将各居群不同指标隶属值平均后作为抗旱鉴定的综合评价指标(表7)。依据计算所得隶属值将参试草地早熟禾分为3个类群:其中Ⅱ级中等抗旱的居群有沁水Ⅱ、浑源Ⅰ、沁水Ⅰ、五台、浑源Ⅱ、应县、广灵和灵丘8个居群;Ⅲ级弱抗旱居群有垣曲、宁武、霍州、忻州、五寨和灵石6个居群,屯留居群属于Ⅳ级不抗旱居群。
3 讨论
3.1 不同居群野生草地早熟禾幼苗生长性能对干旱及复水的响应
植株存活率和相对生长率是衡量植物对于干旱耐受性的最直接体现,同时,它们在一定程度上也反映了环境对参试植株的选择情况。本试验结果表明,在干旱过程中不同居群野生草地早熟禾的存活率和相对生长率都呈下降趋势。经21d的干旱胁迫,各居群野生草地早熟禾植株出现了不同程度的枯黄,这说明随着胁迫时间的延长,土壤中的水分亏缺,根系能够从土壤中摄取的水分与养分变得极其有限,进而草地早熟禾的生长发育受到限制。胁迫程度较轻时表现为相对生长速率降低,严重时造成草地早熟禾植株死亡。复水后,各居群野生草地早熟禾的存活率和相对生长率均有所提高,但均未恢复至对照水平,这与董丽华[22]关于12个草地早熟禾引进品种的抗旱性研究结果相一致。
3.2 不同居群野生草地早熟禾幼苗生理特性对干旱及复水的响应
叶片相对含水量是衡量植物吸水和失水动态平衡的一个指标,反映植物体内的水分状况,在一定程度上也能表现出参试植株对干旱胁迫的适应能力。干旱胁迫下,植株RWC下降速度慢、幅度小,表明其有较强的持水保水能力,即抗旱性强,反之则弱[23]。本试验中,不同居群野生草地早熟禾的RWC大幅度降低,不同居群间存在差异,说明不同居群间抗旱性不同,这与 Huang和 Gao[24]就高羊茅(Festucaarundinacea)和 Abraham 等[25]就3种早熟禾的研究结果一致。分析其原因主要是干旱胁迫下,土壤含水量及可利用水分降低,使得草地早熟禾根系吸水困难,而叶片蒸散失水较多,进而表现出叶片相对含水量降低。本试验结果表明,复水后,各居群野生草地早熟禾叶片相对含水量均有大幅度提高,不同居群间存在显著差异,这与杜建雄等[26]关于草地早熟禾3个品种抗旱性的研究一致。同时也发现,复水后各居群的叶片相对含水量均未恢复到对照水平,说明干旱对草地早熟禾的伤害是不可逆的,而且不同居群在干旱胁迫后的恢复能力也存在差异。大量研究结果得出,干旱胁迫下草地早熟禾叶片相对含水量的阈值为25%,当相对含水量低于25%时,复水后很难恢复[27-28]。然而本试验中参试草地早熟禾在干旱胁迫下相对含水量大部分低于此阈值,复水后均有不同程度的恢复。这可能是本试验所选用的材料均为山西野生种质资源,在经长期自然选择后具有对干旱条件的一定适应能力的原因。
植物为了减轻或者避免干旱造成的伤害,通常会合成和积累渗透调节物质,通过降低自身渗透势来维持正常膨压,进而适应干旱胁迫[29]。游离脯氨酸是植物体内重要的渗透调节物质,一方面其具有亲水性,防止在干旱胁迫中水分的散失;另一方面,脯氨酸是中性氨基酸,在干旱胁迫时能与细胞膜物质相互作用,稳定膜结构,进而减轻或避免细胞膜受到伤害[30]。本研究结果表明,脯氨酸含量与叶片相对含水量呈正相关,这与卢少云等[31]、刘迪[32]的研究结果不一致。这可能是由于野生草地早熟禾启动了与上述研究中不同的通路或途径来抵御外界的干旱胁迫环境。本试验中,干旱胁迫21d的不同居群野生草地早熟禾Pro含量均高于正常水分处理;复水7d时,各居群Pro含量又均降低,说明Pro的合成与积累在山西野生草地早熟禾干旱及复水整个过程中发挥重要调控作用。在正常水分条件下,不同居群野生草地早熟禾的Pro实测值较大且差异显著,说明不同居群野生草地早熟禾本身存在一定程度的适应干旱潜力;在干旱胁迫过程中,不同居群间Pro含量的增加幅度不同,表明居群间的抗旱能力存在差异。综上,Pro含量变化可作为衡量野生草地早熟禾抗旱能力的生理指标,这与董丽华[22]和李显利[33]的报道一致。
干旱胁迫下,酶活性的高低及其变化可以直接反应该植物的抗旱性强弱[34]。陈雅君等[35]研究得出,不同草坪草品种SOD活性及其变化在干旱胁迫条件下存在差异,认为草坪草对ROS的清除很可能存在一个临界点,当ROS超过临界点,保护酶活性就会下降,进而影响草坪草的代谢活动,本研究结果与此相一致。同时本试验还发现,野生草地早熟禾在经干旱后复水的过程中SOD活性呈先下降后升高的变化趋势,不同居群间变化幅度存在差异,说明干旱胁迫对参试野生草地早熟禾造成了一定伤害,这与Fu和Huang[36]、Liu[32]相关此方面的研究一致。
丙二醛是植物细胞膜脂质过氧化的最终产物之一,具有细胞毒性,可反映膜的稳定性与植物受伤害的程度[37],抑制植物的正常生长。从本试验可以看出,不同居群野生草地早熟禾的MDA含量在胁迫21d时成倍增加,说明此时野生草地早熟禾幼苗受到极大程度的伤害,这与荣秀莲[38]研究所得结论一致。复水7d时,各居群野生草地早熟禾SOD活性和MDA含量均有恢复,但都未能达到对照水平,说明21d的干旱胁迫对野生草地早熟禾造成了一些不可逆的损伤。
4 结论
干旱胁迫下,不同居群野生草地早熟禾的存活率和相对生长率降低,浑源Ⅰ和沁水Ⅱ居群未发生植株死亡现象,相对生长率较高;复水后浑源Ⅰ和沁水Ⅱ居群恢复较好。受干旱的影响,不同居群野生草地早熟禾幼苗叶片相对含水量和SOD活性降低,而MDA和游离脯氨酸含量增加,15份材料相应指标的变化幅度存在差异。复水后,各生理指标均表现不同程度的恢复,但均未恢复至正常水平。采用抗旱隶属函数法进行抗旱性综合评价,可将15份山西野生草地早熟禾种质分为3个类群,其中Ⅱ级中等抗旱的居群8个,Ⅲ级弱抗旱居群6个,Ⅳ级不抗旱居群1个。
[1]Martiniello P,D’Andrea E.Cool-season turf grass species adaptability in Mediterranean environments and quality traits of varieties.European Journal of Agronomy,2006,25(3):234-242.
[2]Romani M,Piano E,Pecetti L.Collection and preliminary evaluation of native turfgrass accessions in Italy.Genetic Resources and Crop Evolution,2002,49(4):341-349.
[3]Chao W,Xin L,Li-na G,etal.Study on classification and genetic diversity of Kentucky bluegrasses by using RAPD markers.Journal of Northeast Agricultural University(English Edition),2012,19(4):37-41.
[4]Curley J,Jung G.RAPD-based genetic relationships in Kentucky bluegrass:comparison of cultivars,interspecific hybrids,and plant introductions.Crop Science,2004,44(4):1299-1306.
[5]Bremer D J,Lee H,Su K,etal.Relationships between normalized difference vegetation index and visual quality in cool-season turfgrass:I.Variation among species and cultivars.Crop Science,2011,51(5):2212-2218.
[6]Wang X Y,Hu T M,Wang Q Z,etal.Growth of Kentucky bluegrass as influenced by nitrogen and trinexapacethyl.Agricultural Sciences in China,2009,8(12):1498-1502.
[7]Beasley J S,Branham B E.Trinexapac-ethyl and paclobutrazol affect Kentucky bluegrass single-leaf carbon exchange rates and plant growth.Crop Science,2007,47(1):132-138.
[8]He Y L,Huang B R.Protein changes during heat stress in three Kentucky bluegrass cultivars differing in heat tolerance.Crop Science,2007,47(6):2513-2520.
[9]Richardson M D,Karcher D E,Hignight K,etal.Drought tolerance and rooting capacity of Kentucky bluegrass cultivars.Crop Science,2008,48(6):2429-2436.
[10]Liu J R,Xie X R,Du J X,etal.Effects of simultaneous drought and heat stress on Kentucky bluegrass.Scientia Horticulturae,2008,115(2):190-195.
[11]Yu S W.The Effects of Photosynthetic Physiology and Water Metabolism of Kentucky Bluegrass under Drought Stress[D].Haerbin:Northeast Agricultural University,2012.
[12]Xu L X,Yu J J,Han L B,etal.Photosynthetic enzyme activities and gene expression associated with drought tolerance and post-drought recovery in Kentucky bluegrass.Environmental and Experimental Botany,2013,89:28-35.
[13]Guo Y P,Mi F G,Yan L J,etal.Physiological response to drought stresses and drought resistances evaluation of different Kentucky bluegrass varieties.Acta Prataculturae Sinica,2014,23(4):220-228.
[14]Wang J H,Duo D.Effect of paclobutrazol on drought resistance of six turfgrass cultivars during the seedling stage.Acta Prataculturae Sinica,2014,23(6):253-258.
[15]Zhuo L Q,Chang Z H.Impact of biologically active substances of biosolids onPoapratensisL.growth under drought stress.Acta Agrestia Sinica,2013,21(2):346-352.
[16]Yu Q.The Effects of Silicon on Growth and Development of Kentucky Bluegrass Seedlings under Drought Stress[D].Lanzhou:Lanzhou University,2014.
[17]Du J X,Shi S L,Liu J R,etal.Effects of drought stress and rewatering on physiological characteristics of three Kentucky bluegrass cultivars.Acta Agrestia Sinica,2010,18(1):73-77.
[18]Zhang Z L.Experimential Instructor of Plant Physiology(2ndedition)[M].Beijing:Higher Education Press,1999:259-260.
[19]Li H S.Experimetial Principle and Technology of Plant Physiology and Biochemistry(2ndedition)[M].Beijing:Higher Education Press,2003:191-205.
[20]Li P Y,Sun Z J,A Bu L T.Study on the drought resistance of germplasm resources ofElytrigiarepens.Chinese Journal of Grassland,2008,30(3):59-64.
[21]Li H.FestucarubraandPoapratensisTurfgrass Capacity at Different Times of the Comparative Study of Drought[D].Haerbin:Northeast Forestry University,2009.
[22]Dong L H.Studies on Drought Resistance in Different Bluegrass Cultivars[D].Yinchuan:Ningxia University,2005.
[23]Hu L X.Study on the Physiology of Drought Resistance and Isolation of Drought-related Genes in Turfgrass[D].Shanghai:Shanghai Jiao Tong University,2010.
[24]Huang B R,Gao H W.Physiological responses of diverse tall fescue cultivars to drought stress.HortScience,1999,34(5):897-901.
[25]Abraham E M,Huang B,Bonos S A,etal.Evaluation of drought resistance for Texas bluegrass,Kentucky bluegrass,and their hybrids.Crop Science,2004,44(5):1746-1753.
[26]Du J X,Hou X Y,Liu J R.A study on physiological response to drought and re-watering treatments in Kentucky bluegrass.Acta Prataculturae Sinica,2010,19(2):31-38.
[27]Xu L L,Han L,Huang B R.Membrane fatty acid composition and saturation levels associated with leaf dehydration tolerance and post-drought rehydration in Kentucky bluegrass.Crop Science,2011,51(1):273-281.
[28]Hu L X,Wang Z L,Huang B R.Diffusion limitations and metabolic factors associated with inhibition and recovery of photosynthesis from drought stress in a C3perennial grass species.Physiologia Plantarum,2010,139(1):93-106.
[29]Morgan J M.Osmoregulation and water stress in higher plants.Annual Review of Plant Physiology,1984,35(1):299-319.
[30]Sanada Y,Veda H,Kuribayashi K,etal.Novel light-dark change of proline levels in halophyte(MesembryanthemumcrystallinumL.)and glycophytes(HordeumvulgareL.andTriticumaestivumL.)leaves and roots under salt stress.Plant Cell Physiology,1995,36(6):965-970.
[31]Lu S Y,Chen S P,Chen S M,etal.Responses of proline content and activity of antioxidant enzymes in warmseason turfgrasses to soil drought stress.Acta Horticulturae Sinica,2003,30(3):303-306.
[32]Liu D.The Effect of Super Absorbent Polymer on the Growth and Drought Resistance of Kentucky Bluegrass[D].Haerbin:Northeast Forestry University,2008.
[33]Li X L.Evaluation and Analysis of the Drought Resistance and Salt Tolerance of Different Kentucky Bluegrass Varieties[D].Huhhot:Inner Mongolia Agricultural University,2010.
[34]Gong J R,Zhao A F,Zhang L X,etal.A comparative study on anti-oxidative ability of several desert plants under drought stress.Acta Botanica Boreali-Occidentalia Sinica,2004,24(9):1570-1577.
[35]Chen Y J,Zu Y G,Liu H M,etal.Effect of drought on membrane lipid peroxidation and protective enzymes activities in cells of different Kentucky bluegrass(PoapratensisL.)cultivars.Chinese Journal of Grassland,2008,30(5):32-36.
[36]Fu J M,Huang B R.Involvement of antioxidants and lipid peroxidation in the adaptation of two cool-season grasses to localized drought stress.Environmental and Experimental Botany,2001,45(2):105-114.
[37]Jaleel C A,Gopi R,Sankar B,etal.Studies on germination,seedling vigour,lipid peroxidation and proline metabolism inCatharanthusroseusseedlings under salt stress.South African Journal of Botany,2007,73(2):190-195.
[38]Rong X L.Study and Evaluation on Drought Resistance of Three Cool-season Turfgrasses[D].Suzhou:Soochow University,2010.
参考文献:
[11]于善伟.干旱胁迫对草地早熟禾部分光合生理及水分代谢指标的影响[D].哈尔滨:东北农业大学,2012.
[13]郭郁频,米福贵,闫利军,等.不同早熟禾品种对干旱胁迫的生理响应及抗旱性评价.草业学报,2014,23(4):220-228.
[14]王竞红,多多.多效唑对6种草坪草苗期抗旱性影响的研究.草业学报,2014,23(6):253-258.
[15]禚来强,常智慧.干旱条件下污泥中生物活性物质对草地早熟禾生长的影响.草地学报,2013,21(2):346-352.
[16]余群.干旱胁迫下硅肥对草地早熟禾苗期生长发育的影响[D].兰州:兰州大学,2014.
[17]杜建雄,师尚礼,刘金荣,等.干旱胁迫和复水对草地早熟禾3个品种生理特性的影响.草地学报,2010,18(1):73-77.
[18]张志良.植物生理学实验指导(第二版)[M].北京:高等教育出版社,1999:259-260.
[19]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003:191-205.
[20]李培英,孙宗玖,阿不来提.偃麦草种质资源抗旱性评价初步研究.中国草地学报,2008,30(3):59-64.
[21]李鹤.紫羊茅和草地早熟禾草坪草在不同时期抗旱能力的比较研究[D].哈尔滨:东北林业大学,2009.
[22]董丽华.草地早熟禾不同品种抗旱性研究[D].银川:宁夏大学,2005.
[23]胡龙兴.草坪草抗旱生理及相关基因分析[D].上海:上海交通大学,2010.
[26]杜建雄,侯向阳,刘金荣.草地早熟禾对干旱及旱后复水的生理响应研究.草业学报,2010,19(2):31-38.
[31]卢少云,陈斯平,陈斯曼,等.三种暖季型草坪草在干旱条件下脯氨酸含量和抗氧化酶活性的反应.园艺学报,2003,30(3):303-306.
[32]刘迪.保水剂对草地早熟禾生长及抗旱性的影响[D].哈尔滨:东北林业大学,2008.
[33]李显利.草地早熟禾不同品种抗旱性、耐盐性的评价分析[D].呼和浩特:内蒙古农业大学,2010.
[34]龚吉蕊,赵爱芬,张立新,等.干旱胁迫下几种荒漠植物抗氧化能力的比较研究.西北植物学报,2004,24(9):1570-1577.
[35]陈雅君,祖元刚,刘慧民,等.干旱对草地早熟禾膜质过氧化酶和保护酶活性的影响.中国草地学报,2008,30(5):32-36.
[38]荣秀莲.三种冷季型草坪草抗旱性研究与评价[D].苏州:苏州大学,2010.

