植物ABCG转运蛋白研究进展
张婧,陈梦词,马清,未丽,王锁民
(兰州大学草地农业科技学院, 草地农业生态系统国家重点实验室, 甘肃 兰州730020)
植物ABCG转运蛋白研究进展
张婧,陈梦词,马清,未丽,王锁民*
(兰州大学草地农业科技学院, 草地农业生态系统国家重点实验室, 甘肃 兰州730020)
摘要:ABCG转运蛋白是ABC蛋白家族最庞大的亚族,广泛存在于植物体内。ABCG亚族主要由半分子转运蛋白WBC(white-brown complex)和全分子转运蛋白PDR(pleiotropic drug resistance)组成,其底物类型广泛,包括抗生素、植物激素、木质素单体、脂质及次生代谢产物等,涉及植物生命周期中的多种代谢活动。本文综述了植物ABCG转运蛋白的分子特性、结构及功能方面的研究进展,并对今后有关该蛋白的主要研究方向做了展望。
关键词:ABCG转运蛋白;基因结构;功能
DOI:10.11686/cyxb2014415
Zhang J, Chen M C, Ma Q, Wei L, Wang S M. Review of advances in the study of plant ABCG transporters. Acta Prataculturae Sinica, 2015, 24(7): 180-188.
张婧, 陈梦词, 马清, 未丽, 王锁民. 植物ABCG转运蛋白研究进展. 草业学报, 2015, 24(7): 180-188.
http://cyxb.lzu.edu.cn
收稿日期:2014-10-09;改回日期:2014-10-24
基金项目:国家自然科学基金项目(31470503),教育部博士点基金优先发展领域项目(20130211130001)和兰州大学中央高校基本科研业务费专项资金(lzujbky-2014-m01)资助。
作者简介:张婧(1989-),女,山西原平人,硕士。E-mail: zhangjing12@lzu.edu.cn
通讯作者*Corresponding author. E-mail: smwang@lzu.edu.cn
Abstract:The ATP-binding cassette (ABC) transporters are members of a protein superfamily that constitutes one of the largest protein families known in plants. The ABC subfamily G (ABCG) consists of a single ABC cassette in the amino terminal. ABCG includes both the half-size molecular transporter white-brown complex (WBC) and the full-size molecular transporter pleiotropic drug resistance (PDR). ABCG is made up of a wide variety of substances (including antibiotics, phytohormones, lignin monolignols, lipids and secondary metabolites) that are involved in many kinds of metabolic processes during the plant life cycle. This paper reviews recent advances in studies of the molecular structure and function of ABCG transporters. Research hotspots and future directions are also considered.
Review of advances in the study of plant ABCG transporters
ZHANG Jing, CHEN Meng-Ci, MA Qing, WEI Li, WANG Suo-Min*
CollegeofPastoralAgricultureScienceandTechnology,StateKeyLaboratoryofGrasslandAgro-ecosystems,LanzhouUniversity,Lanzhou730020,China
Key words: ABCG transporters; gene structure; function
ABC (ATP-binding cassette,ABC)转运蛋白家族是目前发现的最大的蛋白家族之一,由于其能够借助水解ATP释放的能量完成底物的跨膜运输而得名。因为其丰富的底物选择性,在生物体内参与多种重要生理过程,对于植物生长发育至关重要,受到了国内外研究者的广泛关注。该家族包含13个亚家族,拟南芥(Arabidopsisthaliana)全基因组测序结果显示其包含131个ABC转运蛋白基因,其中ABCG是最大的亚族,共包含44个成员[1]。近年来,ABCG转运蛋白在植物中得到了广泛的研究,除模式植物拟南芥外,在水稻(Oryzasativa)、蒺藜苜蓿(Medicagotruncatula)、烟草(Nicotianatabacum)中也展开了大量研究。随着研究的不断深入,逐渐发现ABCG转运蛋白在植物器官发育、表皮角质层形成、激素运输、次生代谢产物分泌、抵抗生物和非生物胁迫以及植物与微生物互作方面具有重要作用。
1ABCG转运蛋白的结构及分类
ABCG转运蛋白包含核苷酸结合域NBD(nucleotide-binding domain,NBD)和跨膜结构域TMD(transmembrane domain,TMD)。其中亲水性的NBD结构域包含高度保守的特征基序,即Walker A[GX4GK(ST)],ABC signature[(LIVMFY)S(SG)GX3(RKA)(LIVMYA)X(LIVFM)(AG)]和Walker B[(RK)X3GX3L(hydrophobic)3][2],能够结合水解ATP,为跨膜运输提供能量。而疏水的TMD结构域由4~6个跨膜α螺旋构成,形成跨膜通道,并能够识别底物特异性。
依据NBD和TMD的组成,可将ABCG转运蛋白家族分为两类。一类是WBC (white-brown complex,WBC)型,其结构为NBD-TMD,称为半分子(half-size)转运蛋白。在果蝇和哺乳动物的研究中已表明该类转运蛋白需要与自身或另一个半分子转运蛋白聚合,形成同二聚蛋白或异二聚蛋白,共同发挥转运功能[3-4]。McFarlane等[5]运用双分子荧光互补法首次证明了植物体中也存在类似现象,发现拟南芥植株内存在AtABCG11与AtABCG12形成的异二聚体以及2个AtABCG11形成的同二聚体。另一类为PDR (pleiotropic drug resistance,PDR)型,结构为NBD-TMD-NBD-TMD,称为全分子(full-size)转运蛋白,可以单独发挥功能。拟南芥、水稻[6]、葡萄(Vitisvinifera)[7]及百脉根(Lotusjaponicus)[8]全基因组测序结果显示其分别有44,51,63和36个ABCG转运蛋白(表1)。此外,Jasinski等[9]在蒺藜苜蓿中确定了19个PDR型转运蛋白,且组织特异性分析发现其大部分在根或花中表达,极少数在叶中表达;进一步分析发现百脉根和蒺藜苜蓿PDR转运蛋白编码基因能够受到不同根瘤菌接种的诱导,表明其在根瘤菌互作过程中发挥重要作用。
根据对ABC转运蛋白三维结构的预测,推测其转运过程为底物分子首先与一个跨膜结构域TMD结合,促使ATP与NBD结构域结合,随后ATP水解导致NBD和TMD结构域构象改变,底物移位至膜另一侧,最终ADP与磷酸脱离,ABC转运蛋白恢复初始构象[6]。而ABC转运蛋白如何转运不同类型的底物,是许多研究者关注的问题,虽然Neyfakh[10]提出ABC转运蛋白能够借助其较大的疏水结构域,与底物形成疏水效应及静电吸引,从而能够转运多种类型底物,但仍需最终确定ABC转运蛋白的三维结构,才能揭开其奥秘。
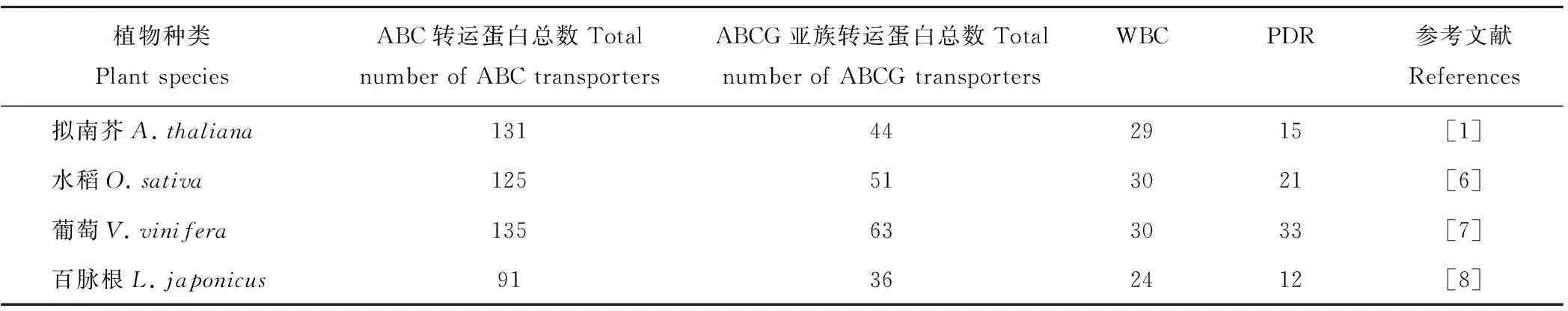
表1 植物ABCG转运蛋白家族成员比较
2ABCG转运蛋白的功能
2.1 转运抗生素
抵抗抗生素类基因常被作为基因工程中的筛选标记基因,如抗卡那霉素的新霉素磷酸转移酶基因nptⅡ。而这些抗性基因多源于土壤细菌。Mentewab和Stewart[11]首次发现在介质中添加卡那霉素后,与对照相比,敲除AtWBC19基因的拟南芥突变体根系生长缓慢,而将AtWBC19或nptⅡ超表达至烟草中,两种转基因烟草植株对卡那霉素的抗性相似;进一步研究发现AtWBC19能够将卡那霉素从细胞质区域化至液泡中,从而减轻卡那霉素对植物细胞的损害。随后Kang等[12]发现超表达AtWBC19的转基因杂种山杨(Populustremuloides)植株叶片不仅能够在含有150 mg/L卡那霉素的介质中萌发再生枝,也能够在含有200 mg/L新霉素,5 mg/L遗传霉素或100 mg/L巴龙霉素中正常分化,且与超表达nptⅡ的植株抗性相似。研究者推测AtWBC19转基因杂种山杨能够体现对多种氨基糖苷类抗生素具有抗性,是由于AtWBC转运蛋白与其他半分子转运蛋白结合发挥作用,扩大了其底物选择范围[12]。这为转基因工程中必需的选择性标记基因提供了新的基因来源,相比其他来源于细菌等的外源抗性基因,源于植物的内源标记基因WBC19可避免转基因植物安全性方面的争议。但目前尚未发现该ABCG亚族中的其他转运蛋白具有类似功能。
2.2 介导植株体内重金属离子的外排
土壤中存在的重金属离子能够破坏植物细胞的膜结构,加剧膜脂过氧化作用,进而导致植株代谢活动受阻,甚至死亡[13-15]。其解毒机制之一是增加对重金属离子的外排[16]。Lee等[17]发现Pd2+处理下,野生型植株地上部AtABCG40/AtPDR12表达量显著上调,且根部出现表达;同时atpdr12突变体生长受抑,鲜重和根长显著低于野生型,且植株地上部Pd含量约为野生型的1.4倍;而该基因超表达植株对Pd抗性增强,植株Pd含量显著低于野生型;由于谷胱甘肽是植物重金属解毒的重要途径之一,为排除其干扰,实验中发现添加谷胱甘肽合成抑制剂后,AtPDR12的作用依然存在,进而推测定位于质膜的AtPDR12能够将Pd离子或化合物主动运出细胞外。随后,Kim等[18]通过测定放射性109Cd排出速率,发现AtABCG36/AtPDR8基因超表达的拟南芥原生质体排出速率远高于基因沉默植株,直接证明定位于表皮细胞质膜的AtPDR8能够介导Cd2+外排至细胞外。可见,AtPDR12与AtPDR8能够依据其底物特异性,主动外排细胞内的重金属,降低植株体内重金属含量,从而提高植株对重金属离子的抗性。
此外,Kim等[19]发现在正常生长条件下,超表达AtABCG36基因的拟南芥植株和atabcg36突变体植株均与野生型长势相同;而在干旱胁迫下或80 mmol/L NaCl处理下,超表达植株长势显著优于野生型,atabcg36突变体植株长势最差。进一步研究发现基因超表达植株体内Na+含量显著低于野生型,而其他离子如K+,Ca2+,Mg2+和P元素含量均无显著差异,因而推测AtABCG36在表皮细胞中可能是通过直接外排Na+提高植株对盐胁迫的耐受能力,或通过间接参与抗氧化胁迫分子的转运,提高植物对干旱胁迫的抗性,其机制仍有待进一步研究[19]。
2.3 介导植物激素的吸收与外排
2.3.1生长素类似物人工合成的生长素类似物2,4-D被广泛运用于双子叶杂草的防治,但植物对其吸收和运输的机制尚不明确。已有对ABC家族参与生长素运输的转运蛋白的研究多集中于ABCB亚族[20-21]。而Ito和Gray[22]发现拟南芥半显性pdr9突变体对生长素类除草剂2,4-D耐受能力提高,是由于AtABCG37/AtPDR9能够将外源性2,4-D排出细胞外,降低其在细胞内的浓度,而同时不影响内源性生长素吲哚-3-乙酸(indole-3-acetic acid,IAA)的运输。
AtPDR9除了参与生长素类似物2,4-D的运输外,还与生长素IAA的前体物质吲哚丁酸(indole-3-butyric acid, IBA)运输有关。研究发现AtPDR9及与其同源性较高的AtABCG36/AtPDR8均在根尖表皮细胞大量分布,能够将IBA外排至细胞外,限制其在植株内的含量,从而维持植株体内生长素含量的平衡,但这两种转运蛋白并不存在功能重叠,因为二者突变体缺陷仍存在差异[23-25]。
2.3.2细胞分裂素细胞分裂素在根部合成后,需运输至地上部参与植株生长发育的调节。最新研究发现atabcg14突变体植株地上部生长缓慢,木质部与韧皮部细胞数量减少,体积变小,而根部较长;且叶片喷施外源性细胞分裂素玉米素能使叶片长势恢复[26]。定量测定发现atabcg14地上部玉米素含量显著低于野生型,而根中含量显著高于野生型;用放射性14C标记的玉米素处理植株根部后,突变体地上部放射性强度显著低于野生型;进一步分析发现突变体木质部汁液中玉米素含量下降约90%,而根中含量则显著升高,表明定位于根部中柱细胞质膜的AtABCG14能够将根部细胞合成的细胞分裂素泵入木质部,进而长距离运输至地上部[27]。由于AtABCG14为half-size型转运蛋白,虽然Le Hir等[28]发现AtABCG14能够与AtABCG11结合为异源二聚体发挥作用,但由于AtABCG11在根部表达量非常低,且在维管束薄壁细胞中不表达,因而排除了二者形成的异源二聚体转运细胞分裂素的可能性。
2.3.3脱落酸脱落酸(ABA)主要在植物维管束薄壁细胞中大量合成,因而需长距离运输至各类植物细胞中,与ABA受体结合进而发挥作用,如运输至保卫细胞调节气孔关闭等[29]。而ABA跨膜运输的分子机制尚不清楚。虽然有研究表明ABA可通过自由扩散作用进入细胞,但Kang等[30]发现在外源ABA处理下,突变体abcg40表现为受ABA诱导的基因表达量上调延迟,且气孔关闭缓慢,耐旱能力降低。将原生质体分离进一步发现突变体细胞吸收ABA速率与野生型相比显著下降,表明拟南芥AtABCG40/AtPDR12参与ABA跨膜运输至细胞内的过程[30]。同时Kuromori等[31]还发现拟南芥AtABCG25能够将ABA跨膜运出细胞外,其编码基因在维管束组织中大量表达,超表达植株由于气孔大量关闭而表现为叶片温度升高,水分散失减少;而突变体由于不能外排多余的ABA,表现为对ABA高度敏感。可见ABCG40与ABCG25分别参与植物细胞ABA的吸收与外排,对于植物迅速、有效地响应逆境具有重要作用。
此外,虽然AtABCG40还与植物细胞外排重金属Pb有关,但是Pb与ABA不存在底物竞争性[30],因而推测突变体abcg40耐受Pb能力下降与其细胞ABA吸收能力受限也有关,由于细胞不能有效吸收ABA,导致气孔关闭迟缓,蒸腾拉力依旧能将体内重金属向地上部大量运输,对植物的毒害作用增强。
2.3.4独角金内酯独角金内酯(strigolactones)最初被发现是由于其能够诱导寄生在根部杂草的萌发,随后的研究表明它能够通过抑制植物地上部腋芽生长,调节植株地上部形态,因而被认为是一种新型的植物激素;此外还发现根部分泌的独角金内酯能够诱导丛枝菌根(arbuscular mycorrhizae,AM)真菌萌发,对于植物吸收有益元素具有重要作用[32-35]。Kretzschmar等[36]在矮牵牛(Petuniahybrida)中首次发现,PhPDR1在侧根皮下通道细胞(hypodermal passage cells,HPCs)大量表达,而该部位由于缺乏木栓质,因而是AM真菌菌丝侵入点[37];phpdr1突变体根部分泌物中独角金内酯含量降低,共生AM真菌减少;而超表达PhPDR1的拟南芥植株能够耐受外源性高浓度的独角金内酯,且从根部上运的独角金内酯含量增加,表明定位于质膜的PhPDR1能通过转运独角金内酯进而参与调节根部共生AM真菌的萌发。而在地上部,PhPDR1仅在茎维管组织及叶腋处大量表达,phpdr1突变体腋芽生长迅速,枝条长度显著大于野生型[36]。参照Brewer等[38]和Crawford等[39]提出的模型,其机制可能是独角金内酯能够运输至腋芽处,作为生长素信使或抑制生长素极性运输,从而抑制腋芽生长。
2.4 参与除草剂的转运
由于除草剂百草枯能够快速、无选择性地除去杂草,被广泛应用于田间管理。Hart等[40]提出植物可能是将百草枯区域化至液泡中,或通过提高抗氧化酶活性抵抗百草枯毒害。Xi等[41]发现在2 μmol/L百草枯处理下,拟南芥缺失AtPDR11基因的纯合子突变体存活率高达82%,而野生型存活率仅有2%;用10 μmol/L14C标记的百草枯处理后,野生型与atpdr11体内百草枯含量在2 h内均显著上升,但最终atpdr11植株体内百草枯含量仅为野生型的33%,且百草枯转运蛋白竞争性抑制剂丁二胺[42]的添加能够降低植株体内百草枯含量,因而推测AtPDR11能够将百草枯转运至植株内进而产生毒害作用,且仍然存在其他转运蛋白参与百草枯的吸收。
2.5 参与木质素单体的转运
木质素单体的合成途径均在细胞质内完成,而其聚合的过程发生于质外体,因而木质素单体跨质膜运输的过程至关重要[43]。Miao和Liu[44]证明ABC转运蛋白参与木质素单体的跨质膜运输,但未确定ABC转运蛋白的种类。Alejandro等[45]研究发现AtABCG29/PDR1与参与木质素单体合成的基因存在高度共表达现象,GUS报告基因显示AtABCG29主要在根和茎的内皮层及维管组织中表达;异源表达AtABCG29能促使酵母外排香豆醇,从而提高酵母对香豆醇的抗性;在1.5 mmol/L 香豆醇处理下,atabcg29植株根长小于野生型,而用其他木质素单体如芥子醇,松柏醇处理,突变体长势与野生型无显著差异,表明AtABCG29能够特异性的转运木质素单体香豆醇。此外实验中还发现atabcg29植株中木质素单体组分羟苯基,愈创木基和紫丁香基含量均显著低于野生型,可能是由于AtABCG29转运蛋白功能的缺失影响了木质素单体的合成及其他两种单体的转运[45]。
2.6 参与表皮角质层脂质的分泌
陆生植物进化的典型特征是植株表皮覆盖了疏水性角质层,能够起到防止非气孔性水分散失、防止机械损伤,阻止器官融合及抵抗病虫害侵袭等重要作用[46]。角质层是由角质(cutin)基质,嵌入及覆盖在角质基质上的蜡质(wax)组成的。角质的主要成分是由羟基脂肪酸和环氧脂肪酸聚酯化形成的有机聚合物,而蜡质主要由饱和超长链脂肪酸(very long chain fatty acids, VLCFAs)及其衍生物如烷烃、醛、醇类、酮类和酯类等组成,还包括萜类和其他微量的次级代谢物如固醇和类黄酮类物质[47-48]。角质层组分在表皮细胞内质体及内质网中合成后,需跨质膜运输至表皮细胞外[49]。Pighin等[50]首次报道了AtABCG12/AtWBC12/CER5参与茎表皮角质层蜡质的跨膜运输,cer5由于蜡质组分不能分泌至表皮细胞外,在表皮细胞质内堆积为片状物;且cer5与野生型植株总蜡质含量(包含表皮细胞内蜡质)相似,但cer5表皮角质层蜡质含量显著低于野生型,进一步表明突变体蜡质合成途径正常,分泌过程受阻。随后,关于角质层脂质(lipid)转运蛋白的研究大量展开。
Bird等[51]发现拟南芥AtABCG11/AtWBC11同时参与角质层角质与蜡质组分的跨膜运输。AtABCG11基因T-DNA插入的突变体表现为表皮细胞内出现薄片状脂质堆积物,同时表皮角质与蜡质组分含量下降,植株矮化,并且还出现叶与茎的器官融合[51]。此外,Panikashvilia等[52]发现AtWBC11基因沉默植株花瓣与角果形态改变,种子出现融合现象,花与角果表皮角质单体含量改变,根木栓质含量降低,表明AtABCG11还参与植株生殖器官角质单体及根部木栓质单体的转运。表达模式分析表明,AtABCG11在表皮细胞特异性表达,且属于光照依赖型,可受到机械损伤、盐胁迫、干旱胁迫以及植物激素ABA的诱导[53-54]。表明角质层的形成与植株生长发育及抵抗逆境胁迫密切相关。此外,对AtABCG11基因沉默的植株表达谱分析发现,AtABCG11基因表达受抑引起了其他与角质层形成相关的16个基因表达量的显著下降,表明AtABCG11介导的脂质跨膜运输是角质层代谢的限速步骤[52]。由于AtABCG12与AtABCG11均属于半分子转运蛋白,因此研究者推测二者是否通过形成二聚体发挥功能。McFarlane等[5]首次证明拟南芥中AtABCG11与AtABCG12可形成异型二聚体,而2个AtABCG11也能够形成同型二聚体。这体现了半分子转运蛋白聚合的灵活性,其聚合方式的多样使其能够运输多种类型的底物。我们课题组对荒漠旱生植物霸王(Zygophyllumxanthoxylum)响应盐处理和渗透胁迫的转录组和基因表达谱分析发现,霸王体内存在33个ABCG亚族编码基因,其中有19个基因在盐处理或渗透胁迫下的表达丰度显著上调,如渗透胁迫24 h时,根中细胞分裂素转运蛋白编码基因ZxABCG14表达量上调2倍,叶中ABA转运蛋白编码基因ZxABCG25表达量上调2.5倍,而尤以角质层脂质转运蛋白编码基因ZxABCG11表现最为突出;我们克隆了霸王ZxABCG11全长cDNA,表达模式分析发现,ZxABCG11基因在幼嫩叶中表达量最高,老叶中表达量最低,仅为嫩叶中的1/2;在50 mmol/L NaCl、-0.5 MPa渗透胁迫或35℃高温处理下,与对照相比,其表达丰度分别上调2,4和5倍,并且均在处理后6 h内达到最大值,表明ZxABCG11基因在霸王适应盐、渗透胁迫及高温过程中发挥着重要作用。
除了以上WBC型转运蛋白参与角质层形成外,在植物中还发现2个PDR型转运蛋白,大麦(Hordeumvulgare) HvABCG31[55]及其在拟南芥中的同源蛋白AtABCG32[56],参与植株角质单体分泌。HvABCG31功能缺失的大麦突变体角质单体含量仅为野生型的50%,角质层厚度为野生型的25%,且离体叶片失水率远大于野生型,进一步证明角质层对植物抗旱保水的意义重大[55]。而atabcg32还表现为花表皮角质主要单体ω-羟基脂肪酸和二羟基棕榈酸酯含量下降约为野生型的40%,表明AtABCG32在转运角质前体物质方面发挥重要作用[56]。
以上研究多集中于植株营养器官表皮角质层,而花表皮角质层对于植物花器官建成及有性生殖也有重要作用。与以上研究中的突变体表型不同,AtABCG13基因敲除的突变体主要表现为花表皮角质含量显著下降,且出现花瓣扭曲及花器官融合现象,但角果及种子的发育并未受影响,表明AtABCG13参与花表皮角质组分的分泌[57]。相比花瓣形态,植物育性意义更为重要。由脂肪酸及酚类聚合而成的孢粉素是花粉外壁的主要组分,是花粉粒的重要保护层[58]。AtABCG26/AtWBC27能将孢粉素前体从绒毡层细胞运至花粉表皮,其基因缺失的突变体难以产生成熟花粉粒,由于花粉外壁存在缺陷因而育性下降,种子数量减少[59-60]。有研究还发现拟南芥AtABCG9和AtABCG31能参与花粉壁组分甾醇糖苷的转运[61]。此外,水稻ABCG15除了具备上述功能外,还参与花药表皮角质层的形成[62]。可见ABCG类转运蛋白对雄性植株育性有重要影响,对于揭示雄性植株不育机制及指导作物生产具有重要理论及实践意义。
2.7 参与植物次生代谢产物的分泌
具有抗菌作用的植物次生代谢产物如萜类、生物碱和酚类等,可以阻止病菌在表皮繁殖,是植物抵抗致病菌的第一道防线[63]。PDR型转运蛋白可通过参与次生代谢产物的分泌,间接参与植物对病害侵袭的抵抗。白花丹叶烟草(Nicotianaplumbaginifolia)NpPDR1和拟南芥AtPDR12的底物均为具抗菌功能的二萜香紫苏醇[64-65]。在致病菌侵染或抗病信号分子化合物(如茉莉酮酸甲酯、水杨酸等)诱导下,许多PDR型转运蛋白编码基因表达量显著上调,如拟南芥AtPDR12[17],AtPDR8[66-67],烟草(Nicotianatabacum)NtPDR1[68-69],白花丹叶烟草NpPDR1[70],大豆(Glycinemax)GmPDR1[71],水稻OsPDR9、OsPDR20[72]等。同时,这些基因沉默会导致植株对病菌侵染更加敏感,抗病能力显著降低[9,73]。豆科植物的次生代谢产物异黄酮也具有抑菌作用,蒺藜苜蓿MtABCG10参与植株异黄酮前体物质的转运,根部基因沉默导致异黄酮苷元含量降低,使致病菌尖孢镰刀菌扩繁速率升高[74]。PDR转运蛋白除了与植物抵抗病原菌相关外,还参与植物抵抗草食动物采食。烟草NtPDR5基因的表达受到草食昆虫烟草天蛾口器分泌物的诱导,用NtPDR5基因沉默的植株饲喂烟草天蛾,昆虫生长发育状态显著优于饲喂野生型烟草的昆虫,表明烟草NtPDR5参与植株分泌有毒化合物,进而抑制草食昆虫烟草天蛾的采食[75],但对其转运的底物种类尚不清楚。
植物根系分泌的次生代谢产物还与诱导土壤有益真菌有关。对于豆科植物而言,根系分泌物中的类黄酮是与根瘤菌共生识别阶段的重要信号分子。采用多种磷酸酶抑制剂抑制ABCG转运蛋白活性时,PDR型转运蛋白抑制剂的使用能显著降低大豆根部金雀异黄酮和大豆黄酮的分泌,且EST数据库分析发现PDR转运蛋白编码基因在根部大量表达,因而推测PDR转运蛋白是根部分泌类黄酮物质的主要蛋白之一[76-77]。此外还发现属于half-size型的ABCG转运蛋白STR功能缺失能导致蒺藜苜蓿、水稻根系AM真菌菌丝分枝减少,植株与AM真菌共生失败[78-79],其作用机制是STR与STR2形成异源二聚体,但其底物类型尚不清楚,但已排除其底物是独脚金内酯的可能性;此外,在已完成全基因组测序的维管植物中均发现了STR同源基因,但拟南芥中没有发现。
3展望
由于ABCG转运蛋白参与植物的多种生理代谢活动,受到了学术界的广泛重视。随着研究的不断深入,除模式植物拟南芥外,也发现了许多作物及牧草中的ABCG转运蛋白。但由于其家族的庞大,功能的复杂多样,尚有很多ABCG转运蛋白的功能未被发掘。因而,基于目前的研究现状,今后对ABCG转运蛋白的研究可从以下几个方面展开:1)在拟南芥和水稻等模式植物中进一步深入分析其他功能未知的ABCG转运蛋白在植物生命活动中的功能和转运机制。2)选择具有代表性的植物类型为研究对象,采用分子生物学手段发掘其ABCG转运蛋白编码基因,结合RNA干扰等方法揭示其在不同生理代谢、抗逆性中的重要作用。3)采用蛋白质组学等方法并结合已发现的ABCG转运蛋白的功能,深入解析其跨膜运输机制并进一步确定其转运的底物类型。4)采用基因工程方法,将已发掘的具有重要应用价值的ABCG蛋白编码基因转入经济作物、粮食作物及饲料作物中,提高其产量、品质及抗性,将理论结果运用于生产实践。
References:
[1]Verrier P J, Bird D, Burla B,etal. Plant ABC proteins a unified nomenclature and updated inventory. Trends in Plant Science, 2008, 13: 151-159.
[2]Bairoch A. Prosite: a dictionary of sites and patterns in proteins. Nucleic Acids Research, 1992, 20: 2013-2018.
[3]Ewart G D, Cannell D, Cox G B,etal. Mutational analysis of the traffic ATPase (ABC) transporters involved in uptake of eye pigment precursors inDrosophilamelanogaster, implications for structure-function relationships. Journal of Biological Chemistry, 1994, 269: 10370-10377.
[4]Tarr P T, Tarling E J, Bojanic D D,etal. Emerging new paradigms for ABCG transporters. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids, 2009, 1791: 584-593.
[5]McFarlane H E, Shin J J, Bird D A,etal.ArabidopsisABCG transporters, which are required for export of diverse cuticular lipids, dimerize in different combinations. The Plant Cell, 2010, 22: 3066-3075.
[6]Jasinski M, Ducos E, Martinoia E,etal. The ATP-Binding cassette transporters: structure, function, and gene family comparison between rice andArabidopsis. Plant Physiology, 2003, 131: 1169-1177.
[7]Çaklr B, Klllçkaya O. Whole-Genome survey of the putative ATP-binding cassette transporter family genes inVitisvinifera. PLOS One, 2013, 8: e78860.
[8]Sugiyama A, Shitan N, Sato S,etal. Genome-wide analysis of ATP-binding cassette (ABC) proteins in a model legume plant,Lotusjaponicus: comparison withArabidopsisABC protein family. DNA Research, 2006, 13: 205-228.
[9]Jasinski M, Banasiak J, Radom M,etal. Full-size ABC transporters from the ABCG subfamily inMedicagotruncatula. Molecular Plant Microbe Interaction, 2009, 22: 921-931.
[10]Neyfakh A A. Mystery of multidrug transporters: the answer can be simple. Molecular Microbiology, 2002, 44: 1123-1130.
[11]Mentewab A, Stewart C N. Overexpression of anArabidopsisthalianaABC transporter confers kanamycin resistance to transgenic plants. Nature Biotechnology, 2005, 23: 1177-1180.
[12]Kang B G, Ye X, Osburn L D,etal. Transgenic hybrid aspen overexpressing theAtWBC19 gene encoding an ATP-binding cassette transporter confers resistance to four amino glycoside antibiotics. Plant Cell Reports, 2010, 29: 643-650.
[13]Chen W, Zhang M M, Song Y Y,etal. Impacts of heavy metals on the fluorescence characteristics and root morphology of 2 turfgrass species. Acta Prataculturae Sinica, 2014, 23(3): 333-342.
[14]Li X, Wu Y J, Sun L X. Growth and physiological responses of three warm-season turfgrasses to lead stress. Acta Prataculturae Sinica, 2014, 23(4): 171-180.
[15]Gao H N, Ma G T, Li C X,etal. Effects of a microorganism on grass seedling physiological and biochemical characteristics when grown in Cr(VI) polluted soil. Acta Prataculturae Sinica, 2014, 23(4): 189-194.
[16]Pourrut B, Shahid M, Dumat C,etal. Lead uptake, toxicity, and detoxification in plants. Reviews of Environmental Contamination and Toxicology, 2011, 213: 113-136.
[17]Lee M, Lee K, Lee J,etal. AtPDR12 contributes to lead resistance inArabidopsis. Plant Physiology, 2005, 138: 827-836.
[18]Kim D Y, Bovet L, Maeshima M,etal. The ABC transporter AtPDR8 is a cadmium extrusion pump conferring heavy metal resistance. The Plant Journal, 2007, 50: 207-218.
[19]Kim D Y, Jin J Y, Alejandrob S,etal. Overexpression of AtABCG36 improves drought and salt stress resistance inArabidopsis. Physiologia Plantarum, 2010, 139: 170-180.
[20]Multani D S, Briggs S P, Chamberlin M A,etal. Loss of an MDR transporter in compact stalks of maizebr2 and sorghumdw3 mutants. Science, 2003, 302: 81-84.
[21]Geisler M, Murphy A S. The ABC of auxin transport: the role of p-glycoproteins in plant development. FEBS Letters, 2006, 580: 1094-1102.
[22]Ito H, Gray W M. A gain-of-function mutation in theArabidopsispleiotropic drug resistance transporter PDR9 confers resistance to auxinic herbicides. Plant Physiology, 2006, 142: 63-74.
[23]Strader L C, Monroe-Augustus M, Rogers K C,etal.Arabidopsisibaresponse5 (ibr5) suppressors separate responses to various hormones. Genetics, 2008, 180: 2019-2031.
[24]Strader L C, Bartel B. TheArabidopsisPLEIOTROPIC DRUG RESISTANCE8/ABCG36 ATP binding cassette transporter modulates sensitivity to the auxin precursor indole-3-Butyric acid. The Plant Cell, 2009, 21: 1992-2007.

[26]Ko D, Kang J, Kiba T,etal.ArabidopsisABCG14 is essential for the root-to-shoot translocation of cytokinin. Proceedings of the National Academy of Sciences of USA, 2014, 111: 7150-7155.
[27]Zhang K W, Novak O, Wei Z Y,etal.ArabidopsisABCG14 protein controls the acropetal translocation of root-synthesized cytokinins. Nature Communacation, 2014, doi:10.1038/ncomms4274.
[28]Le Hir R, Sorin C, Chakraborti D,etal. ABCG9, ABCG11 and ABCG14 ABC transporters are required for vascular development inArabidopsis. Plant Journal, 2013, 76: 811-824.
[29]Kanno Y, Hanada A, Chiba Y,etal. Identification of an abscisic acid transporter by functional screening using the receptor complex as a sensor. Proceedings of the National Academy of Sciences of USA, 2012, 109: 9653-9658.
[30]Kang J, Hwang J U, Lee M,etal. PDR-type ABC transporter mediates cellular uptake of the phytohormone abscisic acid. Proceedings of the National Academy of Sciences of USA, 2010, 107: 2355-2360.
[31]Kuromori T, Miyaji T, Hikaru Y,etal. ABC transporter AtABCG25 is involved in abscisic acid transport and responses. Proceedings of the National Academy of Sciences of USA, 2010, 107: 2361-2366.
[32]Umehara M, Hanada A, Yoshida S,etal. Inhibition of shoot branching by new terpenoid plant hormones. Nature, 2008, 455: 195-200.
[33]Gomez-Roldan V, Fermas S, Brewer P B,etal. Strigolactone inhibition of shoot branching. Nature, 2008, 455: 189-194.
[34]Yang H X, Liu R J, Guo S X. Effects of arbuscular mycorrhizal fungusGlomusmosseaeon the growth characteristics ofFestucaarundinaceaunder salt stress conditions. Acta Prataculturae Sinica, 2014, 23(4): 195-203.
[35]Wu Q S, Yuan F Y, Fei Y J,etal. Effects of arbuscular mycorrhizal fungi on root system architecture and sugar contents of white clover. Acta Prataculturae Sinica, 2014, 23(1): 199-204.
[36]Kretzschmar T, Kohlen W, Sasse J,etal. A petunia ABC protein controls strigolactone-dependent symbiotic signalling and branching. Nature, 2012, 483: 341-346.
[37]Sharda J N, Koide R T. Can hypodermal passage cell distribution limit root penetration by mycorrhizal fungi. New Phytologist, 2008, 180: 696-701.
[38]Brewer P B, Dun E A, Ferguson B J,etal. Strigolactone acts downstream of auxin to regulate bud outgrowth in pea andArabidopsis. Plant Physiology, 2009, 150: 482-493.
[39]Crawford S, Shinohara N, Sieberer T,etal. Strigolactones enhance competition between shoot branches by dampening auxin transport. Development, 2010, 137: 2905-2913.
[40]Hart J J, Ditomaso J M, Linscott D L,etal. Transport interactions between paraquat and polyamines in roots of intact maize seedlings. Plant Physiology, 1992, 99: 1400-1405.
[41]Xi J, Xu P, Xiang C B. Loss of AtPDR11, a plasma membrane-localized ABC transporter, confers paraquat tolerance inArabidopsisthaliana. The Plant Journal, 2012, 69: 782-791.
[42]Hart J J, DiTomaso J M, Kochian L V. Characterization of paraquat transport in protoplasts from maize (ZeamaysL.) suspension cells. Plant Physiology, 1993, 103: 963-969.
[43]Whetten R, Sederoff R. Lignin biosynthesis. Plant Cell, 1995, 7:1001-1013.
[44]Miao Y C, Liu C J. ATP-binding cassette-like transporters are involved in the transport of lignin precursors across plasma and vacuolar membranes. Proceedings of the National Academy of Sciences of USA, 2010, 107: 22728-22733.
[45]Alejandro S, Lee Y, Tohge T,etal. AtABCG29 is a monolignol transporter involved in lignin biosynthesis. Current Biology, 2012, 22: 1207-1212.
[46]Neinhuis C, Barthlott W. Characterization and distribution of water-repellent, self-cleaning plant surfaces. Annals of Botany, 1997, 79: 667-677.
[47]Bernard A, Joubès J.Arabidopsiscuticular waxes: Advances in synthesis, export and regulation. Progress in Lipid Research, 2013, 52: 110-129.
[48]Li J J, Huang J H, Xie S C. Plant wax and its response to environmental conditions. Acta Ecologica Sinica, 2011, 31(2): 565-574.
[49]Kunst L, Samuels A L. Biosynthesis and secretion of plant cuticular wax. Progress in Lipid Research, 2003, 42: 51-80.
[50]Pighin J A, Zheng H, Balakshin L J,etal. Plant cuticular lipid export requires an ABC transporter. Science, 2004, 306: 702-704.
[51]Bird D, Beisson F, Brigham A,etal. Characterization ofArabidopsisABCG11/WBC11, an ATP binding cassette (ABC) transporter that is required for cuticular lipid secretion. The Plant Journal, 2007, 52: 485-498.
[52]Panikashvilia D, Shi J X, Samuel B. TheArabidopsisDSO/ABCG11 transporter affects cutin metabolism in reproductive organs and suberin in roots. Molecular Plant, 2010, 3: 563-575.
[53]Luo B, Xue X Y, Hu W L,etal. An ABC transporter gene ofArabidopsisthaliana,AtWBC11, is involved in cuticle development and prevention of organ fusion. Plant & Cell Physiology, 2007, 48: 1790-1802.
[54]Panikashvili D, Sigal S G, Tali M,etal. TheArabidopsisDESPERADO/AtWBC11 transporter is required for cutin and wax secretion. Plant Physiology, 2007, 145: 1345-1360.
[55]Chen G X, Komatsuda T, Ma J F,etal. An ATP-binding cassette subfamily G full transporter is essential for the retention of leaf water in both wild barley and rice. Proceedings of the National Academy of Sciences of USA, 2011, 108: 12354-12359.
[56]Bessire M, Borel S, Fabre G,etal. A member of the pleiotropic drug resistance family of ATP binding cassette transporters is required for the formation of a functional cuticle inArabidopsis. The Plant Cell, 2011, 23: 1958-1970.
[57]Panikashvili D, Shi J X, Schreiber L,etal. TheArabidopsisABCG13 transporter is required for flower cuticle secretion and patterning of the petal epidermis. New Phytologist, 2011, 190: 113-124.
[58]Huang L C, Jin L, Zhang S Z,etal. Pollen release mechanisms of papilionaceous plants(Faboideae). Acta Prataculturae Sinica, 2013, 22(6): 305-314.
[59]Quilichini T D, Friedmann M C, Samuels A L,etal. ATP-Binding cassette transporter G26 is required for male fertility and pollen exine formation inArabidopsis. Plant Physiology, 2010, 154: 678-690.
[60]Choi H, Jin J Y, Choi S,etal. An ABCG/WBC-type ABC transporter is essential for transport of sporopollenin precursors for exine formation in developing pollen. The Plant Journal, 2011, 65: 181-193.
[61]Choi H, Ohyama K, Kim Y Y,etal. The role ofArabidopsisABCG9 and ABCG31 ATP binding cassette transporters in pollen fitness and the deposition of steryl glycosides on the pollen coat. The Plant Cell, 2014, 26: 310-324.
[62]Qin P, Tu B, Wang Y,etal.ABCG15 encodes an ABC transporter protein, and is essential for post-meiotic anther and pollen exine development in rice. Plant & Cell Physiology, 2013, 54: 138-154.
[63]Weston L A, Ryan P R, Watt M. Mechanisms for cellular transport and release of allelochemicals from plant root into the rhizosphere. Journal of Experimental Botany, 2012, 63: 3445-3454.
[64]Campbell E J, Schenk P M, Kazan K,etal. Pathogen-responsive expression of a putative ATP-binding cassette transporter gene conferring resistance to the diterpenoid sclareol is regulated by multiple defense signaling pathways inArabidopsis. Plant Physiology, 2003, 133: 1272-1284.
[65]Stukkens Y, Bultreys A, Grec S,etal. NpPDR1, a pleiotropic drug resistance-type ATP binding cassette transporter fromNicotianaplumbaginifolia, plays a major role in plant pathogen defense. Plant Physiology, 2005, 139: 341-352.
[66]Kobae Y, Sekino T, Yoshioka H,etal. Loss of AtPDR8, a plasma membrane ABC transporter ofArabidopsisthaliana, causes hypersensitive cell death upon pathogen infection. Plant Cell Physiology, 2006, 47: 309-318.
[67]Stein M, Dittgen J, Sanchez-Rodriguez C,etal.ArabidopsisPEN3/PDR8, an ATP binding cassette transporter, contributes to non-host resistance to inappropriate pathogens that enter by direct penetration. The Plant Cell, 2006, 18: 731-746.
[68]Sasabe M, Toyoda K, Shiraishi T,etal. cDNA cloning and characterization of tobacco ABC transporter: NtPDR1 is a novel elicitor-responsive gene. FEBS Letters, 2002, 518: 164-168.
[69]Crouzet J, Roland J, Peeters E,etal. NtPDR1, a plasma membrane ABC transporter fromNicotianatabacum, is involved in diterpene transport. Plant Molecular Biology, 2013, 82: 181-192.
[70]Bultreys A, Trombik T, Drozak A,etal.Nicotianaplumbaginifoliaplants silenced for the ATP-binding cassette transporter geneNpPDR1 show increased susceptibility to a group of fungal and oomycete pathogens. Molecular Plant Pathology, 2009, 10: 651-663.
[71]Eichhorn H, Klinghammer M, Becht P,etal. Isolation of a novel ABC-transporter gene from soybean induced by salicylic acid. Journal of Experimental Botany, 2006, 57: 2193-2201.
[72]Moons A. Transcriptional profiling of the PDR gene family in rice roots in response to plant growth regulators, redox perturbations and weak organic acid stresses. Planta, 2008, 229: 53-71.
[73]Krattinger S G, Lagudah E S, Spielmeyer W,etal. A putative ABC transporter confers durable resistance to multiple fungal pathogens in wheat. Science, 2009, 323: 1360-1363.
[75]Bienert M D, Gerlitz S E, Drozak A,etal. A pleiotropic drug resistance transporter inNicotianatabacumis involved in defense against the herbivoreManducasexta. The Plant Journal, 2012, 72: 745-757.
[76]Sugiyama A, Shitan N, Yazaki K. Involvement of a soybean ATP binding cassette-type transporter in the secretion of genistein, a signal flavonoid in legume-rhizobium symbiosis. Plant Physiology, 2007, 144: 2000-2008.
[77]Sugiyama A, Shitan N, Yazaki K. Signaling from soybean roots to rhizobium, an ATP-binding casstte-type transporter mediates genistein secretion. Plant Signaling & Behavior, 2008, 3: 38-40.
[78]Zhang Q, Blaylock L A, Harrison M J. TwoMedicagotruncatulahalf-ABC transporters are essential for arbuscule development in arbuscular mycorrhizal symbiosis. The Plant Cell, 2010, 22: 1483-1497.
[79]Gutjahr C, Radovanovic D, Geoffroy J,etal. The half-size ABC transporters STR1 and STR2 are indispensable for mycorrhizal arbuscule formation in rice. The Plant Journal, 2012, 69: 906-920.
参考文献:
[13]陈伟, 张苗苗, 宋阳阳, 等. 重金属离子对2种草坪草荧光特性及根系形态的影响. 草业学报, 2014, 23(3): 333-342.
[14]李西, 吴亚娇, 孙凌霞. 铅胁迫对三种暖季型草坪草生长和生理特性的影响. 草业学报, 2014, 23(4): 171-180.
[15]高海宁, 马国泰, 李彩霞, 等. 菌剂对铬污染土壤中坪草幼苗生理生化的影响. 草业学报, 2014, 23(4): 189-194.
[34]杨海霞, 刘润进, 郭绍霞. AM真菌摩西球囊霉对盐胁迫条件下高羊茅生长特性的影响. 草业学报, 2014, 23(4): 195-203.
[35]吴强盛, 袁芳英, 费永俊, 等. 丛枝菌根真菌对白三叶根系构型和糖含量的影响. 草业学报, 2014, 23(1): 199-204.
[48]李婧婧, 黄俊华, 谢树成. 植物蜡质及其与环境的关系. 生态学报, 2011, 31(2): 565-574.
[58]黄利春, 金樑, 张树振, 等. 蝶形花亚科植物花粉释放机制. 草业学报, 2013, 22(6): 305-314.

