铅 镉对小鼠肝脏毒性作用的形态学观察
任亚萍,廖 卒,孙 莉,陈 筠,王秀杰,罗光斌(.桂林医学院组胚教研室,广西 桂林500;.桂林市公安局七星分局技术科,广西桂林500;.桂林医学院008 级药学系,广西 桂林500;.桂林医学院009 级临床医学系,广西 桂林500)
目前,世界上使用的化学物质已达60 万种,每年还有上千种化学物质进入市场[1]。铅、镉作为工业生产中普遍应用的化学物质,是已知非常重要的重金属类环境激素[2],是重要的职业危害因素和环境污染物,可作用于机体多种器官。受到铅、镉暴露的人或动物会造成各种不正常的生物效应。由于铅、镉在体内有积蓄作用[3],所以,长期低剂量接触会影响动物或人的肝脏功能。一直以来,重金属对肝脏的影响已成为生态毒理学研究的一个重要课题,但对铅、镉的毒性作用机制至今仍众说纷纭。为进一步探讨铅、镉对肝脏的毒性作用机制,本实验选择小鼠作为研究对象,研究成年小鼠长期接触醋酸铅和氯化镉对其肝脏的累积毒性作用,并从形态学角度探讨其毒性的可能机制,为重金属对人类和动物肝脏的毒理作用研究提供参考和基础资料。
1 材料与方法
1.1 主要试剂 醋酸铅[Pb(CH3COO)2·3H2O],相对分子质量0.379×103(天津市化学试剂三厂),分析纯试剂;氯化镉(CdCl2·2.5 H2O),相对分子质量0.228×103(广州化学试剂厂),化学纯试剂。
1.2 实验动物 取8 周龄昆明小鼠(桂林医学院提供)30 只,体质量为25~30 g,随机分为三组,分别为醋酸铅给药组、氯化镉给药组和生理盐水组(阴性对照组),每组10 只。实验期间小鼠常规饲养管理,室温饲养(实验期间因喂养不当,各组均有伤亡,最终各组以6 只统计)。
1.3 醋酸铅、氯化镉染毒方法及程序 用蒸馏水配制3.2 mg/mL的醋酸铅溶液和氯化镉溶液。小鼠按照40 mg/(kg·d)分别经口灌胃给予醋酸铅溶液和氯化镉溶液,对照组经口灌胃给予相应体积的生理盐水。共给药40 d。从给药之日起,每3 天称体质量1 次。
1.4 取材和切片的制备 给药40 d 后断颈处死小鼠,取出小鼠肝脏,用电子天平称质量,做好标记,放入10%甲醛固定液固定。制备成石蜡切片,采用苏木精-伊红(HE)染色法对其染色,做好的切片阴干,干燥环境下保存,在显微镜下观察结果。
1.5 观察指标 通过显微镜(×100、×400 放大)观察经HE 染色的各组肝脏切片的形态改变;记录各组小鼠体质量、肝脏质量及肝脏指数。肝脏指数=肝脏质量(g)/体质量(g)×100%。
1.6 统计学处理 应用PEMS 统计软件对小鼠体质量、肝脏质量等数据进行均值比较的方差分析,P<0.05 为差异有统计学意义。
2 结 果
2.1 三组各项观察指标比较 铅、镉对小鼠体质量的影响结果显示,醋酸铅给药组与阴性对照组比较,差异有统计学意义(P<0.05),氯化镉给药组与阴性对照组比较,差异无统计学意义(P>0.05);铅、镉对小鼠肝脏质量的影响结果显示,醋酸铅给药组和氯化镉给药组与阴性对照组比较,差异均无统计学意义(P>0.05),见表1。
表1 三组小鼠体质量增加、肝脏质量及肝脏指数比较(±s)
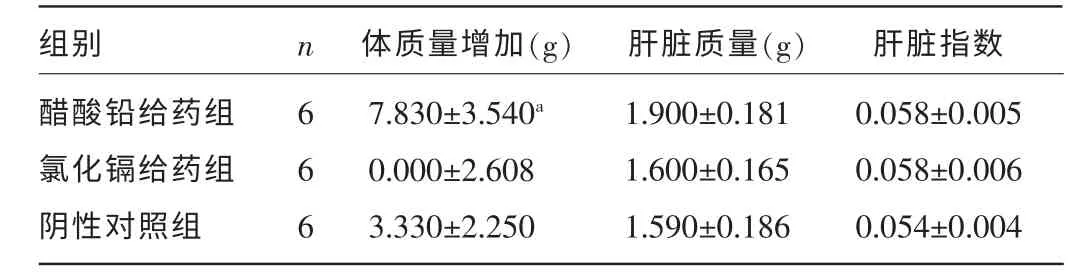
表1 三组小鼠体质量增加、肝脏质量及肝脏指数比较(±s)
注:与阴性对照组比较,aP<0.05。
组别醋酸铅给药组氯化镉给药组阴性对照组n 体质量增加(g) 肝脏质量(g) 肝脏指数666 7.830±3.540a 0.000±2.608 3.330±2.250 1.900±0.181 1.600±0.165 1.590±0.186 0.058±0.005 0.058±0.006 0.054±0.004
2.2 各组肝脏切片HE 染色结果 显微镜下形态学结构观察显示,醋酸铅对小鼠肝脏的毒性作用主要表现在中央静脉周围有炎症细胞聚集,而肝细胞基本无病理改变;氯化镉对小鼠肝脏的毒性作用主要表现在出现多发的点、片性坏死病变及大量肝细胞的水样变性;阴性对照组小鼠肝细胞正常,无炎症细胞聚集现象。见图1~6。
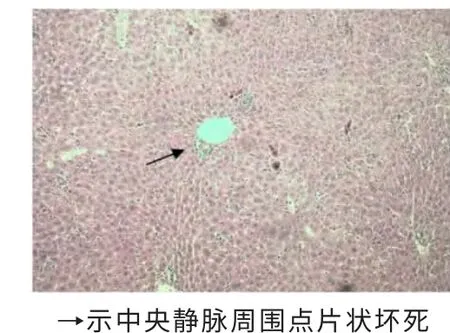
图1 醋酸铅给药组肝脏HE染色(×100)

图2 醋酸铅给药组肝脏HE染色(×400)

图3 氯化镉给药组肝脏HE染色(×100)
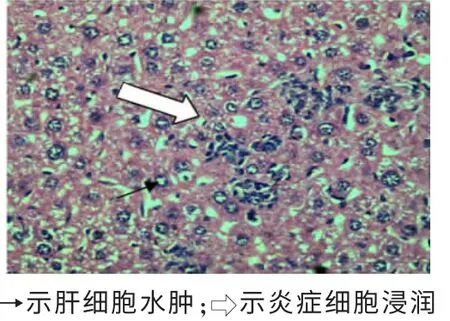
图4 氯化镉给药组肝脏HE染色(×400)

图5 阴性对照组肝脏HE染色(×100)

图6 阴性对照组肝脏HE染色(×400)
3 讨 论
本研究结果显示,醋酸铅给药组肝脏切片组织受毒性作用的影响不明显,但体质量与阴性对照组比较增加明显,差异有统计学意义(P<0.05),推测醋酸铅对小鼠毒性作用的部位在消化系统,影响了消化酶的合成或生物作用,进而影响了小鼠的脂质代谢功能,故使脂肪堆积、体质量增加。而氯化镉给药组几乎无体质量改变,尽管与阴性对照组比较体质量变化差异无统计学意义(P>0.05),但也不能说明镉对小鼠的消化系统没有影响,其影响程度不大的原因也可能与镉的给药剂量有关。镉的中毒剂量、影响镉毒性的因素以及镉的最低中毒剂量和镉在日常饲料中的安全剂量等,目前尚无明确规定,因为镉的代谢和毒性受到日常饲料中与镉有相互作用的多种元素的强烈影响[4]。经查阅相关文献,确定本次实验中镉的给药剂量为40 mg/(kg·d),并选择适宜的饲养方式和给药途径[4-5],确定给药方法为灌胃给药[6-8]。而镉对肝脏代谢的影响主要是作用于肝脏转铁蛋白酶,并抑制其合成,降低其解毒能力。镉对肝脏的影响另一方面是由于镉对肝脏的氧化损伤影响了肝组织中脂质过氧化代谢产物丙二醛(MDA)的水平以及超氧化物歧化酶(SOD)、谷胱甘肽过氧化酶(GSH-Px)、过氧化氢酶[9]的活性。以往有研究证实,电镜下观察肝组织形态学结构均有明显改变[10-11],使肝细胞线粒体的损伤受到较多关注。在本实验中,氯化镉给药组镉对肝脏的损伤其形态学表现已经比较突出,有点、片性坏死病变出现,并有大量肝细胞的水样变性,炎症细胞聚集明显。而醋酸铅则是以影响肝脏功能为主,并未表现出明显的显微结构的损伤。有研究指出,镉致肝脏的损伤从分子水平上可能有氧化应激过程的保护机制,如硫代巴比妥酸反应产物的产生[12]。另有研究指出,锌离子或中药加味四君子汤等对镉致肝脏损伤有保护作用等[13]。那么,醋酸铅与氯化镉对肝脏的损伤在作用机制上有无一致或协同或拮抗效应,其分子生物学水平的作用机制如何,以及对铅、镉致机体损伤的保护机制还有哪些都有待进一步研究。同时,本实验成功构建了铅、镉导致肝脏病理形态学改变的小鼠模型,有助于铅、镉肝脏毒性机制的深入研究。
[1] 高锦声,万加华. 微核检测技术在医学中的应用[J]. 自然杂志,1987,10(6):425-428.
[2] 周庆祥,江桂斌. 浅谈环境内分泌干扰物质[J]. 科学术语研究,2001,3(3):12-14.
[3] 刘继华,何晓宏,牟志浩,等. 恩施州9 类食品中铅、镉和汞含量监测结果[J]. 职业与健康,2012,28(18):2261-2262.
[4] 杨自军. 镉的污染及对动物的危害与防治[J]. 中国动物保健,2008(5):55-60.
[5] 马保华,史志诚,艾小云,等. 醋酸铅对小鼠受精能力及受精卵发育毒性研究[J]. 西北大学学报:自然科学版,2006,36(1):93-96.
[6] 王薛君,张玉敏,李海山,等. 双酚A 对小鼠生殖和发育毒性的研究[J]. 中国职业医学,2005,32(3):37-39.
[7] 石莹,张宏伟. 乙酸铅染毒对小鼠脑、肝、肾生化指标、抗氧化系统及微量元素的影响[J]. 环境与健康杂志,2010,27(5):448-450.
[8] 魏帅,郭波莉,魏益民,等. 铅在猪不同组织和器官中的富集状态[J]. 中国兽医学报,2009,29(11):1459-1462.
[9] 王杨科,路宏朝,王琦. 镉对泥鳅肝脏及其过氧化氢酶的影响[J]. 动物医学进展,2012,33(4):52-55.
[10] 杨巧媛,董胜璋. 锌金属硫蛋白对镉致肝肾损伤的修复作用研究[J]. 中国公共卫生,2002,18(12):1416-1417.
[11] Pal S,Pal PB,Das J,et al.Involvement of both intrinsic and extrinsic pathways in hepatoprotection of arjunolic acid against cadmium induced acute damage in vitro[J].Toxicology,2011,283(2/3):129-139.
[12] Staneviciene I,Sadauskiene I,Lesauskaite V,et al.Subacute effects of cadmium and zinc ions on protein synthesis and cell death in mouse liver[J].Medicina(Kaunas),2008,44(2):131-138.
[13] 陈强,刘丽,肖银霞,等.中药加味四君子汤与镉对鸡肝脏ATP酶活性的颉颃效应[J]. 中国农学通报,2012,28(14):93-95.

