RGS17 在不同肝癌细胞株及HuH7 裸鼠移植瘤中的表达
曹 静,王云杰,李俊生(. 临沂市人民医院药学部,山东 临沂76003;. 临沂经济技术开发区人民医院,山东 临沂7603)
异源三聚体鸟苷酸调节蛋白(G 蛋白)信号通路在正常肝组织生长和再生中起着重要作用[1],而在肝癌组织中G 蛋白的表达和功能均失常[2]。鉴于G 蛋白的表达和功能对正常肝细胞及肝癌细胞均有十分重要的作用,作者设想G 蛋白信号转导调节因子(regulator of G protein signalling,RGS)在调节肝细胞癌形成的过程中可能也起着同样重要的作用。2013 年1~10 月,作者从体外细胞株和裸鼠体内2 个层面观察了RGS17 在正常肝细胞和肝癌细胞株的表达,探讨其在肝细胞癌发生和发展中的作用。
1 材料与方法
1.1 材料
1.1.1 细胞及动物 肝癌细胞株HepG2、HuH7 及正常肝细胞株THLE-2(上海交通大学上海市肿瘤研究所惠赠);无特定病原体(SPF)4 周龄雄性裸鼠10 只[购于上海斯莱克动物中心,批号SCXK(沪)2012-0002]。
1.1.2 主要试剂与仪器
1.1.2.1 主要试剂 细胞培养用胎牛血清(美国Gibco 公司原装进口)和DMEM 培养基(杜氏改良培养基,美国Gibco 公司产品);实时荧光定量聚合酶链反应(real-time PCR)两步法试剂盒及逆转录酶(日本Takara 公司产品);Trizol 试剂(美国Invitrogen 公司产品);引物(上海生工有限公司合成);焦磷酸二乙酯(DEPC)水(购自杭州碧云天公司);氯仿(购自Sigma 公司);异丙醇(购自德国Merck 公司);抽提RNA 用无RNA 酶EP 管和real-time-PCR 管(购自美国Axygen 公司);CCK-8 试剂(日本同仁公司生产,原装进口)。
1.1.2.2 主要仪器 细胞培养皿和96 孔培养板(美国Corning 公司);5%CO2细胞培养箱和处理细胞用超净工作台(EQR/GL-65,美国Thermo 公司生产);逆转录聚合酶链反应仪(美国Bio-Rad 公司生产);real-time-PCR 仪(美国ABI 公司生产)。
1.2 方法
1.2.1 细胞培养 肝癌细胞株HepG2、HuH7 及正常肝细胞株THLE-2 用DMEM 细胞培养液及10%胎牛血清培养,培养液中加入青霉素(100 μg/mL)和链霉素(50 μg/mL)以防止细胞污染。细胞在37 ℃、5%CO2无菌细胞培养箱中培养(时间不固定,根据细胞生长情况,至少2 d 以上)。细胞换液、传代、冻存等操作均在无菌细胞超净工作台进行。细胞贴壁生长至80%覆盖时传代,先用磷酸盐缓冲液(PBS)冲洗,再用2.5%胰酶0.5 mL 消化,镜下见细胞变圆时弃去胰酶溶液,用含10%胎牛血清培养基吹打,将1 个细胞培养皿的细胞传入3 个细胞培养皿备用。
1.2.2 细胞增殖活力检测 将细胞消化计数,铺入96 孔细胞培养板,每孔约2 000 个细胞。从铺板第2 天起检测细胞活性,每天1次。检测时将孔中培养基吸净,加入用培养基配成的10%CCK-8检测试剂,37 ℃放置1.5 h,用酶标仪在450 nm 波长检测其光密度(OD)值,间接反映细胞活性。
1.2.3 动物皮下移植成瘤模型的建立 取SPF 4 周龄雄性裸鼠10 只,采用自身对照试验,在裸鼠皮下接种肝癌细胞株HuH7,成瘤后检测瘤组织(模型组)和肝组织(对照组)中RGS17 mRNA 的表达差异。具体方法如下。
1.2.3.1 模型组 扩增培养HuH7 细胞,从6 cm 培养皿传入10 cm培养皿,使细胞数达到2×107个;消化细胞,显微镜下计数,用不加胎牛血清的DMEM 培养液稀释细胞至1×104μL-1,置于冰上;用1 mL 注射器将培养的细胞悬液200 μL 皮下注射于裸鼠左侧腹股沟处,每3 天观察成瘤情况;成瘤后28 d 取瘤时,将裸鼠用戊巴比妥钠(30 mg/kg)麻醉,用组织剪剪开裸鼠皮肤,用镊子及眼科剪协助将肿瘤组织从皮下完整剥离切除,称质量后放入PBS中等待裂解提取总RNA。
1.2.3.2 对照组 将裸鼠用戊巴比妥钠麻醉,组织剪小心剪开其皮肤,用镊子夹起胸骨,剪开腹部肌肉暴露腹腔,将肝脏完全切除,放入PBS 中等待裂解提取RNA。
1.2.4 总RNA 提取及逆转录 将1.2.1 中培养的3 种细胞和1.2.3 中移植的瘤块组织(每块1 g)用PBS 冲洗,对瘤块组织和肝组织抽提的RNA,应先用匀浆器匀浆,加入1 mL Trizol 试剂,反复吹打消化后,加入200 μL 氯仿,振荡混匀15 s,室温静置3 min,然后4 ℃、12 000 r/min 离心15 min。微量移液器吸取上清液放入新的无RNA 酶的1.5 mL EP 管中。每管加500 μL 预先冰上冷冻的异丙醇,-20 ℃沉淀0.5 h,然后4 ℃、12 000 r/min 离心15 min。离心后可见管底有白色RNA 沉淀,用DEPC 水配制的75%无水乙醇洗一遍后晾干,用50 μL DEPC 水溶解RNA 备用。取1 μL 作为逆转录模板,80 ℃5 s、37 ℃15 min 进行逆转录。
1.2.5 real-time-PCR 引物序列 将逆转录获得cDNA 稀释10 倍,取4 μL 为模板配制50 μL 反应液。RGS 上游引物序列:5′-CAGAG GCCCAACAACACCTG-3′;下游引物序列:5′-TGTGGGTCTTCCCGCATTTT-3′。甘油醛-3-磷酸脱氢酶(GAPDH)上游引物序列:5′-TGTGGGCATCAATGGATTTGG-3′;下 游 引 物 序 列:5′-ACACCAT GTATTCCGGGTCAAT-3′。反应条件:95 ℃变性30 s、95 ℃退火5 s、60 ℃延伸31 s,40 个循环。扩增产物分别为105、116 bp,得到Ct值后用2-△△Ct方法计算结果。
1.3 统计学处理 应用SSPS11.0 统计软件进行数据分析,组间比较采用t 检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 细胞活力检测 细胞培养中,用CCK-8 检测细胞活力,连续检测4 d,可见肝癌细胞株HepG2、HuH7 及正常肝细胞株THLE-2的细胞增殖呈稳定上升趋势(图1),表明细胞生长状态良好,可以进行细胞水平mRNA 检测及裸鼠成瘤实验。
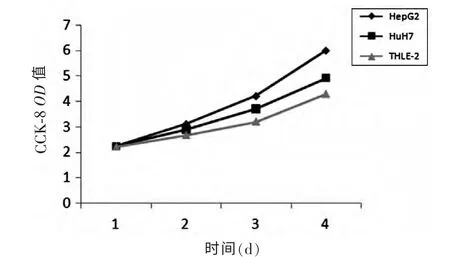
图1 肝癌细胞株HepG2、HuH7 及正常肝细胞株THLE-2 增殖曲线
2.2 HepG2、HuH7 及THLE-2 中RGS mRNA 的表达 3 种细胞抽提总RNA 进行琼脂糖凝胶电泳检测RNA 的完整性见图2。由图2 可见,所抽提总RNA 28 s 条带明亮,提示RNA 完整性好,未见降解,满足下一步逆转录反应及real-time PCR 的需要。real-time PCR结果显示,设THLE-2 细胞RGS17 mRNA 表达水平为1,HepG2、HuH7 细 胞RGS17 mRNA 表 达 水 平 分 别 为3.20±0.92、11.60±2.53,提示肝癌细胞HepG2、HuH7 表达水平明显高于正常肝细胞株THLE-2,差异有统计学意义(P<0.05),见图3。
图2 3 种细胞抽提RGS17总RNA 琼脂糖凝胶电泳图
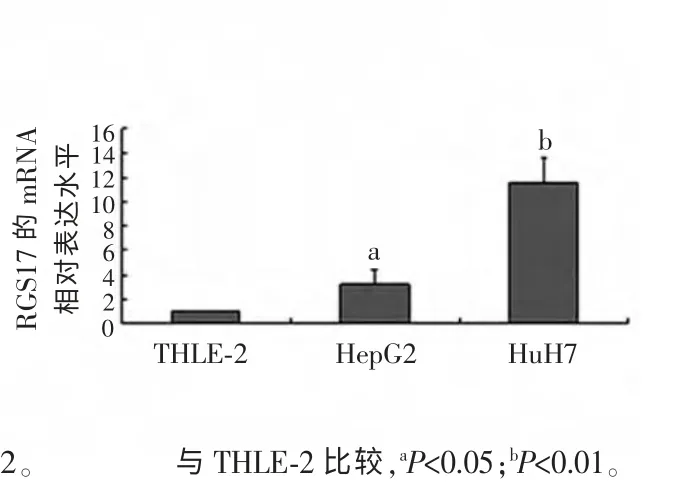
图3 RGS17 mRNA 在3 种细胞株中的表达
2.3 裸鼠成瘤模型的建立 模型组裸鼠在注射HuH7 细胞后12 d,在裸鼠左侧腹股沟处可见皮下瘤块形成,待其继续生长14 d后,用游标卡尺检测肿瘤瘤块大小,其体积如表1 所示。说明在裸鼠皮下移植肝癌细胞成瘤造模成功。
2.4 裸鼠瘤块组织及正常肝组织中RGS17 mRNA 的表达 用real-time PCR 方法检测裸鼠瘤块组织及肝组织中RGS17 mRNA的表达,发现模型组有8 只裸鼠瘤块组织中RGS17 mRNA 高表达,2 只裸鼠瘤块组织中RGS17 mRNA 低表达,见图4、5。
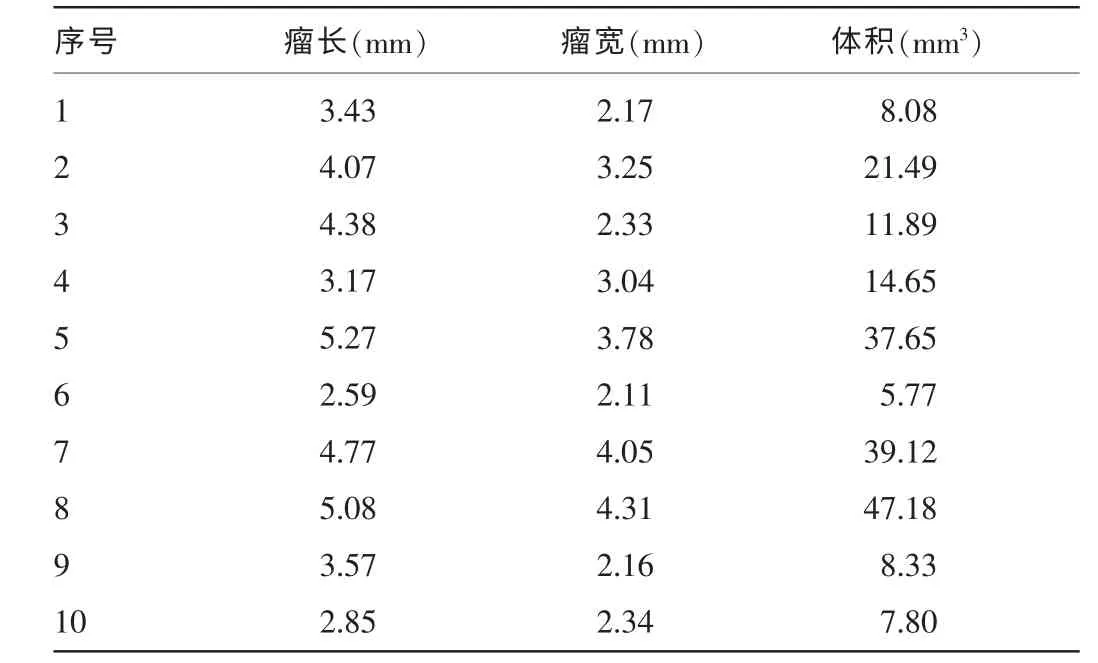
表1 模型组裸鼠瘤块生长情况(n=10)
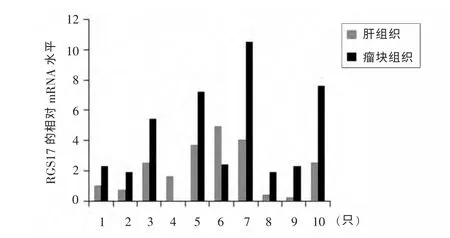
图4 裸鼠瘤块组织和肝组织中RGS17 mRNA 的表达
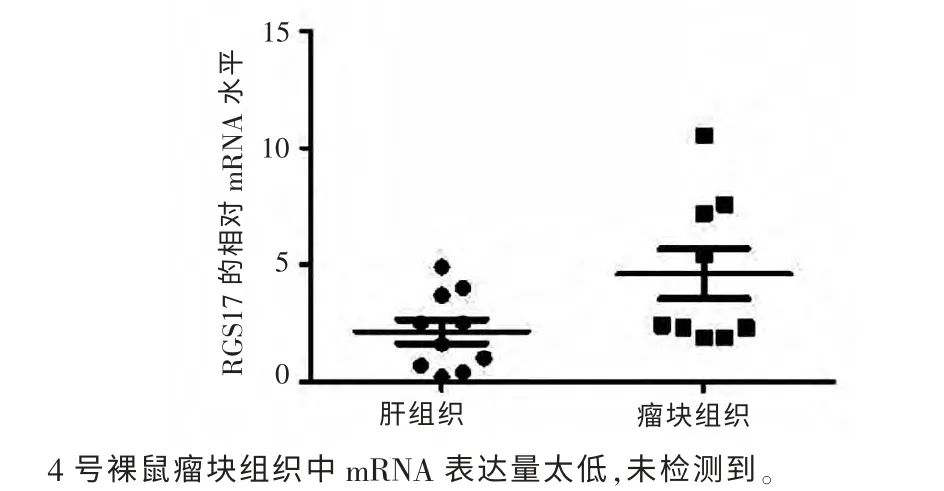
图5 瘤块组织和肝组织RGS17 mRNA 表达散点图
3 讨 论
肝癌在所有癌症中为高发肿瘤,在男性人群中排名第5 位,在女性人群中排名第7 位[3]。世界范围内每年约有60 万人死于肝癌,其在发展中国家发病率较高[4]。因此,目前对于肝癌发病机制的研究以及据此制定相应的预防、诊断和治疗策略,成为世界范围内迫切需要研究的重要课题。
G 蛋白位于细胞膜的内表面,是细胞膜表面受体和细胞内效应器的连接桥梁[5],可调节下游效应器如腺苷酸环化酶信号通路的活性[6]。G 蛋白信号通路在正常肝细胞的生长和再生中起重要作用[7]。在肝细胞癌患者和动物模型中G 蛋白的表达和功能失常。有文献报道,G 蛋白偶联受体87(GPR87)可促进肝癌细胞的增殖和迁移[8];GPR 5 在肝癌细胞表达异常,参与调节肝癌细胞的表型和生存[9]。除上述G 蛋白、GPR 在肝癌的相关研究外,RGS 逐渐被纳入人们的研究视线[10]。
RGS 调节G 蛋白信号转导的频率和持续时间、细胞内RGS蛋白的分布和活性决定G 蛋白信号转导的效率以及不同G 蛋白信号转导通路间的平衡调节[11]。已发表的关于RGS 的研究大多局限在神经系统[12],而在其他主要器官如肝脏的研究少见。最近有学者研究发现,RGS5 通过促进肝癌细胞从上皮到间质的转化来促进肝癌的转移[13];RGS19 则可以抑制RAS 诱导的肿瘤形成和转移[14]。
本研究以RGS17 为研究切入点,在体外细胞株和裸鼠动物体内2 个层面发现其在肝癌细胞中表达上调,提示RGS17 可能参与肿瘤的发生和发展,与其他RGS 参与肿瘤的报道互为印证,为肝癌发病机制的研究提供了新的思路,为肝癌的预防和治疗提供了新的分子靶点。但有关RGS17 促进肝细胞癌发生发展的具体机制和调节功能尚需进一步研究。
[1] Kawai Y,Arinze IJ.Glucocorticoid regulation of G-protein subunits in neonatal liver[J]. Mol Cell Endocrinol,1993,90(2):203-209.
[2] McKillop IH,Wu Y,Cahill PA,et al. Altered expression of inhibitory guanine nucleotide regulatory proteins(Gi-proteins)in experimental hepatocellular carcinoma[J].J Cell Physiol,1998,175(3):295-304.
[3] El-Serag HB,Rudolph KL.Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J].Gastroenterology,2007,132(7):2557-2576.
[4] Zhu LF,Hu Y,Yang CC,et al. Snail overexpression induces an epithelial to mesenchymal transition and cancer stem cell-like properties in SCC9 cells[J]. Lab Invest,2012,92(5):744-752.
[5] Gurevich VV,Gurevich EV. Rich tapestry of G protein-coupled receptor signaling and regulatory mechanisms[J]. Mol Pharmacol,2008,74 (2):312-316.
[6] Woehler A,Ponimaskin EG.G protein—mediated signaling:same receptor,multiple effectors[J].Curr Mol Pharmacol,2009,2(3):237-248.
[7] Diehl AM,Yang SQ,Wolfgang D,et al.Differential expression of guanine nucleotide-binding proteins enhances cAMP synthesis in regenerating rat liver[J].J Clin Invest,1992,89(6):1706-1712.
[8] Yan M,Li H,Zhu M,et al.G protein-coupled receptor 87(GPR87)promotes the growth and metastasis of CD133+cancer stem-like cells in hepatocellular carcinoma[J].PLoS One,2013,8(4):e61056.
[9] Fukuma M,Tanese K,Effendi K,et al. Leucine-rich repeat-containing G protein-coupled receptor 5 regulates epithelial cell phenotype and survival of hepatocellular carcinoma cells[J].Exp Cell Res,2013,319(3):113-121.
[10] Olechnowicz SW,Fedele AO,Peet DJ. Hypoxic induction of the regulator of G-protein signalling 4 gene is mediated by the hypoxiainducible factor pathway[J].PLoS One,2012,7(9):e44564.
[11] Xie GX,Palmer PP.How regulators of G protein signaling achieve selective regulation[J].J Mol Biol,2007,366(2):349-365.
[12] Burns ME,Wensel TG. From molecules to behavior:new clues for RGS function in the striatum[J].Neuron,2003,38(6):853-856.
[13] Hu M,Chen X,Zhang J,et al. Over-expression of regulator of G protein signaling 5 promotes tumor metastasis by inducing epithelial-mesenchymal transition in hepatocellular carcinoma cells[J].J Surg Oncol,2013,108(3):192-196.
[14] Wang Y,Tong Y,Tso PH,et al. Regulator of G protein signaling 19 suppresses Ras-induced neoplastic transformation and tumorigenesis[J].Cancer Lett,2013,339(1):33-41.

