神经电生理记录的原理与方法
蓝永生,蒋艳杰,张殿宇
神经电生理早在两百年前已被人们所知,但限于记录手段的制约,其发展较为缓慢。直到20世纪40年代,微电极技术的诞生把人们对神经电的认识带入了新的时代。在此基础上,随着计算机技术及高精密电子设备的研发,人们对神经电生理的研究进入了高速发展时期。如今,神经电生理记录技术已经成为研究神经功能的重要手段。
1 神经电信号
神经电信号是指在静息电位基础上所发生的膜电位变化。静息电位是指当神经元未受刺激时,细胞膜内外的电位差。静息电位的变化代表了神经元功能的活动状态。神经元膜电位变化分为局部电位和动作电位。局部电位包括突触后电位、感受器电位和效应器电位等,目前在神经电生理领域对突触后电位的研究较为广泛。突触后电位是指化学突触传递在突触后膜产生的突触反应,表现为膜电位偏离静息电位的变化。依据其变化的方向和对突触后神经元兴奋性的影响,可将突触后电位分为兴奋性突触后电位和抑制性突触后电位。兴奋性突触后电位是指前膜释放的兴奋性递质与突触后膜对应受体结合,使后膜Na+内流速度大于K+外流速度,导致突触后膜发生局部去极化,而产生兴奋性突触后电位。抑制性突触后电位是指前膜释放的抑制性递质使后膜Cl-大量内流,而产生抑制性突触后电位。由于突触后电位属于局部电位,所以其电位变化会随着距离的延长迅速衰减,不能进行长距离传导。但作用于同一神经元的多个突触后电位可进行整合,若多个未达到阈电位的突触后电位通过整合达到阈电位水平,便会引发动作电位。
动作电位是指神经元在静息电位基础上,受到刺激后膜电位所发生的快速变化过程。动作电位由峰电位和后电位组成,通常意义的动作电位主要指峰电位。峰电位包括从局部电位基础上迅速去极化的上升支和膜电位迅速复极化形成的下降支。上升支系由刺激引发大量电压门控Na+通道开放,在电压差和浓度差的共同驱动下,大量Na+内流产生去极化所致。下降支则是由上升支的去极化导致大量电压门控K+通道开放,大量K+外流产生复极化所致。动作电位是在局部电位基础上形成的,大小和形状固定不变,并且可进行长距离传播。动作电位是神经元兴奋和活动的标志,是神经信息编码的基本单元[1]。
2 神经电生理记录
由于神经元的活动主要表现在神经电信号的产生、变化和传播上,故对神经电记录和分析是研究神经活动过程的基本手段。目前对神经电信号的记录方式主要有细胞外记录、细胞内记录、膜片钳和脑电图技术等。
2.1 细胞内记录
细胞内记录的方法是将记录电极插入神经元胞体内,参考电极通常置于浴液内,记录神经元膜内的电位变化(图1)。当神经元接受兴奋性神经递质时,Na+内流使细胞内电压升高,此时记录电极处的电压和参考电极处电压差发生变化,经放大器放大后便是细胞内记录的神经元电活动。细胞内记录的原理是由于细胞膜相对溶液来说具有很大的电阻值,不易在膜两侧产生短路,也不易受到外界干扰,因此细胞内技术记录到的神经电活动较为真实,所记录到的信号幅度较大,通常为数毫伏至百余毫伏;记录到的神经元电活动信息比较全面,因此,细胞内记录是较为理想的神经电生理记录技术。
但由于此技术为单细胞记录,要求将记录电极插入胞体内,因此对电极的定位和记录的稳定性要求很高。通常动物的呼吸和心跳等正常生理活动都会对细胞内记录产生影响,因此在离体记录中应用比较广泛,而在清醒动物中成功率较低[2-4]。虽然近年来一些新技术的出现,如头部锚定技术[5],使在体细胞内记录成为可能,但其较低的成功率仍然是阻碍细胞内记录进一步发展的重要因素。此外由于细胞内记录使细胞受到物理损伤,导致细胞放电衰减,直至死亡,因此此技术不易进行长时间记录。

图1 细胞内记录
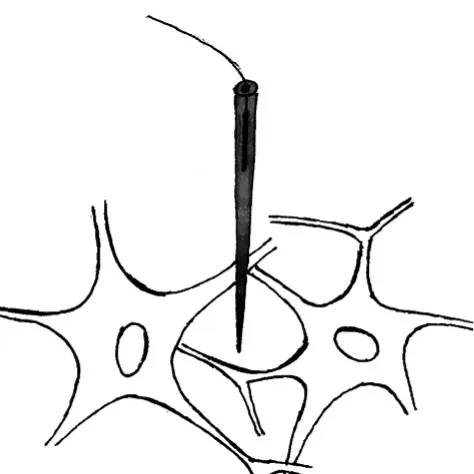
图2 细胞外记录
2.2 细胞外记录
细胞外记录是把记录电极插到被测神经元附近(图2)。而参考电极的位置通常会根据记录对象而有所不同。如记录在体脑部神经元,通常会把参考电极固定在颅骨上;而当记录离体切片时,通常会将记录电极放置在浴液中。此记录方法的原理是当记录电极附近神经元受到刺激时,细胞外液中带电离子进入细胞内,使细胞膜附近的细胞外液产生电压变化,并与参考电极处产生电压差。用这种方法记录脑部神经元时,可以记录到突触后电位和动作电位,但记录不到静息电位。而当记录周围神经时,只能记录到动作电位。因为用细胞外技术记录外周神经的方法通常是将记录电极和参考电极都放置在神经干上。记录的原理是根据动作电位具有长距离传导性。当动作电位依次传导至两个电极位置时,导致两个位置产生电压差。突触后电位由于不具备长距离传输型,因此不能被记录。
由于细胞外记录的电极不需穿过细胞膜,能够保持细胞功能的完好,因此能够保持真实的神经元电活动,也能够进行较长时间记录。基于此特点,细胞外记录目前被广泛应用于检测清醒动物的神经元电活动。
但由于记录电极位于各个神经元之间,缺少细胞膜的隔离,因此记录到的电位比较容易受到外界的干扰,即使电极尖端非常靠近神经元,仍然会受到周围神经元电活动的影响,记录到的电位实质为多个神经元共同放电的总和,常称作场电位。另外由于受细胞外液的分流作用,细胞外记录到场电位幅度非常小,通常为μ级。因此,细胞外记录不能精确地观察细胞的正常极化状态,所获得的信息较少。
但近年来发展起来的微电极阵列技术,使细胞外技术获得的信息量越来越多。此技术是在微区域内平均排列多个电极进行多点细胞外记录。如在直径约5mm的微区域内排列8×8个直径小于10um、间距最小30um的电极。运用此技术可在微区域内对神经组织进行较高空间和时间分辨率记录[1],以跟踪分析神经元电信号传输和处理过程,并可对学习和记忆过程进行进一步研究[6-10]。微电极阵列技术的出现促进了细胞外记录的进一步发展,成为神经元网络研究的重要技术。
2.3 膜片钳记录
膜片钳记录是对电极尖端吸附的细胞膜片进行膜电流记录的方法,是在电压钳基础上发展起来的一种新技术,可将细胞膜上一个通道的电位固定在一定水平,观察流过通道的离子电流。膜片钳记录属于单细胞记录,因此通常进行离体切片记录。记录的方法可分为细胞贴附式、全细胞记录、内面向外式和外面向外式[1]。
细胞贴附式是膜片钳技术中其它记录方法的基础。记录的方法是用微电极接触细胞膜,对微电极施加负压,使细胞膜吸附在微电极开口处,并形成GΩ以上的抗阻使之封接,在电学上使被封接的细胞膜与周围组织绝缘,并在此基础上固定电位,对被封接细胞膜上的离子电流进行记录(图3)。这种方式能够保持细胞的完整性,保证离子的跨膜运动按照正常方式进行。因此若被封接的细胞膜只有单个离子通道,便能够进行单通道记录。
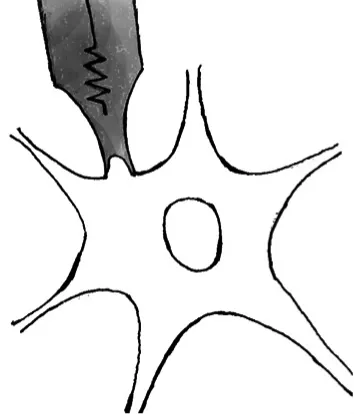
图3 细胞贴附式
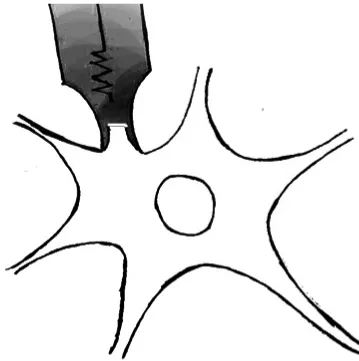
图4 全细胞模式
全细胞模式是在细胞吸附模式上给细胞膜进一步施加负压,将被封接膜片打穿,记录膜片以外部位的全细胞膜的离子电流(图4)。记录的原理类似于电压钳技术,当胞内有离子电流流出时,通过记录电极向胞内补充反向等量电流,以使膜电位数值保持不变。通过测量经过微电极的电流,间接分析细胞兴奋时的离子电流。此外,全细胞模式也可开展电流钳记录。电流钳记录的原理与细胞内记录相似,是通过破坏细胞膜,使记录电极与细胞内液直接接触,形成低阻抗连接。细胞膜相对细胞内液和细胞外液具有很高的抗阻,所以神经元产生的跨膜离子电流全部通过抗阻较小的穿孔处流入记录电极,从而记录到整个神经元的电位活动。因此,全细胞模式既能记录膜电位和动作电位,也能记录整个细胞的电流和不同的离子通道电流,此技术在神经生物学的研究中发挥着越来越重要的作用。
内面向外模式在细胞吸附模式基础上,将形成巨阻抗封接的膜片微电极向上提起,使膜片从细胞体上被切割下来(图5)。此模式的主要优点是可经浴液介导调控细胞内液的条件。外面向外模式是以全细胞模式为基础,将膜片微电极向上提起得到切割分离的膜片,膜外面自然封闭而对外(图6)。这种模式的主要优点是可经浴液介导自由改变细胞外液的条件。
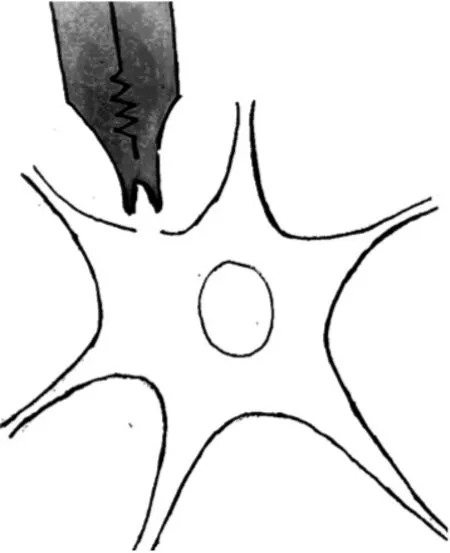
图5 内面向外模式
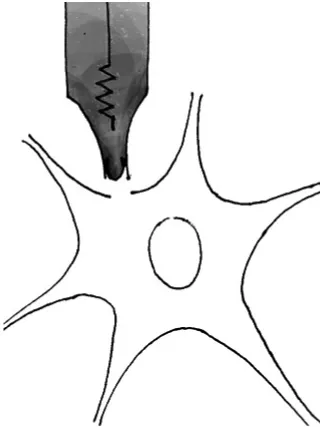
图6 外面向外模式
膜片钳技术的主要优点在于巨阻封接使露出的电流极少,能够正确地进行电压固定。而不足之处在于形成巨阻封接时形成的“Ω”膜片,对细胞造成了不可避免的机械性刺激。但膜片钳技术的发现对生理科学和神经科学都是一次有重大意义的变革,给生命科学带来了巨大的前进动力。而此技术的四种记录方式各有特点,应根据实验的目的和材料进行选取[11]。
2.4 脑电图技术
脑电图技术是用现代电子放大技术,从放置在头皮上的电极描记出脑神经细胞的自发生物电活动,通过脑电图仪加以放大后记录的脑电波形[12]。在实际应用中,除了可将记录电极放置于头皮表面外,还可以放置于皮质表面和皮质内部,参考电极需要放置于没有电位变化的部位,如耳垂、鼻尖和乳突部等。通常所提及的“脑电”是指头皮脑电[13]。
脑电图技术与细胞内记录、细胞外记录和膜片钳记录相比具有操作方便、记录过程无损伤等优点,因此被广泛应用于人类脑功能研究。此技术的记录原理与细胞外记录相似,由于神经元群同时发生电位变化,在其周围产生电场,与参考电极处产生电位差而记录到电位变化。不同之处在于脑电图技术的记录电极与发生电位变化的神经元之间相隔颅骨和头皮等高阻抗组织,并且距离较远,因此信号源需产生足够强的电场才能使带电离子到达头皮表面。动作电位由于不具备叠加性,且持续时间较短,致使形成的电场较小而很难被记录。而突触后电位由于可发生时空积累,具备形成“强大”电场的条件,因此关于脑电的来源,认同比较多的观点是来自突触后电位变化的总和。另外产生突触后电位的脑部神经元需具有排列紧密且方向一致的特点,这样有利于产生的电流在空间中的积累,而大脑皮质中锥体细胞恰好符合这一特点。因此通过脑电图技术记录到的电位变化实质为锥体细胞产生的突触后电位变化的总和。另外锥体细胞群接受相似的输入,并且以方向和时程相似的电位变化对输入作出响应,有利于产生的电流在同一时间积累。这些特点使锥体细胞群可累积较强的电场,从而穿透颅骨和头皮等组织而被采集。其它部分的神经元由于排列方向不一致,产生的电场相互抵消,而不能被记录[15]。目前此技术记录的自发脑电主要用于脑功能障碍性疾病的辅助诊断。而大脑除自发脑电之外,多数时间是在接受和处理刺激。大脑接收某种刺激后,在脑的特定区域出现的电位反应叫做诱发电位。
诱发电位是在自发脑电基础上形成的,其幅度较小,被掩盖在自发脑电中而很难分辨。但因为脑神经元接收特定的刺激后会在固定的时间内出现相同的电位变化,因此诱发电位具有潜伏期恒定和波形恒定两个特征。通过这一特征,可以通过给受试者重复进行特定刺激,将记录的数据进行叠加后再平均,就可以将随机变化的自发脑电抵消而提取到诱发电位。目前诱发电位被广泛应用于视觉、听觉和认知等领域研究。
记录电极和信号源距离较远,并且相隔颅骨和头皮等组织,带电离子到达头皮的过程中,会被分流到头皮其它位置,因此脑电图技术记录的是大脑中很多信号源产生的电位在记录点叠加起来的结果,而不能简单地把头皮对应的激活位置映射到皮层上去。基于此原理,脑电信号源的精确定位一直没有得到很好的解决。目前解决此问题的方法有间接推算法和直接测量法。简介推算法主要为脑电溯源分析,此方法是根据头表测量的电位信号,反演估计脑内神经活动源的位置、方向和强度信息。借助现有的高灵敏度电子设备,此方法可将脑电的时间分辨率精确到毫秒级。但由于脑部解剖结构较复杂,现有的溯源分析算法仍然缺乏准确性。直接测量法通常是将功能性磁共振成像技术与脑电技术结合,此方法可使空间分辨率达到毫米水平,但时间分辨率相对较小,通常以秒为单位,而脑部电活动通常以毫秒为单位,因此功能性磁共振成像技术在时间分辨率上还不能充分满足研究的需要。
3 展望
神经电生理技术是“窥视”神经活动的窗口,自诞生以来一直受到广大神经研究者的青睐。近年来其它新技术的不断涌现,对神经电生理技术的进一步发展起到了很强的促进作用。如无线遥测设备的小型化和轻量化,使人们观察自然环境中动物的神经电活动成为可能[15-17];光感调控技术的兴起,为人们研究特定神经元功能及神经环路等提供了新的方法[18]。随着神经电信号收集和处理技术的提高,以及其它辅助技术的发展,神经电生理技术将会在神经科学领域发挥越来越重要的作用。
[1]寿天德.神经生物学[M].北京:高等教育出版社,2001.
[2]Chorev E,Epsztein J,Houweling AR,Lee AK,Brecht M.Electrophysiological recordings from behaving animals—going beyond spikes[J].Current opinion in neurobiology,2009(19):513-9.
[3]Lee AK,Epsztein J,Brecht M.Head-anchored whole-cell recordings in freely moving rats[J].Nature protocols,2009(4):385-92.
[4]Lee AK,Manns ID,Sakmann B,Brecht M.Whole-cell recordings in freely moving rats[J].Neuron,2006(51):399-407.
[5]Epsztein J,Lee A,Brecht M.Whole-cell recordings of hippocampal CA1 place cell activity in freely moving rats[J].Soc Neurosci Abstr,2008,690:21-27.
[6]Berdondini L,Van Der Wal P,Guenat O,De Rooij N,Koudelka-Hep M,Seitz P,et al.High-density electrode array for imaging in vitro electrophysiological activity[J].Biosensors and bioelectronics,2005(21):167-74.
[7]DeMarse TB,Wagenaar DA,Blau AW,Potter SM.The neurally controlled animat:biological brains acting with simulated bodies[J].Autonomous robots.2001;11:305-10.
[8]Jimbo Y,Tateno T,Robinson H.Simultaneous induction of pathway-specific potentiation and depression in networks of cortical neurons[J].Biophysical Journal.1999;76:670-8.
[9]Mussa-Ivaldi FA,Miller LE.Brain-machine interfaces:computational demands and clinical needs meet basic neuroscience[J].TRENDSin Neurosciences.2003;26:329-34.
[10]Shahaf G,Marom S.Learning in networks of cortical neurons[J].The Journal of Neuroscience.2001;21:8782-8.
[11]陈军,电生理学.膜片钳实验技术[M]:科学出版社;2001.
[12]王维治,罗祖明.神经病学 CM3[M].北京:人民卫生出版社;2001.
[13]赵晔,王超.脑电图技术在针灸临床研究中的应用[J].Journal of Tianjin University of Traditional Chinese Medicine.2011;30.
[14]董盟盟,仲轶,徐洁,戴体俊,刘功俭.基于小波分析的脑电信号处理[M].电子设计工程.2012;20:59-61.
[15]Schregardus DS,Pieneman AW,Ter Maat A,Jansen RF,Brouwer TJ,Gahr ML.A lightweight telemetry system for recording neuronal activity in freely behaving small animals[J].Journal of neuroscience methods.2006;155:62-71.
[16]Jürgens U,Hage SR.Telemetric recording of neuronal activity[J].Methods.2006;38:195-201.
[17]Ye X,Wang P,Liu J,Zhang S,Jiang J,Wang Q,et al.A portable telemetry system for brain stimulation and neuronal activity recording in freely behaving small animals[J].Journal of neuroscience methods.2008;174:186-93.
[18]Berndt A,Yizhar O,Gunaydin LA,Hegemann P,Deisseroth K.Bi-stable neural state switches[J].Nature neuroscience.2008;12:229-34.
——从一道浙江选考生物学试题谈起

