亚临界水法提取新鲜紫薯中花色苷
王 锋,杨腾达,李 猷,杨巧芳,万端极
(1.湖北工业大学膜技术研究所,湖北武汉430068;2.湖北工业大学管理学院,湖北武汉430068)
紫薯属旋花科一年生或多年生双子叶草本植物[1]。新鲜紫薯的含水率为70%左右,纤维素含量一般为8%~13%,花色苷含量高达0.2mg·g-1。花色苷属于类黄酮化合物,是一种天然色素,具有抗氧化、抗肿瘤、护肝、预防心血管疾病、增进视力等保健功效[2],其清除自由基能力是维生素C 的20倍、维生素E的50倍[3-4]。在食品、医药等领域对花色苷的需求量较大。
亚临界水是指在一定压力下(低于临界压力22.1 MPa),将水加热到100~374.2 ℃[5],水体仍然保持液体状态,因此,也称“过热水”或“高压水”,与常压水相比,其溶解能力和渗透能力都有较大的提高,同时亚临界水会使蛋白质、淀粉等变性,有利于后续的分离、纯化[6],因此,被广泛应用于天然产物的提取,具有提取物质量好、提取时间短、安全环保、成本低等优势。
目前,已有研究者使用含乙醇的亚临界水从紫薯粉中提取花色苷,但是利用亚临界水从新鲜紫薯中提取花色苷的工艺研究鲜有报道。基于此,作者在此采用亚临界水从新鲜紫薯中提取花色苷,以期为新鲜紫薯中花色苷的提取提供新途径。
1 实验
1.1 材料与仪器
新鲜紫薯(宁紫薯1号),由中国农业科学院甘薯研究所育种室提供。
FW80型高速万能粉碎机,天津泰斯特仪器有限公司;722型紫外可见分光光度计,上海校光技术有限公司;HA-1型亚临界水提取装置,江苏华安科研仪器有限公司;TDL-5 型离心机,上海安亭科学仪器厂;LGJ-10C型高速冷冻干燥机,湖南湘仪实验室仪器开发有限公司。
1.2 方法
1.2.1 花色苷的提取
提取工艺流程:新鲜原料→磨浆→绢布过滤→亚临界水提取→离心→真空冷冻干燥→花色苷。
1)磨浆:取新鲜紫薯,洗净,切碎,加2倍原料质量的去离子水在高速万能粉碎机中磨浆,避光,备用。
2)亚临界水提取:将磨好的浆投入到亚临界水提取装置中,压力设定为1MPa(因亚临界提取方法对压力的要求较低,一般为1~6 MPa,目标物的提取率可通过改变温度来提高[7]),向提取装置内吹入氮气,以赶走釜内空气,同时充当保护气。加入一定的提取剂(去离子水),升高到一定温度,提取一定时间后,利用加压泵使提取物随亚临界流体到达分离釜,通过减压、降温等措施使提取物回到常温、常压状态。
3)离心分离:将提取液于8 000r·min-1离心20 min,取上清液。
4)冷冻干燥:将上清液放入高速冷冻干燥机内冷冻干燥,即得花色苷。
1.2.2 提取工艺优化
首先采用单因素实验考察提取温度、提取时间、液料比(mL∶g,下同)、pH 值对花色苷提取率的影响,然后采用L9(34)正交实验确定最优提取工艺。
1.2.3 测定方法
取冷冻干燥后的样品1g,用去离子水定容到100 mL,调pH 值为3.0,摇匀。以空白作对照,用1cm 比色皿在536nm 处测定吸光度,分别按式(1)、(2)计算花色苷提取率和色价(E)。

式中:A为吸光度,通过稀释样品浓度控制吸光度在0.2~0.7范围内;V为最终体积(mL);DF为稀释倍数;W为样品质量(g);98.2为1%的花色苷1 mol吸光系数[8]。
2 结果与讨论
2.1 最大吸收波长的确定
取冷冻干燥后的样品,稀释合适的倍数,参照文献[9],设定pH 值为3.0。用紫外可见分光光度计在300~600nm 进行光谱扫描,结果如图1所示。

图1 花色苷的紫外可见吸收光谱Fig.1 UV-Vis Absorption spectrum of anthocyanins
由图1可看出,花色苷的紫外可见吸收光谱有2个吸收峰,分别位于329nm 和536nm 处。由于329 nm 靠近紫外光,因此将536nm 作为花色苷在紫外可见光区域的最大吸收波长。
2.2 单因素实验
2.2.1 提取温度对花色苷提取率的影响
在提取时间为15 min、液料比为8∶1、pH 值为3.0的条件下,考察提取温度对花色苷提取率的影响,结果见图2。
由图2可看出:随着提取温度的升高,花色苷提取率先缓慢上升后下降,在115 ℃时,提取率达到最高;在105~130℃之间,提取温度对花色苷提取率的影响不显著;当提取温度超过130℃时,花色苷对高温较敏感,提取率较低。这可能是由于,温度升高加快了水分子的对流,水的极性降低,提高了其溶解能力,提取率相应提高;当提取温度超过115℃后,由于高温促进了水分子对花色苷的破坏作用或花色苷的降解,导致紫薯中一部分淀粉糊化,阻止亚临界水对花色苷的溶解,提取率下降,提取液颜色逐渐加深,在145℃时变为棕色。因此,选择提取温度为115 ℃较为适宜。

图2 提取温度对花色苷提取率的影响Fig.2 Effect of extraction temperature on extraction rate of anthocyanins
2.2.2 提取时间对花色苷提取率的影响
在提取温度为115 ℃、液料比为8∶1、pH 值为3.0的条件下,考察提取时间对花色苷提取率的影响,结果见图3。
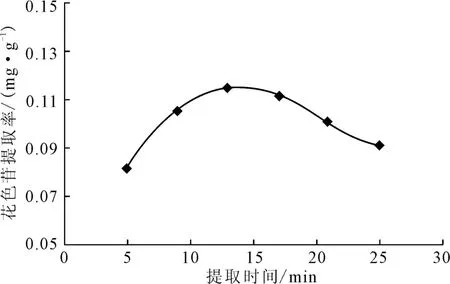
图3 提取时间对花色苷提取率的影响Fig.3 Effect of extraction time on extraction rate of anthocyanins
由图3可看出,花色苷的提取率随着提取时间的延长先上升后下降,当提取时间为13min时提取率达到最高。这可能是由于,亚临界水在高温高压下,其溶解能力和渗透能力都有较大的提高,从而在短时间内就可以提高提取率;而长时间的高温高压会导致花色苷分解,降低提取率。因此,选择提取时间为13 min较为适宜。
2.2.3 液料比对花色苷提取率的影响
在提取温度为115 ℃、提取时间为13min、pH 值为3.0的条件下,考察液料比对花色苷提取率的影响,结果见图4。

图4 液料比对花色苷提取率的影响Fig.4 Effect of liquid-material ratio on extraction rate of anthocyanins
由图4可看出:在液料比为3∶1~8∶1范围内,花色苷提取率先上升后下降,在液料比为6∶1时达到最高;当液料比超过8∶1时,提取率变化不明显。这可能是由于:增大液料比,可以增大亚临界水与花色苷的接触面积,从而提高花色苷的提取率;但液料比过大,提取液的固形物含量迅速降低,提取率相应降低。另一方面,液料比过大导致后续干燥过程能耗变大;若液料比过小会导致反应釜糊锅,且搅拌困难,使机器不能正常运行。因此,选择液料比为6∶1较为适宜。
2.2.4 pH 值对花色苷提取率的影响
在提取温度为115 ℃、提取时间为13 min、液料比为6∶1的条件下,考察pH 值对花色苷提取率的影响,结果见图5。

图5 pH 值对花色苷提取率的影响Fig.5 Effect of pH value on extraction rate of anthocyanin
由图5可看出,pH 值在2.0~4.0 时,对花色苷提取率的影响不是很大,且在pH 值为3.0时,花色苷提取率达到最高(0.134 mg·g-1),颜色也较好。这是因为,pH 值的变化会导致其主体骨架由三环共面结构转化为三环不共面结构,从而引起花色苷色泽的变化。在低pH 值溶液中,呈红色的2-苯并吡喃盐以共振结构形式存在,稳定性较好;pH 值升高,无色的假碱比例开始上升,加速了花色苷的降解[9],从而导致提取率降低。因此,选择pH 值为3.0较为适宜。
2.3 正交实验
在单因素实验的基础上,以提取温度(A)、提取时间(B)、液料比(C)、pH 值(D)为考察因素,以花色苷提取率为考核指标,进行L9(34)正交实验优化提取工艺,结果见表1。
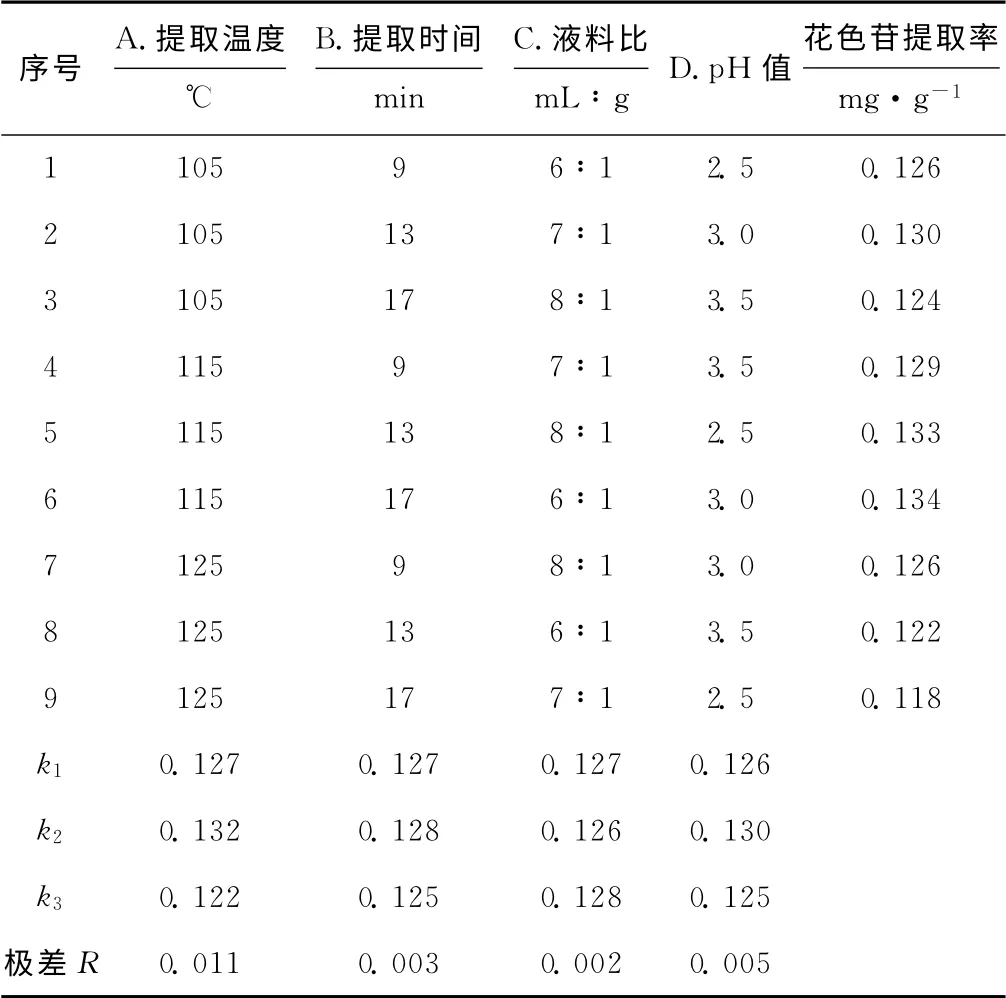
表1 正交实验结果与分析Tab.1 Results and analysis of L9(34)orthogonal experiment
由表1可看出,新鲜紫薯亚临界水法提取花色苷的最佳工艺条件为A2B2C3D2,即提取温度115 ℃、提取时间13min、液料比8∶1、pH 值3.0。各因素对提取率的影响大小依次为:提取温度(A)>pH 值(D)>提取时间(B)>液料比(C),提取温度对提取率的影响最大。
2.4 验证实验
在上述最佳工艺条件下,进行3次重复实验,花色苷平均提取率为0.139mg·g-1。表明所得最优工艺条件可行。
2.5 与水提法的比较
万莹等[8]采用水提法提取紫薯中的花色苷,其产品质量是用色价来表示的。为比较不同方法的提取效果,将本实验最优提取条件下所得最终产品按文献[8]中粗提液相同的固含进行溶解,对比色价指标,结果见表2。
由表2可知,与文献水提法相比,在固含相同的情况下,亚临界水提取法所得产品色价提高了6.2%。因此,可以考虑将亚临界水提取与膜技术相结合,进一步提升产品色价。

表2 亚临界水提取法与水提法的比较Tab.2 Comparison of sub-critical water extraction method and water extraction method
采用亚临界水提取新鲜紫薯中的花色苷优于传统的热水浸提法和有机溶剂法。可能是因为,亚临界水提取法在提高水的渗透能力和溶解能力的同时,避免了由于高温提取使花色苷变性和分解的缺陷,使新鲜紫薯中的花色苷保留其原有特性,更有利于提取质量好、色价高的花色苷;另一方面,亚临界水提取法可使蛋白质、淀粉等变性,给后续的分离纯化带来方便。
3 结论
通过单因素实验和正交实验确定亚临界水提取新鲜紫薯花色苷的最佳工艺条件为:提取温度115℃、液料比8∶1(mL∶g)、提取时间13min、pH 值3.0,在此条件下,新鲜紫薯花色苷提取率为0.139mg·g-1,产品色价提高了6.2%。为花色苷的进一步纯化和活性研究奠定了基础,也为紫薯的开发利用提供了参考。
[1]WOOLFE J A.Sweet Potato,An Untapped Food Resource[M].Cambridge:Cambridge University Press,1992:13-16.
[2]孙金辉,王微,董楠.紫薯花色苷的研究进展[J].粮食与饲料工业,2011,(11):38-40.
[3]吕丽爽,曹栋.葡萄籽中低聚原花青素的抗氧化性的研究[J].食品科技,2000,(4):41-42.
[4]吕丽爽.天然抗氧化剂低聚原花青素的研究进展[J].食品科学,2002,23(2):147-150.
[5]娄冠群,张永忠,李振艳,等.亚临界水提取香菇多糖的工艺研究[J].东北农业大学学报,2010,(2):138-142.
[6]郭娟,丘泰球,杨日福,等.亚临界水萃取技术在天然产物提取中的研究进展[J].现代化工,2007,27(12):19-24.
[7]杜连启,李润丰,程浩,等.紫甘薯色素的提取工艺及其稳定性研究[J].中国调味品,2006,(6):46-50.
[8]万莹,杨青,谢鑫,等.膜技术用于紫薯花色苷色素分离纯化的工艺研究[J].中国食品添加剂,2012,(2):86-89.
[9]吴昊,于国萍,宋岩.紫甘薯色素亚临界水萃取条件优化[J].中国调味品,2012,37(11):106-110.

