地红霉素肠溶片释放度的测定
杨昌华,朱慧芳
(湖南师范大学医学院,湖南 长沙 410013)
地红霉素(dirithromycin)是第二代红霉素类大环(十四元环)内酯类抗生素,由红霉环胺与脂肪醛酸综合而成。体内非酶水解为红霉环胺,通过与敏感病原微生物的50S 核糖体亚基结合阻碍细菌转肽过程,抑制蛋白质的合成而抗菌。体外试验证明地红霉素对临床上多种常见致病菌有抗菌作用。地红霉素具有与红霉素相似的抗菌谱,其特点是药动学性质优良,半衰期长达20 ~50h,不良反应相对较小[1,2]。
美国Lilly 公司的产品于1993年9月在西班牙上市,1996年通过FDA 批准在美国上市并收入美国药典USP 23。目前国内有多家研制的地红霉素肠溶片和肠溶胶囊获准生产并用于临床。本文应用硫酸显色法测定自制地红霉素肠溶片的释放度,并通过计算相似因子判断其与原仿药品的相似程度。
1 实验仪器与试剂
1.1 仪器
UV-2501PC 紫外扫描仪(岛津),Rcz-6B2 型释放度仪(上海黄海药检仪器有限公司),FW-5 型压片机(天津市拓普仪器有限公司),MS/S-MS/L 系列电子分析天平(梅特勒),KQ-500E 型超声波清洗仪(昆山市超声仪器有限公司),CCT-3320 型超纯水制备仪(重庆力德),PHs-2c pH 酸度计(上海仪电),0.45um 微孔滤膜(上海兴亚净化器材厂)。
1.2 试药与试剂
地红霉素(白色粉末湖南九典制药有限公司),地红霉素肠溶片[嘉实(湖南)医药科技有限公司,0.25g,121117],地红霉素肠溶片(参比制剂,湖南九典制药有限公司,0.25g,110302),氢氧化钠(分析纯,天津市风船化学试剂科技有限公司,20111008),磷酸氢二钾(分析纯国药集团化学试剂有限公司,20100124),无水磷酸二氢钾(分析纯,天津市科密欧化学试剂有限公司,20120524),盐酸(分析纯,株洲市星空化玻有限公司,20110916),硫酸(分析纯,株洲市星空化玻有限公司,2012062504),超纯水(自制)。
2 实验方法与结果
2.1 方法建立
参照文献[3-7],以900mL pH6.8 磷酸缓冲液溶液为溶出介质,转速为100 r/min 的大杯转篮法,硫酸显色后482nm 测定释放度。
2.1.1 溶液配置
2. 1. 1. 1 对照溶液配置 取地红霉素适量(11mg),精密称定置100mL 容量瓶中,加pH6.8 磷酸缓冲液溶解并稀释至刻度,摇匀。过滤,取续滤液5mL 置10mL 容量瓶中,加pH6.8 磷酸缓冲液稀释至刻度,摇匀。取5mL 置10mL 具塞试管,加硫酸(75→100mL)5mL,摇匀,静置至室温得对照溶液[11]。
2.1.1.2 供试溶液配置 取地红霉素肠溶片6 片,溶出仪溶液杯中加入溶出介质,调节转速为100 r/min,温度为37℃,分别于3、7、10、13、16、20min 取样10mL(并补液10mL),微孔滤膜(0.45μm)过滤,取续滤液5mL 置25mL 容量瓶中,加pH6.8 磷酸缓冲液稀释至刻度,摇匀。取5mL 置10mL 具塞试管,加硫酸(75→100mL)5mL,摇匀,静置至室温即为供试溶液[11]。
2.1.2 检测波长的确定[7]
在190 ~1100nm 扫描对照溶液,482nm 波长处有最大吸收,选为释放度的测定波长。
2.1.3 溶出介质的选择[8-9]
根据地红霉素的溶解性、地红霉素肠溶片试行标准及国内常用的溶出介质,在pH6.0 磷酸盐缓冲液、pH6.8 磷酸盐缓冲液、纯化水中选择。
地红霉素肠溶片在纯化水中45min 时不裂片,与对照药品的情形一致,故排除纯化水。采用篮法[10],转速100 r/min,45 min 取样,精密量取续滤液5mL,置25mL 量瓶,加溶出介质至刻度,摇匀,482nm 波长处测定吸收值。结果表明45min 时本品在pH6.8 磷酸缓冲液中的释放度最高,其pH 值更接近肠道酸碱度,故确定pH6.8 磷酸缓冲液为溶出介质。
2.1.4 硫酸浓度的确定[7]
取硫酸及硫酸溶液(50 →100mL)、(75 →100mL)分别测定,每个样本测3 次,分别用A1、A2、A3 表示,然后取平均值。结果表明(75→100mL)硫酸溶液最佳。
2.1.5 超声时间的选择
精密称取11mg 地红霉素对照品于25mL 容量瓶中,记录其在pH6. 8 磷酸缓冲液的超声溶解时间。再分别取17.6mg 地红霉素肠溶片片粉三份置100mL 容量瓶中,加入pH6.8 磷酸缓冲液,每5min测定一次。结果表明超声时间对吸光度无影响RSD=1.01%(n=3),超声时间设置为1 ~2min。
2.1.6 转速的选择
依据文献[9],转速分别为75 r/min,100 r/min,120 r/min。pH6.8 磷酸缓冲液为溶出介质,20 min取样,过滤,取续滤液5 mL,以溶出介质稀释至25 mL,测定,计算释放度。结果表明在pH6.8 磷酸缓冲液中,转速100r/min 和120r/min 释放度符合要求(RSD 分别为1.26%和1.12%,n =6),100r/min更接近胃蠕动频率,故选择转速100r/min。
2.2 释放度测定方法的验证
2.2.1 专属性
称取按处方配制的空白辅料适量,pH6.8 磷酸缓冲液溶解,过滤,取滤液及pH6.8 磷酸缓冲液、硫酸溶液以及硫酸和pH6.8 磷酸缓冲液的混合溶液在190 ~700nm 分别扫描。
图谱显示,处方中的辅料、溶出介质以及显色试剂对测定无影响,测定方法专属。
2.2.2 稳定性[9-15]
取同批样品(121117)3 片,照2.1.1.2 配制供试品溶液,分别于0、0.5、1、1.5、2、3、4、6、8 小时取样测定,记录吸收值,相对标准偏差0.17%。结果表明溶液8 h 内稳定。
2.2.3 精密度[9-15]
取地红霉素肠溶片10 片,精密称取相当含药量27.5mg 的粉末,照2.1.1.2 配置溶液;另精密称取对照品约27.5mg,照2.1.1.1 配置溶液,482nm 测定6 次吸光度,相对标准偏差0.08%。结果表明方法的精密度高。
2.2.4 线性与范围[9-15]
精密称取地红霉素对照品15.60 mg 于100 mL容量瓶中,加pH6. 8 磷酸缓冲液溶解并稀释至刻度,过滤。精密取续滤液1、2、3.5、5、7、9、10mL 于25mL 容量瓶中,加pH6.8 磷酸缓冲液稀释至刻度,取5mL 置10mL 具塞试管,加5mL 硫酸溶液(75→100mL),摇匀。482nm 测定。3.12 ~31.2μg/mL,A=0.018C + 0.026,R2=0.999,线性良好。
2.2.5 回收率
(1)地红霉素肠溶片的含量测定:取地红霉素肠溶片30 片,分三组,精密称定,研细。精密称取相当于地红霉素27.5mg 的粉末三份,照2.1.1.2 配制,平行取两份;再精密称取对照品27. 5mg,照
2.1.1.1 配制,482nm 测定吸光度,释放度56.79%,相对标准偏差1.66%。
(2)加样回收率:取已测定含量的地红霉素肠溶片10 片,研细,精密称取相当于含药量27.5mg的粉末三份,分别加入对照品22mg、27.5mg、33mg,照2.1.1.2 加pH6.8 磷酸缓冲液溶解稀释至刻度,过滤,分别取续滤液2.5mL 于25mL 容量瓶中,用pH6.8 磷酸缓冲液稀释至刻度(三份),再取该液5mL 于10mL 具塞试管,加5mL 硫酸(75→100mL)摇匀;精密称取对照品27.5mg,照2.1.1.1 配制。482nm 测定吸光度,平均回收率99.18%,相对标准偏差1.18%。
溶出加样回收率为99.18%,在98% ~102%范围内,相对标准偏差RSD =1. 18% (n =9),小于2%,符合测定要求。表明样品地红霉素的回收率良好。
2.3 溶出测定取样时间及溶出限度的确定
2.3.1 累积溶出曲线研究
测定方法:37 ±0.5℃,转篮法,100r/min,溶出介质为900mLpH6.8 缓冲溶液,3、7、10、13、16、20分钟取样10mL,补液10mL(pH6.8 磷酸缓冲液),精密量取续滤液5mL 稀释至25mL,482nm 测定。样品:121117、121118、121119、参比制剂(湖南九典出品),由测定结果绘制累积溶出曲线图,如图1。
计算得f2值[15]分别为99、99、99,且样品溶出曲线基本重合,溶出行为稳定,表明与参比试剂溶出曲线极其相似。
2.3.2 均一性
取121117 批样品,按上述溶出条件,每次6 片,共6 次,测定其在20 min 时的释放度,结果见图2。

图2 均一性试验曲线
结果表明三批样品在20 min 内达到完全溶出,且释放度均达到95%以上,均一性良好。
根据以上试验结果及对溶出曲线的分析,释放度的限度规定为经45min,释放度不得少于80%,而本品显然在释放过程中达到释放度的限度要求。
2.4 溶出方法的确定
取本品,照释放度测定法[7],以pH6.8 缓冲液900mL 为溶剂,转速为100r/min,依法操作;20min时,取溶液10mL,过滤,精密量取续滤液5.0mL,加pH6.8 缓冲液稀释至25mL,摇匀;另精密称取地红霉素对照品适量,加pH6.8 缓冲液溶解并稀释成每1mL 中约含地红霉素27.5μg 的溶液;取上述两溶液,反应后,在482nm 波长处分别测定吸收值,计算每片的释放量。限度为标示量的80%。
以上法测定三批样品及参比制剂结果见表10。

表10 三批样品测定结果
三批样品及参比制剂的释放度均在80%以上。本释放度测定方法专属性,准确、灵敏、可靠。
采用pH6.8 磷酸缓冲液、100 r/min 大杯转篮法,硫酸(75 →100)显色,482nm 测定吸光度的方法,可简便、专属、精密、快捷的测定地红霉素肠溶片的释放度。
3 讨论
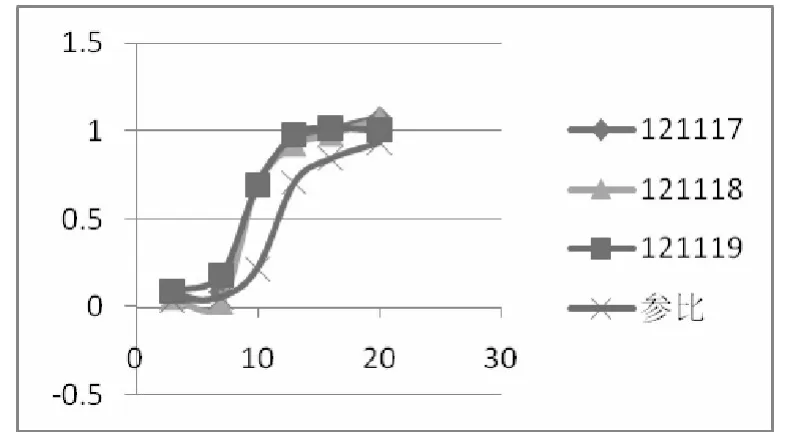
图1 样品及参比制剂累积溶出曲线
目前地红霉素肠溶片释放度的测定方法主要有美国药典(USP34)中采用了口占吨氢醇显色法;我国的试行药品标准中采用了硫酸显色法;另外,还可以采用含量测定的HPLC 法进行释放度的测定。对于前者,试剂较难得到,国内多数单位不具备此条件;而对于后者,由于地红霉素缺乏分析上很好利用的紫外吸收区,一般采用末端吸收波长进行检测,这对于分析实验条件及试剂要求较高。而硫酸显色法虽然专属性相对较低,但操作快速简单。根据本文考察,对于地红霉素肠溶片释放度试验,硫酸显色法是一种较好的测定方法。
本文对地红霉素肠溶片进行释放度的测定,其测得的结果均在20min 内达到溶出标示量的95%以上,符合《中国药典》2010 版要求。
由于实验条件有限,转篮法和浆法的比较在转速上会有差异,并且在美国药典(USP34)中直接选择了转篮法,所以最终未通过试验数据来验证释放度方法中溶出方式的选择,而直接选择了转篮法。
释放度试验是区分药物固体制剂体外溶出速率的一种手段,它的应用指导了新药的研究,增加了控制药物质量的检查项目,客观评价了口服固体制剂,提高了制剂的质量。释放度的研究和应用不断促进了药物研制水平,强化了药品质量控制手段,在药物的研制、生产和指导临床用药方面具有重要的意义。
溶出相似因子f2计算公式:Ynt= (1/n),式中Ynt为平均释放度;YTt)2,Q 为试验药品与对照药品的平均释放度的方差和;
f2=50 × lg[(1 + Q/n)-0.5×100],如果50 ≤f2≤100,则表示释放度相似。
[1]张宇迪,夏海波,王仲.长效安全的大环内酯类抗生素-地红霉素[J].中国临床药理学杂志,2011,6(27):467-471.
[2]安明,常珍,高雷,李梅.地红霉素的合成[J].中国抗生素杂志,2004,29(9):426-528.
[3]王若伦,陆志诚,杨俊河. 阿奇霉素片及胶囊释放度考察[J].1999,9(2):14-15.
[4]陶兆林,李文戈,史效海.糖和酸碱反应的研究与应用[J].淮北煤师院学报,1999,20(4):62-64.
[5]薛强.释放度的测定和评价方法[J].药物研究,2008,35:73-74.
[6]国家药监局药品审评中心.普通口服固体制剂释放度试验技术指导原则[P].2012.10:6-7.
[7]国家药典委员会.中华人民共和国药典(二部)[M]. 北京:人民卫生出版社,2010.附录85.
[8]谢沐风.改善释放度评价方法,提高固体药物制剂水平[J].中国医药工业杂志,2005,36(7):447-451.
[9]丁玉娟,韩振为,于振国,西尼地平片制剂工艺研究[J]. 天津大学化工学院,2008,(4):45-53.
[10]USP XXX Ⅳ. Dirithromycin and Dirithromycin Delayed-Release Tablets[S].2011.
[11]苏佳妍,刘晓红,孙英华,等.硝苯地平片剂释放度的考察[J].沈阳药科大学学报,2007,24(4):193-196.
[12]张余霞,符方非.小儿氨酚黄那敏片中对乙酰氨基酚释放度方法学研究[J].制剂与技术,2009,16(15):147-148.
[13]谢沐风,操洪欣.释放度测定中的若干问题[J].中国医药工业杂志,2006,37(12):859-861.
[14]孔爱英,谢沐风,郭长君,等. 卡马西平片释放度方法学比较以及溶出曲线评价方法[J].中国药事,2011,25(2):162-165.
[15]李桂玲,李眉.地红霉素肠溶片释放度测定方法的研究[J]. 中国抗生素杂志,2007,2,32(2):91-94.

